乳化液破乳实验.docx
《乳化液破乳实验.docx》由会员分享,可在线阅读,更多相关《乳化液破乳实验.docx(13页珍藏版)》请在冰豆网上搜索。
乳化液破乳实验
乳化废水处理实验方案
一、乳化液破乳实验
(1)目的:
通过实验确定混凝气浮破乳的最佳参数,例如:
混凝剂的投加量、助凝剂的投加量、pH值等。
(2)实验过程:
此次试验的原水来自XXXXXXXXX有限公司的乳化液废液,其水质的主要指标:
CODXXX
104mg/L、SS:
mg/L、pH值左右、BOD5mg/L。
1.混凝剂投加量的确定
此次实验采用的混凝剂是PAC,即聚合氯化铝。
选用的浓度为100g/L。
调整水样的PH值为最佳值,向水中滴加PAC,在滴加的过程中需要缓慢的搅拌直至出现矾花为止。
然后,静止10分钟,取上清液测量CODcr,计算CODcr的去除率,去除率越大,混凝的效果就越好。
实验步骤:
选择八个100ml的烧杯,在烧杯中加入100ml的原水,调节其pH值在8左右,向其中滴加不同量的PAC,缓慢搅拌。
静置10分钟,分离出下层清液。
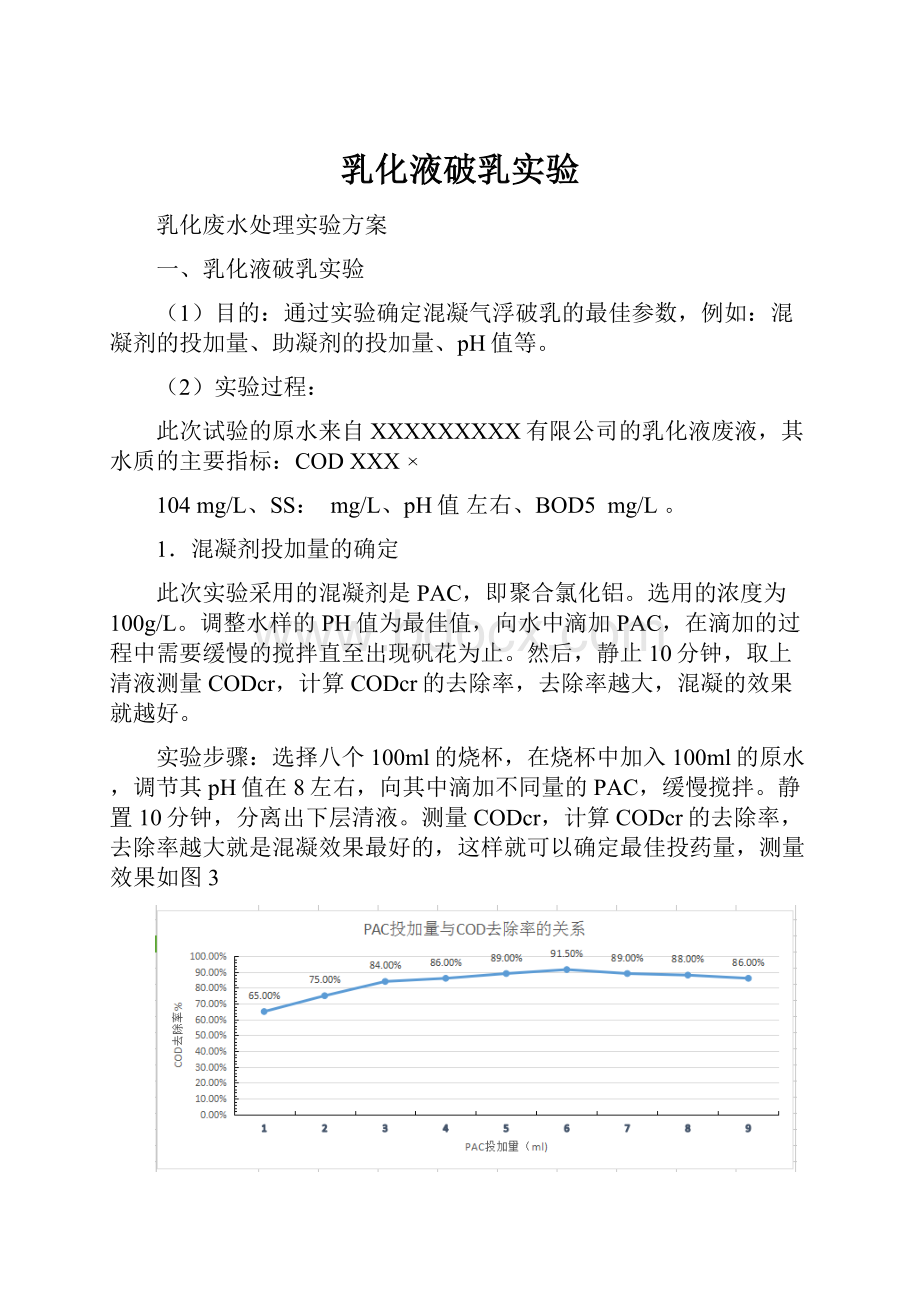
测量CODcr,计算CODcr的去除率,去除率越大就是混凝效果最好的,这样就可以确定最佳投药量,测量效果如图3
图1PAC投加量与COD去除率的关系
由图1可知,在pH值一定的条件下,可以随着混凝剂加入量的逐渐增大,而当混凝剂加到一定量时,CODcr的去除率反而上升,上层的清液也逐渐变得混浊。
这是由于加入的聚合氯化铝逐渐溶解分散到溶液中去。
又有铝离子带有部分正电荷,而乳化液大多数都含有阴离子表面活性剂。
这样,会通过压缩双电层,吸附点中和,吸附架桥,网捕作用达到凝聚,絮凝的效果。
随着混凝剂量的逐渐增大,这四种混凝作用的效果也逐渐增强,直至达到最佳效果,再过量地加入混凝剂,溶液中存在过量的铝离子,产生水解,将会形成胶体,再次达到胶体的稳定,使CODcr值有些许升高的现象。
所以,在混凝的过程中要严格控制混凝剂的投加量。
由此次试验可以确定:
100ml原水加6ml的PAC(浓度为100g/L)混凝效果最佳。
2.pH对混凝效果的影响
实验步骤:
分别取9份100mL的原水,分别调节pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5,均加入6mlPAC(最佳投加量),搅拌,静置10分钟,分离出清液,测定其pH值,并测量COD。
见图2:
图2pH值与COD去除率的关系
由图2可知,在pH在8.5左右的时候,投加6ml的PAC时,COD的去除率最好,混凝效果达到最好。
可见,pH值对混凝效果的影响很大。
所以在混凝过程中应控制pH值8.5左右。
3.助凝剂投加量的确定
此次实验所采用的助凝剂是PAM,即聚丙烯酰胺,选用的浓度为2g/L。
取6个250ml的烧杯,加入100ml的原水,再向其中加入6ml的PAC,搅拌。
向其中分别加入0.5ml、1ml、1.5ml、2ml、2.5ml、3.0ml的PAM,搅拌。
静止10分钟。
取上层清液,测量COD,计算COD的去除率。
见图3
图3PAM投加量与COD去除率的关系
由上图可知,当PAM的投加量为ml时,COD的去除率,混凝效果最佳。
可见,
2、乳化液深度处理实验-芬顿实验
Fenton试剂即过氧化氢与亚铁离子的结合,是一种特效氧化剂,其氧化电极电位高达2.80V;Fen2ton试剂催化氧化用于工业废水处理已有三十年历史,他最早用于处理苯酚和烷基苯废水[1]。
该氧化剂具有极强的氧化能力,适用于难降解有机废水的处理,而且对那些有毒有机物和三致物[2]具有很好的分解能力。
近年来,有关Fenton试剂处理有机废水的研究较多,如纺织印染废水[3],有机合成芳胺废水[4]等。
日本在这方面已有部分专利面世[1]。
本文就机械加工清洗产生的乳化废水的氧化实验作详细介绍。
1.实验部分
1)废水来源
本实验采用的乳化废水是废液。
COD浓度为20000~100000mg/L;试验COD50540mg/L,试验用原水pH值9.35;
2)试剂及测试方法
双氧水、绿矾(硫酸亚铁)用水等为分析纯试剂,COD采用标准法测定,
3)实验方法
水样100mL于250mL三角烧瓶,用硫酸调节原水pH值,投加绿矾后,加入双氧水,置于摇床内振荡,振荡速度200r/min,反应完成后静置30min
取样。
2.
实验结果与讨论:
影响有机物去除的重要因素有双氧水投量,原水pH值,反应时间等;本实验针对这四方面考察了Fenton氧化反应规律;为求得最佳反应条件,首先考虑三因素三水平正交实验。
(见表1)
3.正交实验结果分析:
双氧水投量选择50%、100%、150%Qth(Qth为与COD表征的有机物氧化化学当量;Fe2+投量不仅与双氧水量有关还与原水种类有关,由条件预备实验确定出较佳的Fe2+投量接近0.1COD,即Fe2+/H2O2为1∶20左右;反应时间确定2h。
正交实验结果如下:
由正交实验结果分析,三因素中最为显著的当数双氧水投量,其次是pH
值,再次是绿矾投量。
从数据变化趋势来看似乎呈相同的递增态势,但结合实
际,第二个数据水平COD去除率已经高达88%,再增加双氧水和绿矾投量,有机物分解率增加不多;第二个数据水平就可以认为是较为理想的条件;唯有pH值的影响趋势是于我们更有利,原水的pH值9.35较高,有利于Fenton氧化;这似乎同文献报道的Fenton试剂最佳作用条件pH3.0有所不符,但是当向水样中投加药剂后,根据实验测定,即使不调节原水pH值,体系的pH值也会降低至2.5左右,而后体系的pH值一直维持在2.5左右(见图5);这一结果又是同文献报道的结果相一致。
也就是说,Fe2+-
H2O2的加入使反应体系pH值下降至最佳pH值附近是导致pH值影响不显著的重要原因。
为更精确地寻求反应规律,我们进行如下单因素实验。
4.单因素实验分析
1)原水pH值的影响:
固定双氧水投量在100%Qth,绿矾(FeSO4·7H2O)投量2.482g(Fe2+/H2O2=1∶20)反应2h,结果如图1所示:
在本实验中,原水pH值较低或不调pH值,COD去除率较高,pH值为6.0左右COD去
除率最低,但从整体来看,pH值对有机物氧化反应的影响并不明显,总体差异很小。
而且,在原水不进行pH调节时COD去除率呈现出最高水平。
图4原水pH对有机物去除影响
2)
Fe2+投量的影响图5
为摸索Fe2+投量的影响规律,固定双氧水投量100%Qth(2.0COD),原水不调节pH值,反应2h,亚铁离子同过氧化氢的比例折算成同COD之比,实验结果见图5。
由上图,亚铁投量在0.075COD(1.863g)时达到最高的有机物去除效果,此时Fe2+/H2O2为1∶28;亚铁投量不足或过高均会使有机物去除水平下降。
在亚铁投量极低时,(0.025COD)出现负去除现象,即反应后的水中COD浓度高于初始COD浓度,一个很好的解释就是乳化废水属于难降解废水也是难以化学氧化的废水,Fe2+-H2O2体系产生的羟自由基HO·具有强氧化能力,它能氧化绝大多数的有机物,特别是芳香族化合物易被HO·开环,变成易于氧化的大分子有机物,这样测得的有机物浓度比初始COD值要高;经过多次反复,情形仍然如此。
由此可以看到Fenton试剂的应用潜力。
3)
双氧水投量的影响图6
保证Fe2+投量为最佳水平0.075COD(1.863g),使用原水不调节pH值,结果如图6所示。
随着双氧水投量的增加,COD去除率呈上升趋势,但也并不是多多益善,H2O2投量超过100%Qth(2.0COD)时,COD去除率反而有所下降;这可解释为当过氧化氢量过多时,在亚铁离子的催化作用下产生的羟自由基浓度较高,易发生自分解而变成水和氧,这样就没有达到充分利用于分解有机物的目的,耗费了大量H2O2。
因此,最佳投量还是100%Qth(2.0COD),此时COD去除率为91%。
4)
反应时间的影响
反应时间也是重要的影响因素,在没有催化剂时氧化反应的发生极为缓慢。
甚至难以观察检测。
加入适量催化剂可以改变反应途径,加快反应速度。
从COD降解规律来看,该反应过程同其他催化反应类似,仍然存在有机物分解的诱导过程;反应初期速度较慢,约1.0h后反应速度急剧上升,如图4所示:
反应进行0.5h时出现负去除率(COD稍有增加而TOC有所减少),实际上说明有机物没有真正去除,而是由难以分解的变成易于氧化分解的有机物;因而可以认为ηCOD=0;在反应进行到1.5h,已有大部分分解(ηCOD=75.2%);反应2.0h后,有机物分解比较缓慢。
图8是体系pH值随氧化反应时间的变化规律;开始一段时间,氧化反应产酸使体系pH值下降,而后有机酸开始被氧化使得pH值有所回升,最后pH值的下降可以推测是生成更稳定的甲酸和乙酸造成。
5.
反应机理与动力学浅析Fenton氧化机理属于典型的自由基反应过程,在Fe2+的催化作用下,过氧化氢分解产生羟基自由基引起有机物自由基链引发、链传递、以及链终止;羟基自由基将大分子有机物分解为有机小分子、CO2、H2O;部分有机自由基发生聚合形成易于沉降的大分子,在绿矾水解产物的絮凝作用下沉淀下来。
有关其反应机理的报道较多,在此不再重复;下面就其反应动力学过程略做介绍:
在最佳投量(H2O2为2.0COD,Fe2+为0.075COD),该过程符合准一级动力学模型,即反应过程可以划分为两个阶段,每一阶段均为一级反应,各自存在不同的速率常数
由图9可以看出,反应开始速率较高(速率常数为111423),而且非常符合一级反应规律,其相关系数达0.9973;反应发生到1.5h后速率明显变慢(速率常数为0.1244,相关系数为0.8567),有机物去除总量下降很多;这种自由基反应历程的特点对于工程实际是很有意义的。
参考:
(1)芬顿试剂的反应机理
Fenton技术所应用的Fenton试剂之所以具有很强的氧化能力,是因为其中含有Fe2+和H2O2,H2O2被亚铁离子催化分解生成羟基自由基(·OH),并引发更多的其他自由基,其反应机理如下:
Fe2++H2O2→Fe3++OH-+·OH
Fe3++H2O2→Fe2++HO2·+H+
Fe2++·OH→OH-+Fe3+
RH+·OH→R·+H2O
R·+Fe3+→R++Fe2+
R++O2→ROO+→…→CO2+H2O
Fenton试剂处理有机物的实质就是羟基自由基与有机物发生反应。
(2)芬顿试剂的分类
1.标准芬顿试剂
标准芬顿试剂是由H2O2和Fe2+组成的混合体系,它通过催化分解H2O2产生的·OH进攻有机物分子夺取氢,将大分子有机物降解为小分子有机物或矿化为二氧化碳和水等无机物。
该系统的优点是:
在黑暗中就能降解有机物,节省了设备投资。
主要缺点为:
反应速率较慢,H2O2的利用率低,有机物矿化不充分,处理后的水可能带有颜色,较难应用于饮用水的处理。
2.光-芬顿试剂
针对标准芬顿法过氧化氢的利用率低、有机物矿化不充分等缺点,人们把光照(紫外光或可见光)引入标准芬顿体系,形成了光-芬顿试剂。
反应体系在光的照射下,可以提高其处理效率和对有机物的降解程度,降低Fe2+的用量,保持H2O2较高的利用率。
光-芬顿试剂具有很强的氧化能力,对有机物矿化程度较好,但其缺点是处理费用较高。
随着对芬顿法的进一步研究,人们把草酸盐引入光-芬顿体系中,发现草酸盐的加入可有效提高体系对紫外线和可见光的利用效果。
3.电-芬顿试剂
电-芬顿试剂就是在电解槽中通过电解反应生成H2O2或Fe2+,从而形成芬顿试剂,并让废水流入电解槽,由于电化学作用,使反应机制得到改善,从而提高了试剂的处理效果。
该法综合了电化学反应和芬顿氧化,充分利用了二者的氧化能力。
它与光-芬顿法相比自动产生H2O2的机制较完善。
导致有机物降解的因素较多,除·OH的氧化作用外,还有阳极氧化、电吸附等。
(3)芬顿试剂的影响因素
根据上述Fenton试剂反应的机理可知,OH·是氧化有机物的有效因子,而[Fe2+]、[H2O2]、[OH-]决定了OH·的产量,因而决定了与有机物反应的程度。
影响该系统的因素包括溶液pH值、反应温度、H2O2投加量及投加方式、催化剂种类、催化剂与H2O2投加量之比等。
(4)试验部分
1.试剂和废水
试剂:
双氧水(30%)、绿矾(七水硫酸亚铁)、氢氧化钠、浓硫酸均为分析纯;
试验水质:
试验用水取自乳化废水破乳后处理的水样,水质特征:
pH值为,CODCr为mg/L,BOD5为mg/l色度为度。
2.试验方法
取破乳后最佳的处理水样300mL水样(下简称废水)置于500mL烧杯中,记录其水质各项指标,用H2SO4或NaOH调节pH值,再向废水中加入一定量的硫酸亚铁和双氧水,迅速混合,反应一段时间后取出,调节其pH值至中性,取上清液进行分析,采用国家标准分析方法测定COD和色度。
3.处理工艺流程
(5)结果与讨论
1.反应时间与色度、CODCr去除率的关系
试验条件:
初始CODCr=110mg/L,色度=100倍,pH=5.00,FeSO4投加量=400mg/L,30%H2O2投加量=200mg/L,通过调节停留时间来调节反应时间。
试验结果见图4。
图4反应时间与色度、COD去除率的关系
由图1可知,在前30min内,CODCr和色度的去除率随反应时间的延长而增加,而30min后,CODCr和色度的去除率趋于平缓。
这表明,反应前段时间主要是生成新生态的·OH,反应一段时间随着生成·OH量增多,这时分解破坏一些难分解的有机物占主导地位,反应后期,随着·OH量的减少和难降解物质的减少,CODCr的去除率趋于稳定。
2.pH值对色度、CODCr去除率的关系
试验条件:
初始CODCr=110mg/L,色度为100倍,FeSO4投加量为400mg/L,H2O2投加量为200mg/L,通过往造纸废水中加硫酸调节废水的pH值。
试验结果见图2。
图2反应pH值与色度、COD去除率的关系
由图2可知,pH=5时,CODCr和色度的去除效果最好,过高或过低的pH使CODCr和色度的去除效果都有一定的下降。
这主要跟Fenton试剂的作用机理有关,H+浓度高,对Fenton反应有抑制作用,影响Fe2+的催化再生及·OH的产生;当pH较高时,不仅抑制了·OH的产生,同时也会使Fe2+和Fe3+生成氢氧化物沉淀而降低或失去催化作用;同时较高的pH值也能使H2O2产生无效分解,降低氧化效率。
3.FeSO4投加量对色度、CODCr去除率的关系
试验条件:
初始CODCr=110mg/L,色度=100倍,pH=5.00,H2O2投加量=200mg/L,投入不同的FeSO4量来调节Fe2+浓度。
试验结果见图3。
图3FeSO4投加量与色度、COD去除率的关系
由图3可知,当催化剂Fe2+浓度较小时,不利于催化反应的充分进行,产生的·OH的量较少,且后续的絮凝沉淀效果也差。
Fe2+浓度过高,不仅使反应后的出水色度增大,而且过量的Fe2+会使H2O2
分解速度过快,在短时间内使·OH的浓度达到很高,部分·OH来不及与有机物反应便发生了相互间的自由基反应[10],从而降低了对·OH的利用率。
4.H2O2投加量对色度、CODCr去除率的关系
试验条件:
初始CODCr=110mg/L,色度=100倍,pH=5.00,FeSO4投加量=400mg/L,加入不同的H2O2溶液。
试验结果见图4。
图4H2O2投加量与色度、CODCr去除率的关系
由图4可知,随着H2O2用量的增加,色度和CODCr的去除率也随着增加。
这是因为Fenton氧化作用主要靠H2O2在Fe2+的催化作用下产生·OH来去除有机物,所以H2O2的投加量直接影响着Fenton的氧化效果。
当H2O2投加量继续增加时,CODCr的去除率不仅没增加反而下降,这说明在Fenton氧化过程中,并不是H2O2浓度越高氧化效果越好,相反过量的H2O2会残留在溶液中,而H2O2在CODCr的测量中可被重铬酸钾氧化,从而在一定程度上增加了出水的CODCr值。
在H2O2过量的情况下,大量的Fe2+会在一开始就被氧化成Fe3+,消耗了H2O2
的同时又抑制了·OH的产生。