初中化学所学物质化学性质一览表.docx
《初中化学所学物质化学性质一览表.docx》由会员分享,可在线阅读,更多相关《初中化学所学物质化学性质一览表.docx(11页珍藏版)》请在冰豆网上搜索。
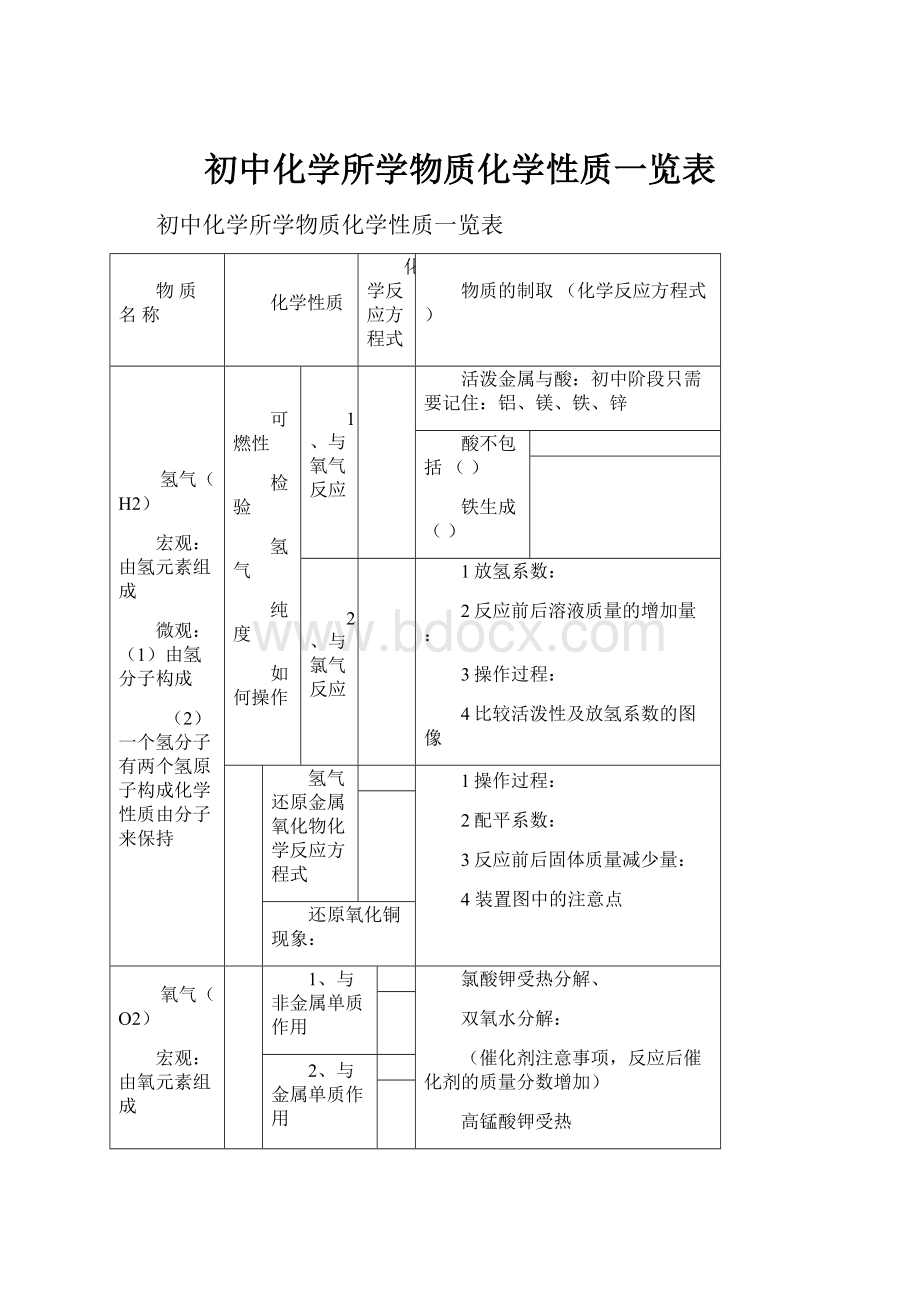
初中化学所学物质化学性质一览表
初中化学所学物质化学性质一览表
物质名称
化学性质
化学反应方程式
物质的制取(化学反应方程式)
氢气(H2)
宏观:
由氢元素组成
微观:
(1)由氢分子构成
(2)一个氢分子有两个氢原子构成化学性质由分子来保持
可燃性
检验
氢气
纯度
如何操作
1、与氧气反应
活泼金属与酸:
初中阶段只需要记住:
铝、镁、铁、锌
酸不包括()
铁生成()
2、与氯气反应
1放氢系数:
2反应前后溶液质量的增加量:
3操作过程:
4比较活泼性及放氢系数的图像
还
原
性
氢气还原金属氧化物化学反应方程式
1操作过程:
2配平系数:
3反应前后固体质量减少量:
4装置图中的注意点
还原氧化铜现象:
氧气(O2)
宏观:
由氧元素组成
微观:
(1)由氧分子构成
(2)一个氧分子有两个氢原子构成化学性质由分子来保持
助
燃
性
1、与非金属单质作用
氯酸钾受热分解、
双氧水分解:
(催化剂注意事项,反应后催化剂的质量分数增加)
高锰酸钾受热
2、与金属单质作用
3、与化合物作用
CO、
(1)反应前后固体质量的减少量:
(2)排水法收集完气体要注意:
有机物
工业制法,利用了,先气化剩于液体中,氧气体积占全部体积的
此变化属于变化
碳(C)
宏观:
由碳元素组成
微观:
由碳原子构成化学性质由原子来保持
可燃性
注意碳与氧气的质量比,生成CO2、CO
3/4
3/8
还原性
还原金属氧化物
(1)条件高温,
(2)反应前后固体质量的减少量
(3)碳原子的配平系数
(4)装置图中的注意点
(5)对生成气体的检验
还原非金属氧化物
硫(S)、磷(P)
宏观由元素组成、微观由原子构成
化学性质由原子来保持
可燃性
常见活泼金属
单质
铁(Fe)
锌(Zn)
镁(Mg)
宏观:
由元素组成
微观:
由原子构成化学性质由相应原子保持
与酸反应
只限盐酸、硫酸
只
限
于
制
取
铁
活泼金属单质与可溶的铁盐溶液的置换
还
原
剂
与
铁
的
氧
化
物
与氧气反应
与可溶性的盐作用以硫酸铜、硝酸银为主
(1)注意反应方程式的配平:
(2)注意反应前后的固体质量的减少量
(3)反应装置的注意点:
(4)一氧化碳的尾气处理:
不活泼金属
单质
铜(Cu)
宏观:
由元素组成
微观:
由原子构成化学性质由铜原子保持
(1)与氧气作用
活泼金属与可溶性
铜盐
(2)与可溶性的盐作用(硝酸银)
(3)与氧气、水、二氧化碳作用(※)
还原剂与氧化铜反应
钾(K)钙(Ca)钠(Na)
置换反应中不要出现钾、钙、钠化学性质由金属原子保持
1、与水作用(※)
钾(K)钙(Ca)钠(Na)制备初中阶段不需要掌握
2、与氧气作用
氧
化
物
XO
宏观:
有相应的元素组成
微观:
氧化物的构成比较复杂。
有些是分子直接构成、有些是离子直接构成
金属氧化物
大多数金属氧化物是碱性氧化物,可与酸反应生成盐和水由离子直接构成,其化学性质有离子保持
化学性质
化学方程式
金属氧化物的制取
化学方程式
分类
可溶的金属氧化物(只掌握
CaO)
(1)与水作用
金属单质与氧气直接作用
(2)与酸作用
(3)与部分非金属氧化物作用
不溶的金属氧化物(Fe2O3
CuO)
(1)与酸作用
金属单质与氧气直接作用
(2)与还原剂作用
相应的不溶性碱受热分解
不溶性碳酸盐分解
非金属
氧化物
大多数非金属氧化物是酸性氧化物,与碱反应生成盐和水。
由分子直接构成其化学性质由分子保持(CO2、SO2、SO3)
具体化学性质
化学方程式
非金属氧化物的制取
化学方程式
1、与水作用(SiO2不溶于水除外)
只
限
于
二
氧
化
碳
非金属单质与氧气直接作用
2、与可溶的碱作用
含氧酸分解(碳酸分解)
一氧化碳还原金属氧化物
3、与部分金属氧化物作用(K、Ca、Na、Ba)
不溶性碳酸盐分解(碳酸钙分解)
碳单质与金属氧化物作用
4、二氧化碳与水
(光合作用)
碳酸氢盐受热分解
水(H2O)
水是由分子直接构成,化学性质由水分子保持
与可溶的金属氧化物作用
水
的
制
取
氢气与氧气直接作用
与可溶的非金属氧化物作用
含氧酸分解
与部分的盐作用生成结晶水合物
结晶水合物受热分解
氢气还原金属氧化物
水分解
不溶性的碱受热分解
水与碳反应((※))
复分解反应生成
一氧化碳
一氧化碳是由分子直接构成,化学性质由一氧化碳分子保持
可燃性(注意防煤气中毒)
煤气中加入报警性气体的性质:
还原性:
还原氧化铜现象:
操作过程:
与氢气知识点相同
反应前后固体质量减少量:
配平系数:
尾气处理:
酸HX
宏观:
由相应元素组成
微观:
由分子直接构成
酸的化学性质有酸的分子来保持
盐酸:
HCl
浓盐酸的挥发性
硫酸:
H2SO4
浓硫酸的吸水性
如何稀释浓硫酸
浓硫酸具有脱水性
浓硫酸具有腐蚀性
(1)与酸碱指示剂作用
(2)与活泼金属作用(不包括硝酸)
(3)与金属氧化物作用(只限于Cuo、Fe2O3)
(元素的化合价不变)
(4)与碱作用(元素的化合价不变)
注:
要想看到现象必须有指示剂
(5)与盐作用
元素的化合价不变
生成物要有难解离
的物质)
H2SO4(Ba或CO3)
HCl(Ag或CO3)
HNO3(CO3)
碱XOH
宏观:
由相应元素组成
微观:
由阴阳离子直接构成
碱的化学性质由离子来保持
分
类
可溶的碱
NaOH、
KOH
Ca(OH)2Ba(OH)2
(1)与酸碱指示剂作用
(2)与非金属氧化物作用(只限于CO2、SO2)
(元素的化合价不变)
(3)与酸作用。
注:
要想看到现象必须有指示剂
(元素的化合价不变)
(4)与可溶性的盐作用(元素的化合价不变,生成物要有难解离的物质)注意:
所有铵盐都可以与可溶的碱作用(CuSO4或FeCl3)
不溶的碱
Cu(OH)2Fe(OH)3
(1)受热分解
可溶的碱与盐作用制不溶的碱
(2)与酸作用
盐
宏观:
由相应元素直接组成
微观:
由阴阳离子通过静电吸引直接构成,其化学性质由离子来保持
盐由两部分组成,其化学性质就由这两部分决定,即有金属离子和酸根离子两部分共同决定
硫
酸
盐
硫酸钾()
硫酸钠()
只能和可溶性含Ba2+的盐或Ba(OH)2作用
硫酸铵()
(1)与可溶性含Ba2+的盐作用
(2)与可溶性碱反应
硫酸亚铁()
硫酸铜()
硫酸铁()
硫酸铜与水作用生成结晶水合物
(1)与可溶性含Ba2+的盐作用
(2)与可溶性碱反应
(3)与可溶的碳酸盐反应
(4)与活泼性较大的金属单质反应
硫酸镁()
硫酸钙()
(1)与可溶性含Ba2+的盐作用
(2)与可溶的碳酸盐反应
硝
酸
盐
硝酸钙()
硝酸镁()
只能和可溶性碳酸盐反应
硝酸钾()
硝酸钠()
初中阶段不发生反应
硝酸铁()
硝酸锌()
硝酸铜()
(1)与可溶的碱作用
(2)与活泼性较大的金属单质反应
(3)与可溶的碳酸盐反应
硝酸钡()
(1)与硫酸及硫酸盐作用
(2)与可溶性的碳酸盐作用
硝酸银()
(1)与活泼性较大的金属单质反应
(2)与盐酸或可溶的氯化物反应
碳
酸
盐
可溶的碳酸盐
碳酸钾()
碳酸钠()
碳酸铵()
碳酸钠与水作用生成结晶水合物
(1)与酸作用
(2)与含Ca2+Ba2+Mg2+的可溶性盐作用
(3)与氢氧化钙、氢氧化钡作用,其中碳酸铵可以和所有可溶性碱作用
(4)与水和二氧化碳共同作用(※)
不溶性碳酸盐
碳酸钙()
碳酸镁()
碳酸钡()
(1)与酸作用
(2)受热分解
(3)与水和二氧化碳共同作用(※)
碳酸氢盐
碳酸氢盐都可溶
碳酸氢钠()碳酸氢钙()
(1)与酸作用
(2)受热分解
氯
化
物
氯化钾()
氯化钠()
只和可溶性银盐反应(AgNO3)
氯化铵()
(1)与可溶性银盐反应(AgNO3)
(2)与可溶的碱作用
氯化铜()
氯化铁()
(1)与可溶的碱作用
(2)与活泼性较大的金属单质反应
(3)与可溶的碳酸盐反应
(4)与可溶性银盐反应(AgNO3)
氯化钡()
(1)与硫酸及硫酸盐反应
(2)与可溶的碳酸盐反应
(3)与可溶性银盐反应(AgNO3)
氯化钙()
氯化镁()
(1)与可溶性银盐反应(AgNO3)
(2)与可溶的碳酸盐反应