届二轮复习 化学能与热能 名师公开课优质学案全国通用1.docx
《届二轮复习 化学能与热能 名师公开课优质学案全国通用1.docx》由会员分享,可在线阅读,更多相关《届二轮复习 化学能与热能 名师公开课优质学案全国通用1.docx(27页珍藏版)》请在冰豆网上搜索。
届二轮复习化学能与热能名师公开课优质学案全国通用1
专题八 化学能与热能
[查漏补缺·对接高考] 排查核心知识 挖掘命题规律
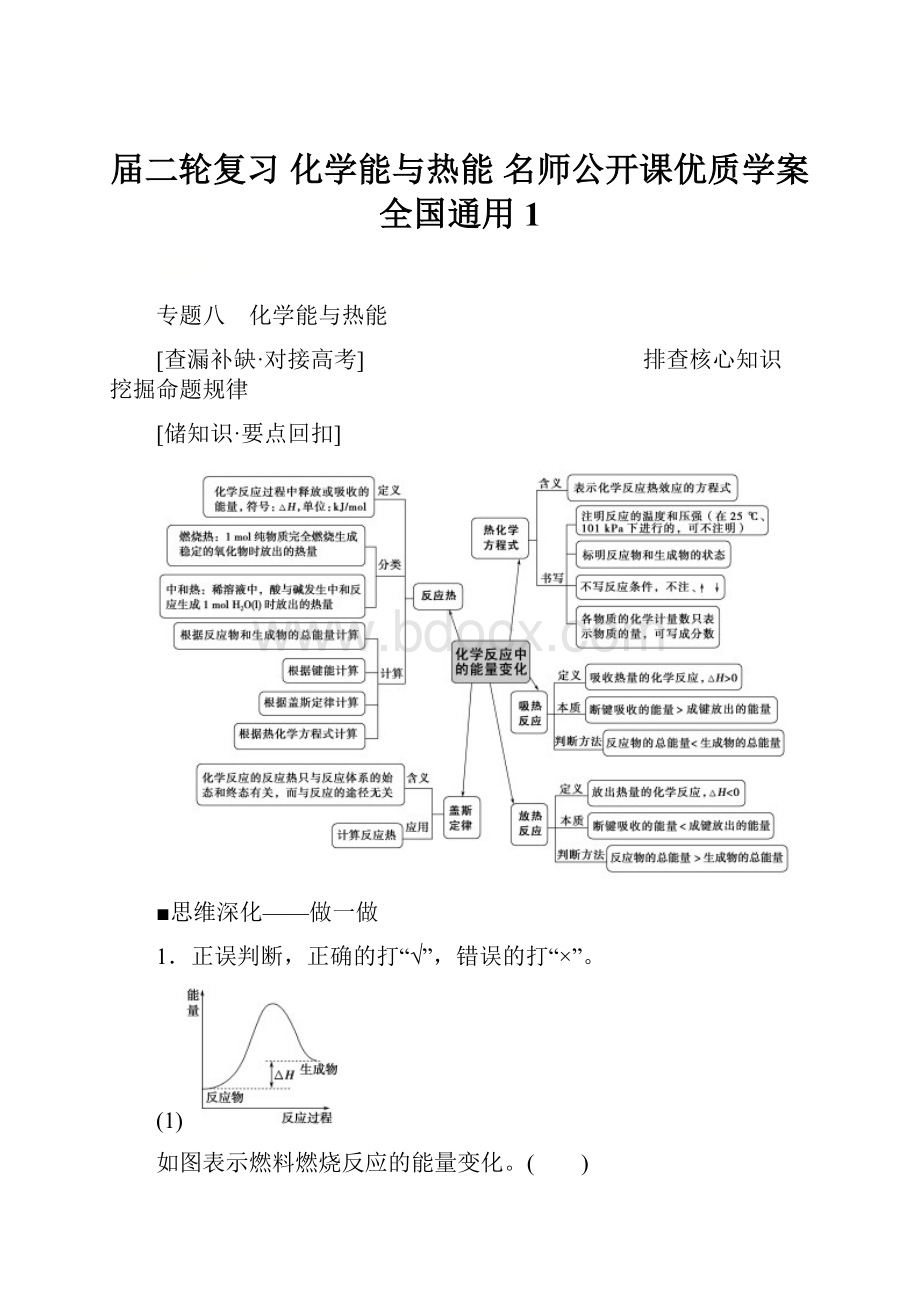
[储知识·要点回扣]
■思维深化——做一做
1.正误判断,正确的打“√”,错误的打“×”。
(1)
如图表示燃料燃烧反应的能量变化。
( )
(2)在CO2中,Mg燃烧生成MgO和C。
该反应中化学能全部转化为热能。
( )
(3)催化剂能降低反应的活化能。
( )
(4)同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同。
( )
答案:
(1)×
(2)× (3)√ (4)×
2.正确理解反应过程、能量图像
(1)E1:
旧键断裂吸收的能量或称为____________。
(2)E2:
新键形成放出的能量或称为逆反应的____________。
(3)ΔH=____________,为此反应的焓变。
(4)催化剂的作用:
降低____________,但不影响________,反应放热还是吸热取决于________和________能量的高低。
答案:
(1)活化能
(2)活化能 (3)E1-E2 (4)E1、E2 ΔH 起点(反应物) 终点(生成物)
3.2molH2SO4稀溶液和2molNaOH稀溶液混合,放出114.6kJ热量。
(1)该反应的中和热ΔH=__________________________________________,
(2)表示该反应的中和热的热化学方程式为____________________________。
(3)若用2molH2SO4浓溶液和2molNaOH浓溶液混合,放出的热量________114.6kJ,原因是___________________________________________________________________。
答案:
(1)-57.3kJ·mol-1
(2)
H2SO4(aq)+NaOH(aq)===H2O(l)+
Na2SO4(aq) ΔH=-57.3kJ·mol-1
(3)大于 浓硫酸和浓氢氧化钠溶液稀释时放热
4.在298K、100kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
(1)ΔH3与ΔH1、ΔH2的关系是__________________________________________________。
(2)若H2O(l)===H2O(g) ΔH4,则氢气的燃烧热为_________________________________。
答案:
(1)ΔH3=ΔH1+2ΔH2
(2)-
(ΔH1+2ΔH4)
[探高考·真题鉴赏]
1.(2018·全国高考卷Ⅰ节选)已知:
2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4kJ·mol-1
2NO2(g)N2O4(g) ΔH2=-55.3kJ·mol-1
则反应N2O5(g)===2NO2(g)+
O2(g)的ΔH=________kJ·mol-1。
解析:
令2N2O5(g)===2N2O4(g)+O2(g)
ΔH1=-4.4kJ·mol-1 a
2NO2(g)N2O4(g) ΔH2=-55.3kJ·mol-1 b
根据盖斯定律,a式×
-b式可得:
N2O5(g)===2NO2(g)+
O2(g)
ΔH=+53.1kJ·mol-1
答案:
+53.1
2.(2018·全国高考卷Ⅱ节选)CH4�CO2催化重整反应为CH4(g)+CO2(g)2CO(g)+2H2(g)。
已知:
C(s)+2H2(g)===CH4(g)
ΔH=-75kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-394kJ·mol-1
C(s)+
O2(g)===CO(g) ΔH=-111kJ·mol-1
该催化重整反应的ΔH=________kJ·mol-1。
解析:
将已知中3个反应依次记为①、②、③,根据盖斯定律,由③×2-①-②得该催化重整反应的ΔH=(-111×2+75+394)kJ·mol-1=+247kJ·mol-1。
答案:
+247
3.(2018·全国高考卷Ⅲ节选)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g)
ΔH1=+48kJ·mol-1
3SiH2Cl2(g)===SiH4(g)+2SiHCl3(g)
ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)===SiH4(g)+3SiCl4(g)的ΔH为________kJ·mol-1。
解析:
将已知热化学方程式依次编号为①、②,根据盖斯定律,由①×3+②,可得:
4SiHCl3(g)===SiH4(g)+3SiCl4(g) ΔH=3×48kJ·mol-1-30kJ·mol-1=+114kJ·mol-1。
答案:
+114
4.(2017·全国高考卷Ⅰ节选)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________________________________________________________________、
________________________________________________________________________,
制得等量H2所需能量较少的是___________________________________________。
解析:
系统(Ⅰ)和系统(Ⅱ)都是吸热反应,从热化学方程式可以看出,系统(Ⅱ)制备1molH2需要消耗20kJ能量,而系统(Ⅰ)制备1molH2需要消耗286kJ能量,故系统(Ⅱ)消耗的能量较少。
答案:
H2O(l)===H2(g)+
O2(g) ΔH=286kJ·mol-1 H2S(g)===H2(g)+S(s) ΔH=20kJ·mol-1 系统(Ⅱ)
5.(2017·全国高考卷Ⅱ节选)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
回答下列问题:
正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:
①C4H10(g)===C4H8(g)+H2(g) ΔH1
已知:
②C4H10(g)+
O2(g)===C4H8(g)+H2O(g) ΔH2=-119kJ·mol-1
③H2(g)+
O2(g)===H2O(g) ΔH3=-242kJ·mol-1
反应①的ΔH1为________kJ·mol-1。
解析:
根据盖斯定律,可得①=②-③,则ΔH1=ΔH2-ΔH3=-119kJ·mol-1+242kJ·mol-1=+123kJ·mol-1。
答案:
+123
[研考纲·聚焦素养]
最新考纲
1.了解化学反应中能量转化的原因及常见的能量转化形式。
2.了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。
3.了解热化学方程式的含义,能正确书写热化学方程式。
4.了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
5.了解焓变(ΔH)与反应热的含义。
6.理解盖斯定律,并能用盖斯定律进行有关反应焓变的计算。
核心素养
1.变化观念与平衡思想:
认识化学反应中的能量变化是由化学反应中旧化学键断裂和新化学键形成时的能量变化不同造成的,能从宏观和微观的不同角度分析化学反应中的能量变化,解决热化学的有关问题。
2.科学探究与创新意识:
能发现和提出有探究价值的燃烧热、中和热测定等热化学问题,确定探究目的,设计探究方案,进行实验探究,并能根据实际情况改进实验装置,面对“异常”现象敢于提出自己的见解。
3.科学精神与社会责任:
具有可持续发展意识和绿色化学观念,能合理利用常规能源,开发利用新能源和环保、清洁能源,能对与热化学有关的社会热点问题做出正确的价值判断。
[题型突破·通法悟道] 摆题型示例 巧取应考宝典
授课提示:
对应学生用书第24页
题型一 焓变 热化学方程式
[研——题型探究]
►角度一 反应热与焓变
1.可逆反应NO2(g)+CO(g)CO2(g)+NO(g),反应过程中的能量变化如图所示,下列说法正确的是( )
A.1molNO2与1molCO混合经充分反应放热234kJ
B.若反应开始时加入催化剂,则使E1、E2都变大
C.正反应的活化能是134kJ·mol-1
D.该反应的反应热ΔH=E2-E1
解析:
NO2(g)+CO(g)CO2(g)+NO(g)属于可逆反应,1molNO2与1molCO混合,无法完全反应,反应放热小于234kJ,A错误;催化剂能降低反应活化能,使E1、E2都变小,B错误;由图可知E1为正反应的活化能,C正确;该反应为放热反应,ΔH<0,该反应的反应热ΔH=E1-E2,D错误。
答案:
C
拓展思考
(1)该可逆反应的逆反应的ΔH=________。
(2)该可逆反应的逆反应的活化能为______________kJ·mol-1。
提示:
(1)ΔH=E2-E1=368kJ·mol-1-134kJ·mol-1=+234kJ·mol-1。
正反应为放热反应,则逆反应为吸热反应。
(2)368
2.乙苯催化脱氢制苯乙烯反应:
已知:
化学键
C—H
C—C
C===C
H—H
键能/(kJ·mol-1)
412
348
612
436
计算上述反应的ΔH=________kJ·mol-1。
解析:
设“
”部分的化学键键能为akJ·mol-1,则ΔH=(a+348+412×5)kJ·mol-1-(a+612+412×3+436)kJ·mol-1=+124kJ·mol-1。
答案:
+124
[题型建模] 反应热与焓变理解“六大误区”
(1)误认为放热反应不需要加热,吸热反应必须加热。
(2)误认为键能越大能量越高,其实键能越大,物质越稳定,能量越低。
(3)误认为反应条件不同时,ΔH也不同。
其实在相同状况下,相同的反应物生成相同的生成物,ΔH相同,而与反应的引发条件无关。
(4)误认为可逆反应的反应热与物质的转化率有关。
其实反应热与转化率无关,反应放出或吸收的能量值与转化率有关。
(5)燃烧热是指101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时放出的热量,并不是1mol可燃物燃烧时放出的热量。
(6)中和热不是指1mol酸与1mol碱中和时的热效应,而是指中和反应“生成1molH2O(l)”的热效应。
►角度二 热化学方程式书写及正误判断
3.
(1)已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃。
室温时AX3与气体X2反应生成1molAX5,放出热量123.8kJ。
该反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)化学反应N2(g)+3H2(g)2NH3(l)的能量变化如图所示,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应。
温度为T时,该反应的热化学方程式为________________________________________________________________________
________________________________________________________________________。
已知温度为T时:
CH4(g)+2H2O(g)===CO2(g)+4H2(g)
ΔH=+165kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH=-41kJ·mol-1
解析:
(1)由题意知,室温时,AX3是液体,AX5是固体,所以热化学方程式为AX3(l)+X2(g)===AX5(s) ΔH=-123.8kJ·mol-1。
(2)从图像来看,反应
N2(g)+
H2(g)NH3(g)的焓变为(a-b)kJ/mol,反应
N2(g)+
H2(g)NH3(l)的焓变为(a-b-c)kJ/mol。
因此,反应N2(g)+3H2(g)3(g)的焓变为2(a-b)kJ/mol,反应N2(g)+3H2(g)2NH3(l)的焓变为2(a-b-c)kJ/mol。
(3)已知:
CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165kJ·mol-1①、CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41kJ·mol-1②,由盖斯定律可知,②-①即得所求热化学方程式:
CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH=-206kJ·mol-1。
答案:
(1)AX3(l)+X2(g)===AX5(s)
ΔH=-123.8kJ·mol-1
(2)N2(g)+3H2(g)2NH3(l)
ΔH=2(a-b-c)kJ·mol-1
(3)CO(g)+3H2(g)===CH4(g)+H2O(g)
ΔH=-206kJ·mol-1
4.下列关于反应热和热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热ΔH=-283.0kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+2×283.0kJ·mol-1
C.氢气的燃烧热为ΔH=-285.5kJ·mol-1,则电解水的热化学方程式为2H2O(l)
2H2(g)+O2(g) ΔH=+285.5kJ·mol-1
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
答案:
B
[题型建模]
热化学方程式书写与正误判断易出现的5种常见错误
(1)“+”“-”漏写或使用不正确。
即吸热反应未标“+”,放热反应未标“-”。
(2)单位与热量Q单位混淆。
ΔH的单位为“kJ·mol-1(或kJ/mol)”,易错写成“kJ”。
(3)物质的状态标注不正确。
s、l、g和aq分别表示固态、液态、气态和水溶液。
(4)ΔH的数值不正确。
即ΔH的数值必须与方程式中的化学计量数相对应。
(5)对概念的理解不正确。
如燃烧热是指1mol可燃物,且生成CO2(g)、H2O(l)、SO2(g)等;中和热是指1molH+和1molOH-生成1molH2O(l)。
[练——即学即用]
1.臭氧层中臭氧分解历程如图所示,下列说法正确的是( )
臭氧分解历程示意图
A.催化反应①、②均为放热反应
B.催化剂不能改变该反应的焓变
C.ClO是该反应的催化剂
D.在该反应过程中没有化学键的断裂与生成
解析:
由题可知反应①反应物能量低于生成物,为吸热反应,反应②反应物能量高于生成物,为放热反应,A错误;催化剂改变了反应的活化能,没有改变反应的焓变,B正确;ClO是中间产物,Cl是催化剂,C错误;任何化学反应中都既有化学键的断裂又有化学键的形成,D错误。
答案:
B
2.已知1g氢气完全燃烧生成液态水时放出热量143kJ,18g水蒸气变成液态水放出44kJ的热量。
其他相关数据见下表:
O===O(g)
H—H
H—O
1mol化学键断裂时
需要吸收的能量/kJ
496
x
463
则表中x为( )
A.920 B.557
C.436D.188
解析:
根据题意,可得热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-572kJ·mol-1;而18g水蒸气变成液态水时放出44kJ热量,则2H2(g)+O2(g)===2H2O(g) ΔH=-484kJ·mol-1,即-484kJ=2xkJ+496kJ-4×463kJ,解得x=436。
答案:
C
3.正误判断,正确的划“√”,错误的划“×”。
(1)500℃、30MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6kJ·mol-1。
( )
(2)密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量。
则Fe(s)+S(s)===FeS(s) ΔH=-95.6kJ·mol-1。
( )
(3)稀醋酸与0.1mol·L-1NaOH溶液反应:
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ·mol-1。
( )
答案:
(1)×
(2)√ (3)×
4.如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
______________________________________________。
解析:
ΔH=E生成物-E反应物=(E过渡态-E2)-(E过渡态-E1)=E1-E2=-234kJ·mol-1。
答案:
NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234kJ·mol-1
题型二 盖斯定律的应用
1.(2018·湖北武汉模拟)已知:
2H2(g)+O2(g)===2H2O(g) ΔH1
3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2
2Fe(s)+
O2(g)===Fe2O3(s) ΔH3
2Al(s)+
O2(g)===Al2O3(s) ΔH4
2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1<0,ΔH3>0
B.ΔH5<0,ΔH4<ΔH3
C.ΔH1=ΔH2+ΔH3
D.ΔH3=ΔH4+ΔH5
解析:
燃烧反应都是放热反应,故ΔH3<0,A错误;将上述反应分别编号为①②③④⑤,反应⑤是铝热反应,显然是放热反应,ΔH5<0,将④-③可得⑤,即ΔH5=ΔH4-ΔH3<0,B正确、D错误;将②+③可得3H2(g)+
O2(g)===3H2O(g),故ΔH1=
(ΔH2+ΔH3),C错误。
答案:
B
2.铅及其化合物在工业生产及日常生活中都具有非常广泛的用途。
瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)===2PbO(s)+2SO2(g)
ΔH=akJ·mol-1;
②PbS(s)+2PbO(s)===3Pb(s)+SO2(g)
ΔH=bkJ·mol-1;
③PbS(s)+PbSO4(s)===2Pb(s)+2SO2(g)
ΔH=ckJ·mol-1。
反应3PbS(s)+6O2(g)===3PbSO4(s)
ΔH=________kJ·mol-1(用含a、b、c的代数式表示)。
解析:
依据盖斯定律,将①×2+②×2-③×3,即可得所求反应的ΔH。
答案:
(2a+2b-3c)
3.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。
发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键
H—H
C—O
H—O
C—H
E/(kJ·mol-1)
436
343
1076
465
413
由此计算
(1)ΔH1=________kJ·mol-1;
(2)已知ΔH2=-58kJ·mol-1,则ΔH3=________kJ·mol-1。
答案:
(1)-99
(2)+41
[题型建模] 根据盖斯定律计算ΔH的步骤
巧用题链 透析活化能及催化剂
授课提示:
对应学生用书第26页
[题链1] 将CH4与H2O(g)通入聚焦太阳能反应器,发生反应:
CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206kJ/mol。
在坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
答案:
[题链2] CaSO4(s)+CO(g)CaO(s)+SO2(g)+CO2(g) ΔH=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)CaS(s)+4CO2(g)
ΔH=-175.6kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是________。
答案:
C
[题链3] 某实验室控制CO2和H2初始投料比为1∶2.2,在相同压强下,经过相同反应时间测得如下实验数据:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
ΔH1=-53.7kJ·mol-1 Ⅰ
CO2(g)+H2(g)CO(g)+H2O(g) ΔH2 Ⅱ
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
543
Cat.1
12.3
42.3
543
Cat.2
10.9
72.7
553
Cat.1
15.3
39.1
553
Cat.2
12.0
71.6
备注:
Cat.1:
Cu/ZnO纳米棒;Cat.2:
Cu/ZnO纳米片;甲醇选择性:
转化的CO2中生成甲醇的百分比。
表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是:
_______________________________________。
答案:
表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响
[题链阐释]
题链1
题链2
题链3
知识内容
能量反应过程曲线的绘制
能量反应过程的曲线的识别
催化剂对生成物的选择性的认识
解题难点
是否需要活化能的体现
由反应速率与活化能的关系
由反应对催化剂的选择性大小来判断
思维突破
准确理解有效碰撞理论
活化能影响化学反应速率,化学反应速率快慢反映活化能大小
反应对催化剂的选择性的具体数据分析对比
化学观念
教材必修2中,能量反应过程图,没有体现活化能。
选修4中体现了活化能
由定性到定量
定量更能精准地理解催化剂对反应速率的影响
[限时规范训练]