粗盐的提纯中考化学专题专题分类汇编.docx
《粗盐的提纯中考化学专题专题分类汇编.docx》由会员分享,可在线阅读,更多相关《粗盐的提纯中考化学专题专题分类汇编.docx(15页珍藏版)》请在冰豆网上搜索。
粗盐的提纯中考化学专题专题分类汇编
专题22粗盐的提纯
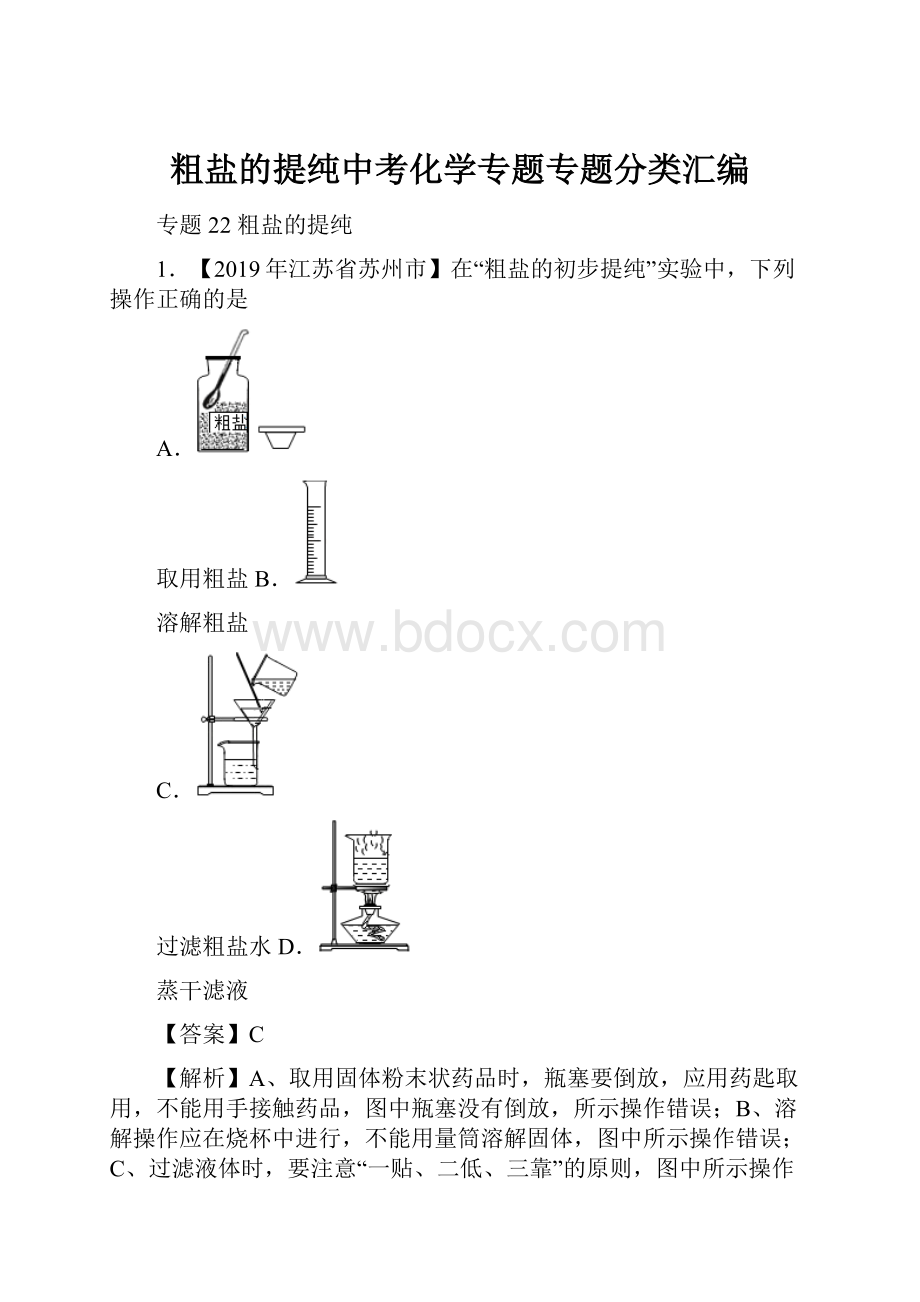
1.【2019年江苏省苏州市】在“粗盐的初步提纯”实验中,下列操作正确的是
A.
取用粗盐B.
溶解粗盐
C.
过滤粗盐水D.
蒸干滤液
【答案】C
【解析】A、取用固体粉末状药品时,瓶塞要倒放,应用药匙取用,不能用手接触药品,图中瓶塞没有倒放,所示操作错误;B、溶解操作应在烧杯中进行,不能用量筒溶解固体,图中所示操作错误;C、过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确;D、蒸发操作应用蒸发皿进行完成,图中所示操作错误。
故选C。
2.【2019年海南省】在“粗盐中难溶性杂质的去除”实验中,不需要进行的操作是
A.溶解B.过滤C.蒸发D.蒸馏
【答案】D
【解析】粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,无需进行蒸馏。
故选D。
3.【2019年广西省梧州市】为除去粗盐中的泥沙、Ca2+、Mg2+、
等杂质,可将粗盐溶于水,再进行下列五步操作:
①过滤,②加过量的氢氧化钠溶液,③加适量盐酸,④加过量的碳酸钠溶液,⑤加过量的氯化钡溶液。
正确的操作顺序是
A.④⑤②①③B.②④⑤①③C.②⑤④①③D.⑤②④③①
【答案】C
【解析】镁离子用氢氧根离子沉淀,加入过量的氢氧化钠溶液可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,加入过量的碳酸钠溶液将钙离子转化为沉淀,同时将过量的氯化钡溶液除去;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:
②⑤④①③或⑤②④①③。
故选C。
4.【2019年河北省】下列实验操作可以达到实验目的是
选项
实验目的
实验操作
A
鉴别木炭粉和氧化铜粉末
取样,加稀硫酸
B
除去MnO2中少量的KMnO4
加热固体混合物
C
检验氧气是否收集满
将带火星的木条伸入集气瓶内
D
分离CaCl2和CaCO3的固体混合物
加足量水溶解,蒸发
【答案】A
【解析】A、氧化铜粉末能与稀硫酸反应生成硫酸铜和水,会观察到黑色粉末溶解、溶液变蓝色,木炭粉不能与稀硫酸反应,可以鉴别,故选项实验操作可以达到实验目的;B、高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,能除去杂质但引入了新的杂质锰酸钾,不符合除杂原则,故选项实验操作不能达到实验目的;C、检验氧气是否收集满时,应将带火星的木条放在集气瓶口,不能伸入瓶中,故选项实验操作不能达到实验目的;D、氯化钙易溶于水,碳酸钙难溶于水,加足量水溶解,过来,蒸发,故选项实验操作不能达到实验目的。
故选A。
5.【2019年广东省广州市】除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A.Zn粉(Fe):
用ZnCl2溶液浸泡,过滤
B.碳粉(MnO2):
滴入H2O2溶液,过滤
C.NaCl溶液(Na2SO4):
加入适量MgCl2溶液,过滤
D.CO2(H2O):
通过盛有浓硫酸的洗气瓶
【答案】D
【解析】A、Fe不能与ZnCl2溶液反应,不能除去杂质,故选项所采取的方法错误;B、过氧化氢在二氧化锰的催化作用下生成水和氧气,二氧化锰作催化剂,反应前后质量不变,不能除去杂质,不符合除杂原则,故选项所采取的方法错误;C、Na2SO4与氯化镁溶液不反应,不能除去杂质,不符合除杂原则,故选项所采取的方法错误;D、浓硫酸具有吸水性,且不与二氧化碳反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
故选D。
6.【2019年河南省】为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。
(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是____________。
(2)写出一个加入Na2CO3溶液时所发生反应的化学方程式_____________________________________________。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含哪些杂质?
(BaSO4不溶于水,也不溶于酸)
【答案】
(1)玻璃棒
(2)Na2CO3+CaCl2
CaCO3↓+2NaCl或BaCl2+Na2CO3
BaCO3↓+2NaCl
(3)氯化钙、氯化镁、氯化钡
【解析】
(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是玻璃棒。
(2)加入Na2CO3溶液时,碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,和氯化钡反应生成白色沉淀碳酸钡和氯化钠,发生反应的化学方程式:
Na2CO3+CaCl2
CaCO3↓+2NaCl,BaCl2+Na2CO3
BaCO3↓+2NaCl。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,和氢氧化镁反应生成氯化镁和水,和碳酸钡反应生成氯化钡、水和二氧化碳,所得精盐产品中杂质有氯化钙、氯化镁、氯化钡。
7.【2019年安徽省】Ba(NO3)2可用于生产信号弹、炸药等。
利用钡泥(主要含有BaCO3、BaSO3、Fe2O3)可制取Ba(NO3)2,其部分流程如图:
(1)Ba(NO3)2中钡元素的化合价为____________;流程中所涉及的氧化物是_____________________(填1种即可)。
(2)BaCO3与稀HNO3反应的反应类型是____________;写出Fe2O3与稀HNO3反应的化学方程式:
________________________________________________。
(3)试剂Y为____________(填序号)。
①BaCl2溶液②Ba(OH)2溶液③NaOH溶液
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体的方法是__________________________________。
【答案】
(1)+2氧化铁(或三氧化二铁、Fe2O3)
(2)复分解反应Fe2O3+6HNO3
2Fe(NO3)3+3H2O
(3)②
(4)蒸发结晶
【解析】
(1)Ba(NO3)2中硝酸根为﹣1价,根据化合物中正负化合价的代数和为零可得钡元素的化合价为+2;氧化物为两种元素组成且其一为氧元素的纯净物,所以流程中所涉及的氧化物氧化铁(或三氧化二铁、Fe2O3)(填1种即可)。
(2)BaCO3与HNO3反应生成硝酸钡和碳酸,碳酸不稳定分解为二氧化碳和水,所以是两种化合物相互交换成分生成两种新的化合物,符合复分解反应的特征,属于复分解反应;Fe2O3与HNO3反应生成硝酸铁和水,对应的化学方程式:
Fe2O3+6HNO3
2Fe(NO3)3+3H2O。
(3)硝酸钡和硝酸铁与试剂Y生成了硝酸钡和氢氧化铁,所以Y为Ba(OH)2溶液。
故选②。
(4)从Ba(NO3)2溶液中析出Ba(NO3)2晶体所以可以蒸发结晶。
8.【2019年山西省】工业上,常采用“盐硝联产工艺”生产高纯度食盐,还可以制得硫酸钠。
卤水中主要含有NaCl,还含有少量Na2SO4、CaSO4、MgSO4、CaCl2、MgCl2、FeCl3,用火碱和烟道气中的CO2为原料净化卤水,符合低碳经济发展要求。
分析流程,回答问题:
(1)反应器1中主要除去的离子是____________(填符号)。
(2)烟道气通入反应器2前要脱硫,是为了除去有害气体____________(填化学式)。
反应器2中生成沉淀的化学方程式____________________________________(写一个)。
(3)下表为NaCl和Na2SO4在不同温度时的溶解度:
温度/℃
0
10
20
30
32.4
40
50
60
70
80
90
100
溶解度/g
35.7
35.8
36.0
36.3
36.4
36.6
37.0
37.3
37.8
38.4
39.0
39.8
4.9
9.1
19.5
40.8
52.0
48.8
46.2
45.3
44.3
43.7
42.7
42.5
从析盐罐中排出的溶液a,在温度不变的条件下,每10g水中含有NaCl约____________g。
为提高Na2SO4纯度,析硝罐中析出Na2SO4,需采用____________(填“升温”或“降温”)结晶方法。
【答案】
(1)Mg2+、Fe3+
(2)SO2Na2CO3+CaCl2
CaCO3↓+2NaCl
(3)3.64升温
【解析】
(1)氢氧根离子和镁离子反应会生成氢氧化镁沉淀,和铁离子反应会生成氢氧化铁沉淀,所以反应器1中主要除去的离子是:
Mg2+、Fe3+。
(2)二氧化硫有毒,会污染空气,所以烟道气通入反应器2前要脱硫,是为了除去有害气体SO2,二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:
Na2CO3+CaCl2
CaCO3↓+2NaCl。
(3)32.4℃时,氯化钠的溶解度是36.4g,即100g水中最多溶解度36.4g的氯化钠,所以10g水中含有3.64g的氯化钠,原温度为32.4g,降温的话氯化钠也可能析出,而升温的话,氯化钠溶解度增大,不会析出,硫酸钠的溶解度减小,结晶析出,所以采用升温结晶的方法。
9.【2019年江西省】2020年奥运会奖牌制作原料来自于电子垃圾中提炼出来的金属。
从废线路板中提炼贵重金属和制备硫酸铜晶体的一种工艺流程如图:
已知:
在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
(1)操作①的名称是____________。
(2)提炼出的贵重金属可制作奖牌,其成分是____________。
(3)调节pH的主要目的是除去滤液中____________(填金属离子符号);
(4)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式:
____________________________________。
【答案】
(1)过滤
(2)金
(3)Al3+和Fe3+
(4)Cu+H2O2+H2SO4
CuSO4+2H2O
【解析】
(1)操作①得到固体和液体,所以是过滤。
(2)提炼出的贵重金属可制作奖牌,其中有金,所以其成分是金。
(3)调节pH,根据生成固体氢氧化铝和氢氧化铁,所以主要目的是除去滤液中Al3+和Fe3+。
(4)根据信息“在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
”,可知粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应生成硫酸铜和水,对应的化学方程式为Cu+H2O2+H2SO4
CuSO4+2H2O。
10.【2019年福建省】用如图所示装置模拟废液(含CuSO4、MgSO4及一些不溶物)净化实验、步骤如下:
Ⅰ.往沉降槽中加入适量絮凝剂(混凝剂)甲,加速沉降;
Ⅱ.往反应槽中缓慢加入一定浓度的NaOH溶液,至沉淀完全;
Ⅲ.通过盛装有活性炭的水槽后。
调节溶液的pH=7,存在指定容器中。
(1)测得原废液pH=5,显____________(填“酸性”“碱性”或“中性”)。
(2)甲是____________(写物质名称);操作X可使固体与液体分离,操作X是____________;活性炭的作用是____________。
(3)反应槽中生成沉淀的化学方程式为____________________________________(写一个)。
【答案】
(1)酸性
(2)明矾过滤吸附
(3)CuSO4+2NaOH
Cu(OH)2↓+Na2SO4(或MgSO4+2NaOH
Mg(OH)2↓+Na2SO4)
【解析】
(1)pH<7溶液呈酸性;pH=7溶液呈中性;pH>7溶液呈碱性。
测得原废液pH=5,显酸性。
(2)甲是一种常用的絮凝剂,加速沉降,常用的絮凝剂是明矾;操作X可使固体与液体分离,操作X是过滤;活性炭具有疏松多孔的结构,所以活性炭的作用是吸附。
(3)在反应槽中生成沉淀的反应有两个:
①硫酸铜和氢氧化钠反应生成氢氧化铜和硫酸钠,化学方程式为:
CuSO4+2NaOH
Cu(OH)2↓+Na2SO4;②硫酸镁和氢氧化钠反应生成氢氧化镁和硫酸钠,化学方程式为:
MgSO4+2NaOH
Mg(OH)2↓+Na2SO4。
11.【2019年重庆市A】某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。
他们设计了如图所示的实验流程:
供选试剂:
K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
(1)步骤①中,分离A、B的实验操作名称是____________,试剂a是__________________。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是____________(双选,填序号)。
A.NaOH溶液B.CaCl2溶液
C.NaCl溶液D.AgNO3和HNO3混合溶液
(3)步骤③中,发生反应的化学方程式为____________________________________。
(4)要达到预期的目的,还需要改进的方法为____________________________________。
【答案】
(1)过滤K2CO3溶液
(2)BD
(3)BaCO3+2HCl
BaCl2+H2O+CO2↑
(4)加入过量试剂a改为适量的试剂a
【解析】
(1)步骤①是将沉淀与滤液分离,实验操作名称是过滤。
试剂a是K2CO3溶液,碳酸钾能与氯化钡溶液反应生成碳酸钡沉淀和氯化钾溶液,不会生成新的杂质。
(2)沉淀B是碳酸钡沉淀,表面残留少量滤液是氯化钾和碳酸钾溶液,为了检验沉淀B是否洗涤干净,可向步骤②的最后一次洗涤液中加入的试剂是CaCl2溶液、AgNO3和HNO3混合溶液,分别能检验碳酸钾和氯化钾是否洗涤干净。
(3)步骤③中碳酸钡与试剂b反应,应生成氯化钡溶液,b应为稀盐酸,碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,反应的化学方程式为BaCO3+2HCl
BaCl2+H2O+CO2↑。
(4)滤液A中含有过量的碳酸钾溶液,因此,加入过量试剂a改为适量的试剂a。
12.【2019年江苏省苏州市】实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO3•3H2O。
其主要实验过程如图:
已知:
SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为________________________________________________和________________________________________________。
(2)“过滤Ⅱ”所得滤液中含有的主要离子有________________________(填离子符号)。
(3)“反应”步骤前后均有过滤,能否省去“过滤Ⅰ”只进行“过滤Ⅱ”。
____________(填“能”或“否”),理由是________________________。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是____________________________________。
【答案】
(1)MgO+H2SO4
MgSO4+H2OMgCO3+H2SO4
MgSO4+H2O+CO2↑
(2)Na+、
、
(3)否导致产品不纯
(4)避免制备产品消耗更多的碳酸钠
【解析】
(1)“酸溶”时是氧化镁以及碳酸镁与硫酸反应,对应的化学方程式为MgO+H2SO4
MgSO4+H2O和MgCO3+H2SO4
MgSO4+H2O+CO2↑。
(2)滤液I为生成的硫酸以及生成的硫酸镁的混合溶液,和过量碳酸钠反应,生成硫酸钠以及碳酸镁,还剩余碳酸钠,所以“过滤Ⅱ”所得滤液中含有的主要离子有Na+、
、
。
(3)“反应”步骤前后均有过滤,能否省去“过滤Ⅰ”只进行“过滤Ⅱ”。
不能,因为导致得到的产品因为混油二氧化硅而不纯。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是过量的硫酸需要加入碳酸钠进行去除,所以是避免制备产品消耗更多的碳酸钠。
13.【2019年江苏省盐城市】盐城濒临黄海,拥有巨大的天然宝库。
(1)海堤树林茂密,让人清新呼吸。
①树林中的绿色植物通过光合作用,吸收____________(填化学式),放出O2,将____________能转化为化学能。
②树林中富含抗氧化防衰老的负氧离子。
一种负氧离子(O2−)的一个原子团是由一个O2分子俘获了空气中一个自由电子形成的微粒,每个O2−中共含有____________个电子。
(2)滩涂花海飘香,使人流连忘返。
①鲜花的香味在空气中扩散,是大量的带有香味的分子____________________的结果。
②培育鲜花的某种营养液呈蓝色,可能由KNO3、Ca(NO3)2、CuCl2中的一种或几种物质配制而成,其中Ca、N的元素质量比为1∶1,则该营养液中含有____________种溶质。
从均衡植物所需营养元素的角度分析,营养液中还需补充____________(填元素符号)。
(3)大海资源丰富,引人不断探索。
从海水中可以提取粗盐(含少量泥沙和CaCl2、MgSO4等可溶性杂质)。
小明利用如图流程进行除杂,得到精盐。
①操作1需要在____________(填字母序号)中进行。
A.研钵B.量筒C.烧杯D.广口瓶
②操作2的步骤为溶解、过滤、____________、结晶,过滤操作中玻璃棒的作用是____________。
③操作3的步骤为“盐洗”(即用NaCl溶液浸洗粗盐,以溶解除去其中可溶性杂质),过滤、烘干,则“盐洗”溶液应选用NaCl的____________(填“饱和”或“不饱和”)溶液。
④在农业生产上,常用质量分数为16%的NaCl溶液选种。
小明称取实验制得的精盐l6g,加入盛有84mL蒸馏水的烧杯里(实验条件下,水的密度为1g·mL−1),完全溶解。
配制所得的NaCl溶液的浓度低于16%,原因是________________________________________________。
⑤若利用化学方法除去粗盐中CaCl2、MgSO4两种杂质,可在粗盐溶液中依次加入稍过量的三种溶液:
BaCl2溶液、____________(填化学式)溶液、Na2CO3溶液。
允分反应后过滤,加入过量稀盐酸,搅拌、煮沸。
【答案】
(1)①CO2太阳②17
(2)①不断运动②3P
(3)①A②蒸发引流③饱和
④精盐不纯有杂质或未完全烘干⑤NaOH
【解析】
(1)①树林中的绿色植物通过光合作用,吸收二氧化碳放出O2,将太阳能转化为化学能。
②每个氧原子含有8个质子,核外有8个电子,所以每个负氧离子含有17个电子。
(2)①鲜花的香味在空气中扩散,是大量的带有香味的分子不断运动的结果。
②在Ca(NO3)2中Ca和N的质量比=40∶(14×2)=10∶7>1∶1,溶液中一定含有KNO3;且溶液呈蓝色,所以含有CuCl2;该营养液中含有三种溶质;农作物需要最多的元素有三种,分别为N、P、K,从均衡植物所需营养元素的角度分析,营养液中还需补充P。
(3)①把大颗粒的粗盐制成小颗粒的粗盐需要在研钵中进行,故选A。
②粗盐的提纯分为溶解、过滤、蒸发、结晶四步;过滤操作中玻璃棒的作用是引流。
③“盐洗”的目的是洗去其他可溶性杂质,留下氯化钠固体,则“盐洗”溶液应选用NaCl的饱和溶液,这样氯化钠固体才不会溶解,只溶解其他可溶性杂质。
④配制所得的NaCl溶液的浓度低于16%,原因是精盐不纯有杂质或未完全烘干。
⑤若利用化学方法除去粗盐中CaCl2、MgSO4两种杂质,先加入稍过量的BaCl2溶液除去硫酸根离子;再加入稍过量的氢氧化钠溶液除去镁离子;再加入稍过量的碳酸钠溶液除去溶液中钙离子和钡离子;允分反应后过滤,最后加入过量稀盐酸,搅拌、煮沸。