元素周期表及常用元素详解.docx
《元素周期表及常用元素详解.docx》由会员分享,可在线阅读,更多相关《元素周期表及常用元素详解.docx(97页珍藏版)》请在冰豆网上搜索。
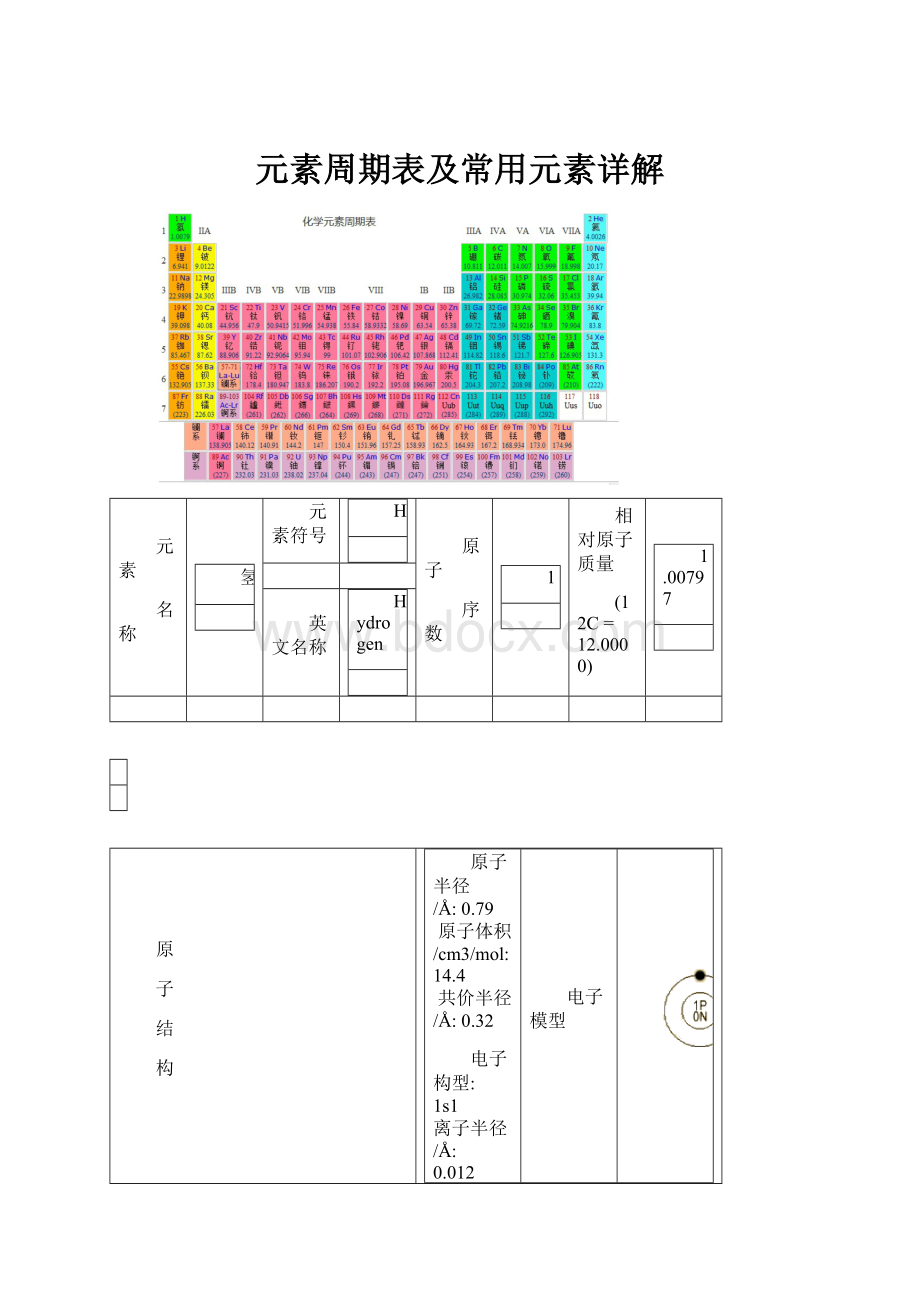
元素周期表及常用元素详解
元素
名称
氢
元素符号
H
原子
序数
1
相对原子质量
(12C=12.0000)
1.00797
英文名称
Hydrogen
原
子
结
构
原子半径/Å:
0.79 原子体积/cm3/mol:
14.4 共价半径/Å:
0.32
电子构型:
1s1 离子半径/Å:
0.012 氧化态:
Ⅰ
电子模型
发
现
1766年,在英国伦敦,由H.Cavendish发现。
来
源
在宇宙中最丰富的元素,主要和氧结合,以水的形式存在与自然界,也存在于矿井、油和汽井之中。
用途
用于生产氨、乙醇、氯化氢、溴化氢、植物油和不饱和烃的氢化,火箭燃料,低温学研究等。
有两个同位素:
氘(D)和氚(T)。
物
理
性
质
状态:
无味、无色、无臭、极易燃烧的气体。
熔点(℃):
-258.975 沸点(℃):
-252.732 密度(g/L/273K,1atm):
0.0899 自燃点/℃:
500
比热/J/gK:
14.304 蒸发热/KJ/mol:
0.44936 熔化热/KJ/mol:
0.05868 闪点/℃:
253
导电率:
-- 导热系数:
0.001815
化
学
性
质
地
质
数
据
丰 度 滞留时间/年:
太阳(相对于H=1×1012):
最丰富的元素 海水中/p.p.m.:
作为水的成分存在于海水中,也有一些气体H2
地壳/p.p.m.:
1520 溶在其中。
大气/p.p.m.(体积):
0.5
生
物
数
据
人体中含量 肝/p.p.m.:
93000
器官中:
肌肉/p.p.m.:
93000
血/mgdm-3:
以水存在于血液中 日摄入量:
骨/p.p.m.:
52000 人(70Kg)均体内总量:
7kg
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:
氕、氘、氚。
氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米³/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。
在高温下,氢是高度活泼的。
除稀有气体元素外,几乎所有的元素都能与氢生成化合物。
非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
元素
名称
氦
元素符号
He
原子
序数
2
相对原子质量
(12C=12.0000)
4.002602
英文名称
Helium
原
子
结
构
原子半径/Å:
0.49 原子体积/cm3/mol:
共价半径/Å:
0.93
电子构型:
1s2 离子半径/Å:
氧化态:
0
电子模型
发
现
NormanLockyer和EdwardFrankland在1868年的一次日食期间,从太阳光谱中观测到。
来
源
在宇宙中,氦是仅次于氢的第二个最丰富的元素。
用途
用于深海潜水,超低温研究,核能系统的冷却剂。
物
理
性
质
状态:
轻的无臭、无色、无味的惰性气体。
熔点(℃):
-272.05 沸点(℃):
-268.785 密度(g/L/273K,26atm):
0.1785
比热/J/gK:
5.193 蒸发热/KJ/mol:
熔化热/KJ/mol:
5.23
导电率:
导热系数/W/cmK:
0.00152
化
学
性
质
地
质
数
据
丰 度 滞留时间/年:
太阳(相对于H=1×1012):
6.31×1010 海水中/p.p.m.:
4×10-6
地壳/p.p.m.:
0.008
大气/p.p.m.(体积):
5.2
生
物
数
据
人体中含量 肝/p.p.m.:
零
器官中:
肌肉/p.p.m.:
零
血/mgdm-3:
痕量 日摄入量:
骨/p.p.m.:
零 人(70Kg)均体内总量:
氦,原子序数2,原子量4.002602,为稀有气体的一种。
元素名来源于希腊文,原意是“太阳”。
1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。
后有人用无机酸处理沥青铀矿时得到一种不活泼气体,1895年英国科学家拉姆赛用光谱证明就是氦。
以后又陆续从其他矿石、空气和天然气中发现了氦。
氦在地壳中的含量极少,在整个宇宙中按质量计占23%,仅次于氢。
氦在空气中的含量为0.0005%。
氦有两种天然同位素:
氦3、氦4,自然界中存在的氦基本上全是氦4。
氦在通常情况下为无色、无味的气体;熔点-272.2°C(25个大气压),沸点-268.9°C;密度0.1785克/升,临界温度-267.8°C,临界压力2.26大气压;水中溶解度8.61厘米³/千克水。
氦是唯一不能在标准大气压下固化的物质。
液态氦在温度下降至2.18K时,性质发生突变,成为一种超流体,能沿容器壁向上流动,热传导性为铜的800倍,并变成超导体;其比热容、表面张力、压缩性都是反常的。
氦是最不活泼的元素,基本上不形成什么化合物。
氦的应用主要是作为保护气体、气冷式核反应堆的工作流体和超低温冷冻剂等等。
元素
名称
锂
元素符号
Li
原子
序数
3
相对原子质量
(12C=12.0000)
6.941
英文名称
Lithium
原
子
结
构
原子半径/Å:
2.05 原子体积/cm3/mol:
13.1 共价半径/Å:
1.23
电子构型:
1s22s1 离子半径/Å:
0.76 氧化态:
Ⅰ
电子模型
发
现
1817年在瑞典的斯德哥尔摩,由J.A.Arfvedson发现。
来
源
锂辉石、锂云母和盐湖等,可由电解氯化锂溶液而制得。
用途
用于电池、玻璃、陶瓷、润滑剂、传热介质、火箭驱动剂、vitaminA的合成等方面。
物
理
性
质
状态:
软的银白色金属,是最轻的金属。
熔点(℃):
180.7 沸点(℃):
1342 密度(g/CC,300K):
0.534
比热/J/gK:
3.6 蒸发热/KJ/mol:
145.92 熔化热/KJ/mol:
3
导电率/106/cm:
0.108 导热系数/W/cmK:
0.847
化
学
性
质
地
质
数
据
丰 度 滞留时间/年:
2×106
太阳(相对于H=1×1012):
10 海水中/p.p.m.:
0.17
地壳/p.p.m.:
20
生
物
数
据
人体中含量 肝/p.p.m.:
0.025
器官中:
肌肉/p.p.m.:
0.023
血/mgdm-3:
0.004 日摄入量/mg:
0.1-2
骨/p.p.m.:
1.3 人(70Kg)均体内总量/mg:
7
锂,原子序数3,原子量6.941,是最轻的碱金属元素。
元素名来源于希腊文,原意是“石头”。
1817年由瑞典科学家阿弗韦聪在分析透锂长石矿时发现。
自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷铝石等。
在人和动物机体、土壤和矿泉水、可可粉、烟叶、海藻中都能找到锂。
天然锂有两种同位素:
锂6和锂7。
金属锂为一种银白色的轻金属;熔点为180.54°C,沸点1342°C,密度0.534克/厘米³,硬度0.6。
金属锂可溶于液氨。
锂与其它碱金属不同,在室温下与水反应比较慢,但能与氮气反应生成黑色的一氮化三锂晶体。
锂的弱酸盐都难溶于水。
在碱金属氯化物中,只有氯化锂易溶于有机溶剂。
锂的挥发性盐的火焰呈深红色,可用此来鉴定锂。
锂很容易与氧、氮、硫等化合,在冶金工业中可用做脱氧剂。
锂也可以做铅基合金和铍、镁、铝等轻质合金的成分。
锂在原子能工业中有重要用途。
元素
名称
铍
元素符号
Be
原子
序数
4
相对原子质量
(12C=12.0000)
9.012182
英文名称
Beryllium
原
子
结
构
原子半径/Å:
1.4 原子体积/cm3/mol:
5 共价半径/Å:
0.9
电子构型:
1s22s2 离子半径/Å:
0.35 氧化态:
II
电子模型
发
现
1797年在法国巴黎,由NicholasLouisVauquelin发现。
来
源
主要以绿玉[AlBe3(Si6O18)]和金绿玉(Al2BeO4)的形式存在于自然界。
用途
能吸收大量的热量,因此用于太空船、导弹火箭、飞机等。
也用于制造轻质合金。
物
理
性
质
状态:
坚固、硬的灰白色金属,是最轻的硬质金属。
熔点(℃):
1278 沸点(℃):
2970 密度(g/cc,300K):
1.848
比热/J/gK:
1.82 蒸发热/KJ/mol:
292.4 熔化热/KJ/mol:
12.2
导电率/106/cm:
0.313 导热系数/W/cmK:
2.01
化
学
性
质
地
质
数
据
丰 度 滞留时间/年:
4000
太阳(相对于H=1×1012):
14 海水中/p.p.m.
地壳/p.p.m.:
2.6 大西洋表面:
8.8×10-8 太平洋表面:
3.5×10-8
大西洋深处:
17.5×10-8 太平洋深处:
22×10-8
生
物
数
据
人体中含量 肝/p.p.m.:
0.0016
器官中:
肌肉/p.p.m.:
0.00075
血/mgdm-3:
<1×10-5 日摄入量/mg:
0.01
骨/p.p.m.:
0.003 人(70Kg)均体内总量/mg:
0.036
铍,原子序数4,原子量9.012182,是最轻的碱土金属元素。
1798年由法国化学家沃克兰对绿柱石和祖母绿进行化学分析时发现。
1828年德国化学家维勒和法国化学家比西分别用金属钾还原熔融的氯化铍得到纯铍。
其英文名是维勒命名的。
铍在地壳中含量为0.001%,主要矿物有绿柱石、硅铍石和金绿宝石。
天然铍有三种同位素:
铍7、铍8、铍10。
元素
名称
硼
元素符号
B
原子
序数
5
相对原子质量
(12C=12.0000)
10.811
英文名称
Boron
原
子
结
构
原子半径/Å:
1.17 原子体积/cm3/mol:
4.6 共价半径/Å:
0.82
电子构型:
1s22s2p1 离子半径/Å:
0.23 氧化态:
III
电子模型
发
现
1808年,法国巴黎的L.J.LussacandL.J.Thenard和英国伦敦的HumphryDavy先生发现。
来
源
从kernite获得,即硼砂(Na2B4O7·10H2O)。
用途
和钛钨一起制轻质抗热合金,也用于抗热玻璃的制造,和眼睛消毒液的配制。
物
理
性
质
状态:
黄棕色非金属晶体 。
熔点(℃):
2300 沸点(℃):
4002 密度(g/cc,300K):
2.34
比热/J/gK:
1.02 蒸发热/KJ/mol:
489.7 熔化热/KJ/mol:
50.2
导电率/106/cm:
1.0E-12 导热系数/W/cmK:
0.274
化
学
性
质
地
质
数
据
丰 度 滞留时间/年:
1×107
太阳(相对于H=1×1012):
2.63×105 海水中/p.p.m.:
4.41
地壳/p.p.m.:
950
生
物
数
据
人体中含量 肝/p.p.m.:
0.4-3.3
器官中:
肌肉/p.p.m.:
0.33-1
血/mgdm-3:
0.13 日摄入量/mg:
1-3
骨/p.p.m.:
1.1-3.3 人(70Kg)均体内总量/mg:
18
硼,原子序数5,原子量10.811。
约公元前200年,古埃及、罗马、巴比伦曾用硼沙制造玻璃和焊接黄金。
1808年法国化学家盖·吕萨克和泰纳尔分别用金属钾还原硼酸制得单质硼。
硼在地壳中的含量为0.001%。
天然硼有2种同位素:
硼10和硼11,其中硼10最重要。
硼为黑色或银灰色固体。
晶体硼为黑色,熔点约2300°C,沸点2550°C,密度2.34克/厘米³,硬度仅次于金刚石,较脆。
硼在室温下比较稳定,即使在盐酸或氢氟酸中长期煮沸也不起作用。
硼能和卤组元素直接化合,形成卤化硼。
硼在600~1000°C可与硫、锡、磷、砷反应;在1000~1400°C与氮、碳、硅作用,高温下硼还与许多金属和金属氧化物反应,形成金属硼化物。
这些化合物通常是高硬度、耐熔、高电导率和化学惰性的物质,常具有特殊的性质。
硼的应用比较广泛。
硼与塑料或铝合金结合,是有效的中子屏蔽材料;硼钢在反应堆中用作控制棒;硼纤维用于制造复合材料等。
元素
名称
硼
元素符号
B
原子
序数
5
相对原子质量
(12C=12.0000)
10.811
英文名称
Boron
原
子
结
构
原子半径/Å:
1.17 原子体积/cm3/mol:
4.6 共价半径/Å:
0.82
电子构型:
1s22s2p1 离子半径/Å:
0.23 氧化态:
III
电子模型
发
现
1808年,法国巴黎的L.J.LussacandL.J.Thenard和英国伦敦的HumphryDavy先生发现。
来
源
从kernite获得,即硼砂(Na2B4O7·10H2O)。
用途
和钛钨一起制轻质抗热合金,也用于抗热玻璃的制造,和眼睛消毒液的配制。
物
理
性
质
状态:
黄棕色非金属晶体 。
熔点(℃):
2300 沸点(℃):
4002 密度(g/cc,300K):
2.34
比热/J/gK:
1.02 蒸发热/KJ/mol:
489.7 熔化热/KJ/mol:
50.2
导电率/106/cm:
1.0E-12 导热系数/W/cmK:
0.274
化
学
性
质
地
质
数
据
丰 度 滞留时间/年:
1×107
太阳(相对于H=1×1012):
2.63×105 海水中/p.p.m.:
4.41
地壳/p.p.m.:
950
生
物
数
据
人体中含量 肝/p.p.m.:
0.4-3.3
器官中:
肌肉/p.p.m.:
0.33-1
血/mgdm-3:
0.13 日摄入量/mg:
1-3
骨/p.p.m.:
1.1-3.3 人(70Kg)均体内总量/mg:
18
硼,原子序数5,原子量10.811。
约公元前200年,古埃及、罗马、巴比伦曾用硼沙制造玻璃和焊接黄金。
1808年法国化学家盖·吕萨克和泰纳尔分别用金属钾还原硼酸制得单质硼。
硼在地壳中的含量为0.001%。
天然硼有2种同位素:
硼10和硼11,其中硼10最重要。
硼为黑色或银灰色固体。
晶体硼为黑色,熔点约2300°C,沸点2550°C,密度2.34克/厘米³,硬度仅次于金刚石,较脆。
硼在室温下比较稳定,即使在盐酸或氢氟酸中长期煮沸也不起作用。
硼能和卤组元素直接化合,形成卤化硼。
硼在600~1000°C可与硫、锡、磷、砷反应;在1000~1400°C与氮、碳、硅作用,高温下硼还与许多金属和金属氧化