高考化学专题突破无机推断题kf.docx
《高考化学专题突破无机推断题kf.docx》由会员分享,可在线阅读,更多相关《高考化学专题突破无机推断题kf.docx(21页珍藏版)》请在冰豆网上搜索。
高考化学专题突破无机推断题kf
高考化学专题突破——无机推断题
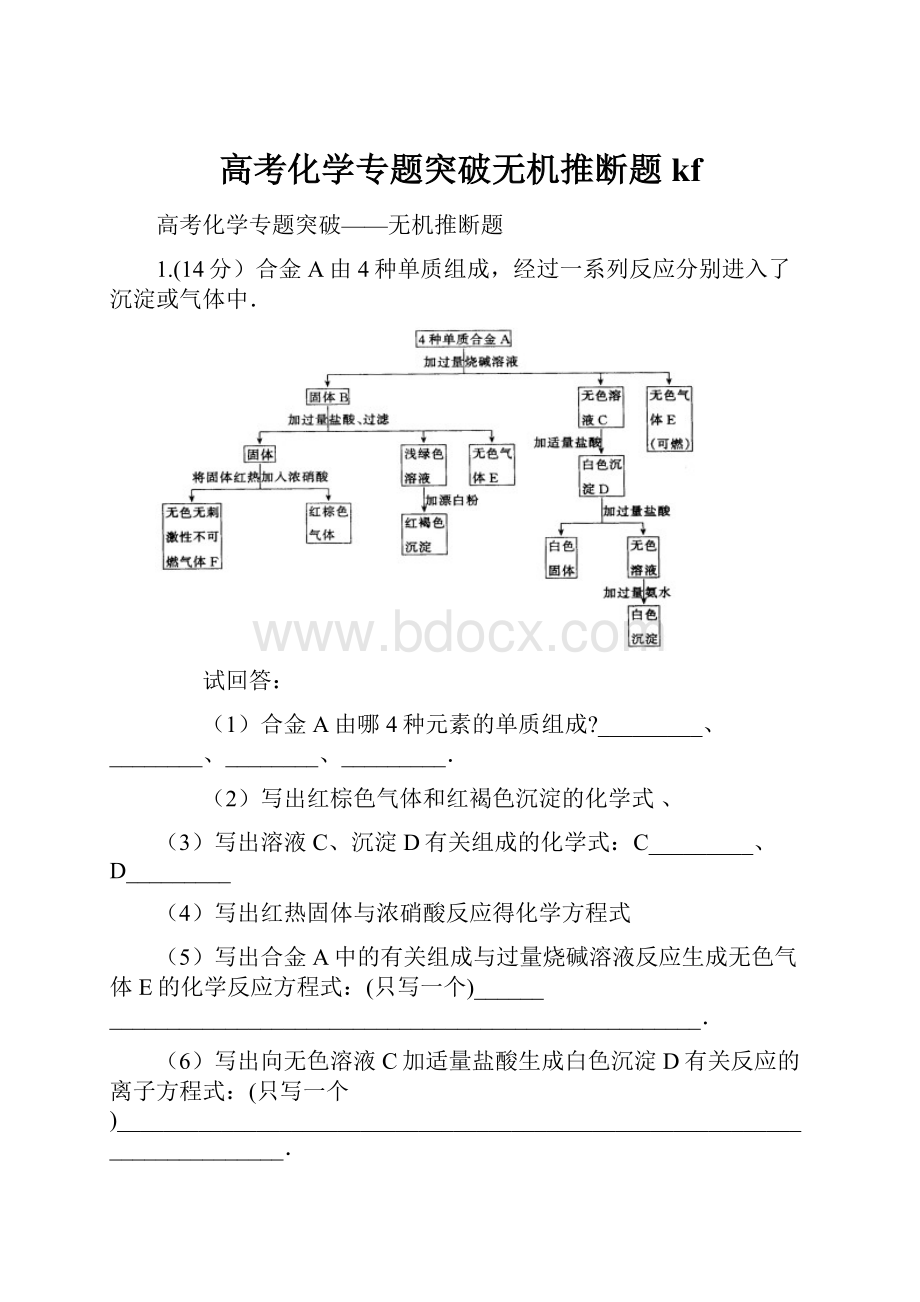
1.(14分)合金A由4种单质组成,经过一系列反应分别进入了沉淀或气体中.
试回答:
(1)合金A由哪4种元素的单质组成?
_________、________、________、_________.
(2)写出红棕色气体和红褐色沉淀的化学式、
(3)写出溶液C、沉淀D有关组成的化学式:
C_________、D_________
(4)写出红热固体与浓硝酸反应得化学方程式
(5)写出合金A中的有关组成与过量烧碱溶液反应生成无色气体E的化学反应方程式:
(只写一个)_________________________________________________________.
(6)写出向无色溶液C加适量盐酸生成白色沉淀D有关反应的离子方程式:
(只写一个)__________________________________________________________________________.
2.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:
(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
(b)反应①②是化工生产中的重要反应。
(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。
(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。
(e)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
⑴反应③的化学方程式____________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
3.(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。
下述为相关实验步骤和实验现象:
请回答:
(1)写出A、B和C的化学式:
A,B,C。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
,。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式:
。
4.(15分)以下一些氧化物和单质之间可发生如右图所示的反应:
其中,氧化物(Ⅰ)是红棕色固体、氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是。
氧化物(Ⅱ)的化学式(分子式)是。
(2)反应①的化学方程式是。
反应②的化学方程式是。
反应③的化学方程式是。
5.下图每个字母代表一种反应物或一种生成物。
已知常温下A是固体,B、C、D、E、F、G均为气态化合物,X为气态单质。
根据下图填空(有些反应物条件已经略去)
(1)A的化学式为。
(2)若Y是,则I和H溶液中溶质属于(填酸、碱、盐、氧化物)类。
(3)写出发生下列反应的化学方程式
BC:
;EF:
(4)写出E与F在一定条件下反应,且生成物中有一种单质产生的反应的化学方程式
6.(9分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。
它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的名称或化学式:
B,F,H。
(2)指出MnO2在相关反应中的作用:
反应①中是剂,反应②中是剂。
(3)若反应①是在加热条件下进行,则A是;若反应①是在常温条件下进行,则A是。
(4)写出B与MnO2共热获得D的化学方程式。
7.下图中A~L分别表示反应中的一种常见物质,E、F、I在通常状况下是气体单质,其中E为有剌激性气味的气体,X、Y是常见的金属单质,参加反应的水以及生成的水在图中已略去。
填写下列空白:
(1)E是_______________;J是__________________。
(写化学式)
(2)写出D+X→F+G的离子方程式:
________________________________________。
(3)写出A+B→C+E的化学方程式:
_________________________________________。
8.下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
请按要求填空:
(1)写出下列物质的化学式:
A,E,F,Y。
(2)反应⑤的化学方程式为:
。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为:
。
9.A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物。
这些化合物和单质之间存在如下图所示的关系。
据此判断:
(1)在甲、乙两种化合物中,不含有组成A元素的化合物是_________,不含组成B元素的化合物是_______________(用“甲”、“乙”填写)。
(2)单质A是_____________(填“金属”、“非金属”或“既可以是金属又可以是非金属”)。
(3)若单质A是___________,则单质B、C分别是______________;若单质A是________,则单B、C分别是_____________;若单质A是___________,则单质B、C分别是________________。
10.贮气袋中存有有色气体,可能是
、
、
、HCl、
、
蒸气等气体中的几种,进行以下操作:
①通少许于水中,得无色溶液;②通少许于
溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶中,导出的气体再通入澄清石灰水,产生浑浊.则:
由①可判断,一定存在_________;一定不存在________.由②可判断,一定存在_________;一定不存在_________.由③、④可判断,一定存在________;可能存在的是________.
11.(7分)某河道两旁有甲乙两厂.它们排放的工业废水中,共含
、
、
、
、
、
六种离子.
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、_________、________.
(2)乙厂的废水中含有另外三种离子.如果加一定量_______________(选填:
活性炭、硫酸亚铁、铁粉),可以回收其中的金属_______________(填写金属元素符号).
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________
_________(填写离子符号)转为沉淀.经过滤后的废水主要含__________________,可用来浇灌农田.
12.(7分)下列关系图中,A是一种正盐,D的式量比C大16,E是酸.当X无论是强酸还是强碱时都有如下转化关系:
当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素
回答下列问题(用化学式填写):
(1)A是________________,Y是_______________,Z是________________.
(2)当X是强碱时,E是________________.
(3)当X是强酸时,E是________________.
(4)写出A与X反应的离子方程式_______________.
13.(17分)有W、X、Y、Z四种原子序数依次增大的元素。
已知:
①W与X或Y形成的化合物的焰色反应均呈黄色
②X原子次外层电子数为核外电子总数的一半
③X离子、Y离子均与Y的气态氢化物具有相同电子数
④Z可与Y组成化合物ZY2和ZY3
请回答:
(1)Z元素在元素周期表中的位置是第周期族
(2)W2X的电子式为,其水溶液呈碱性的原因是(用离子方程式表示)
。
(3)写出工业电解饱和WY溶液的化学方程式。
当电极上通过0.1mol电子时,阴极生成的气体是,其物质的量为。
(4)将ZY3饱和溶液滴入沸水可得到红褐色液体,此液体具有的性质是
a.光束通过该液体时,形成光亮的通道
b.插入电极通直流电,阳极附近液体颜色加深
c.将该液体加热、蒸干并灼烧后,有红棕色物质生成
d.该液体中分散质粒子可以透过半透膜
(5)在氧气中燃烧4gX单质生成一种有刺激性气味的气体,同时放出akJ热量,写出该反应的热化学方程式。
14.(15分)甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系(反应中生成的水已略去):
(1)丙的名称是_____________;C的化学式是_____________;X属_____________晶体。
(2)A+D→C的反应属于下列何种反应类型(填序号)_____________。
A.化合反应B.氧化还原反应
C.非氧化还原反应D.离子反应
(3)工业生产中,将D转化为E的反应条件是_______________________________________。
(4)写出A与H2O反应的化学方程式:
__________________________。
15.(15分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。
B原子的最外层电子数是其次外层电子数的2倍;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X;E与A同主族;A、B、C这三种元素,每一种与D都能形成元素的原子个数比不相同的若干种化合物。
(1)写出下列元素的元素符号:
A_____________,E_____________。
(2)D在周期表中位于第_____________周期,第_____________纵行。
(3)B的最高价氧化物的电子式为_____________。
(4)E和D形成的化合物与水反应的化学方程式为_____________。
(5)盐X的水溶液显_____________(填“酸”“碱”或“中”)性,其原因用离子方程式表示是:
__________________________。
16.(14分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。
已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。
试完成下列问题:
(1)写出下列元素的符号:
A________,D_______,E_______。
(2)用电子式表示B、F形成的化合物_______________。
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式是________________。
(4)D的固态氧化物是___________晶体。
含nmolD的氧化物的晶体中含D-O共价键为_____________mol。
17.A~H都是初中化学中的常见物质,它们之间的转化关系如图14所示。
A是天然气的主要成分,E是一种常见的食品干燥剂。
请回答:
(1)A的化学式为;
(2)反应③的基本反应类型是;
(3)反应②的化学方程式为;
(4)反应④的化学方程式为。
18.右图表示的是物质A-H相互间的关系(“→”表示物质间的转化关系,“——”表示两端的物质能发生化学反应)。
A、C都是单质,气体C常用于灭火,F是一种蓝色溶液,可用于配制农药波尔多液。
请你回答:
(1)C的化学式,H可能是;
(2)写出标号①、②、③、④的化学方程式:
①②
③④
✧2009年全国理综卷第29题(15分)
已知周期表中,元素Q、R、W、Y与元素X相邻,Y的最高化全价氧化物的水化物是强酸,回答下列问题
(1)W与Q可以形成一种高温结构陶瓷材料。
W的氧化物分子呈正四面体结构,W的氧化物的晶体类型是__________________________________
(2)Q的具有相同化合价且可以相互转变的氧化物是__________________________
(3)R和Y形成的二元化合物中,R呈现最高化合物的化学式是__________________
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)__________________其原因是_____________________
②电子总数相同的氢化物的化学式和立体结构分别是___________________
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:
W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HC1气体。
W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料,上述相关反应的化学方程式(各物质用化学式表示)是____________________
1、(14分)
(1)Fe、C、Si、Al
(2)NO2、Fe(OH)3 (3)
、
、
(4)C+4HNO3(浓)===CO2+4NO2+2H2O
(5)2Al+2NaOH+2H2O==2NaAlO2+3H2或Si+2NaOH+H2O==Na2SiO3+2H2(6)SiO32-+2H++H2O==H4SiO4或AlO2-+H++H2O==Al(OH)3
2.解析:
根据题设的信息,化合物E是形成酸雨的污染物之一,推知可能为SO2;A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
常温下为气体的单质只有五种:
H2O2N2Cl2F2,则A为S,B为O2,E为SO2。
剩余的气体单质相互能化合且是化工生产中的重要反应,则C、D为H2和N2,F为NH3;化合物L为NaClO,化合物J相对分子质量为32且由两种元素组成,其中不可能含有Na(23)、Cl(35.5)、O(16),只能为N和H,化学式为N2H4。
答案:
⑴NH3+H2SO4=(NH4)2SO4;⑵N≡N;(NH4)2SO3或NH4HSO3
⑶ClO-+SO2+2OH-=Cl-+SO42-+H2O;⑷N2H4
【信息点汇总Ⅱ】颜色特征
1.常见有色气体:
Cl2(黄绿色)F2(淡黄绿色)NO2(红棕色)O3(淡蓝色)
2.常见有色溶液:
Cu2+:
绿色(浓的CuCl2溶液中)或蓝色(其它的铜盐溶液或CuCl2的稀溶液中);Fe3+:
棕黄色(浓溶液)或黄色(稀溶液);Fe2+:
浅绿色;MnO4-:
紫红色;Br2水(橙黄色)
3.常见有色固体:
红色:
Cu(亮红色)Cu2O(红色)Fe2O3(铁锈红色)Fe(OH)3(红褐色)
黄色:
Na2O2(淡黄色)S(淡黄色)AgBr(淡黄色),AgI(黄)
蓝色:
CuSO4·5H2O(胆矾,蓝矾)
绿色:
Cu2(OH)2CO3(s)(铜绿或铜锈),FeSO4·7H2O(绿矾)
紫色:
I2(紫黑),KMnO4(紫黑)
黑色:
黑色的物质很多,为了便于记忆,可归为黑五类:
非金属单质C;MnO2;铁的化合物FeO、Fe3O4、FeS;铜的化合物CuO、CuS;金属硫化物:
PbS、AgS、FeS、CuS。
但其中会有一些交叉的归类,不影响记忆。
4.反应颜色特征:
(1)I2与淀粉变蓝;
(2)H2在Cl2中燃烧呈苍白色火焰。
(3) 钠元素的焰色反应为黄色,钾元素的焰色反应为浅紫色。
(4)遇酚酞变红的气体必是氨气。
(5)在空气中迅速由无色变为红棕色的气体是NO。
(6) Cl2通入含Br-溶液中,会出现橙色;加入有机溶剂,在有机溶剂层出现橙红色。
Cl2通入含I-的溶液中,会出现深黄色,加入有机溶剂,在有机溶剂层出现紫红色。
(7) 遇SCN-显红色或OH-遇生成红褐色沉淀或遇苯酚显紫色的离子是Fe3+。
(8)遇BaCl2溶液生成白色沉淀的溶液中可能含有Ag+或SO42-。
(9)Fe(OH)3:
红褐色。
Fe(OH)2:
白色沉淀,迅速地转变成灰绿色,最后变成红
棕色沉淀。
(10)CuS、Ag2S、PbS黑色沉淀均不溶于酸。
FeS:
黑色沉淀溶于酸。
(11) AgBr:
淡黄色沉淀,不溶于酸。
AgI、Ag3PO4:
黄色沉淀,其中Ag3PO4溶于酸,而AgI不溶于酸。
3.解析:
根据题设条件和颜色特征,很容易判断出C为AgI,D为I2,F为Cl2。
依次可推出A、B等物质。
答案:
(1)NaINaClOAgI
(2)2I-+ClO-+H2O=I2+Cl-+OH-I2+5ClO—+2OH—=2IO3-+5Cl-+H2O
(3)Fe3++SO32-+2H2O=Fe2-+SO42-+4H+
(4)Cl2+2NaOH=NaClO+NaCl+H2O
【信息点汇总Ⅲ】反应条件
(1).常温:
2Na+2H2O=2NaOH+H2↑2Na2O2+2H2O=4NaOH+O2↑
2F2+2H2O=4HF+O2H2+F2
2HF
(2).高温:
煅烧黄铁矿4FeS2+11O2
=2Fe2O3+8SO2;炼铁Fe2O3+3CO
=2Fe+3CO2
制水煤气H2O(g)+C
H2+COCO+H2O
CO2+H2;煅烧石灰石CaCO3
CaO+CO2
铁与水蒸汽Fe+H2O(g)
Fe3O4+H2;铝热反应2Al+Fe2O3
2Fe+Al2O3
制粗硅2C+SiO2
Si+2CO
制玻璃Na2CO3+SiO2
Na2SiO3+CO22CaCO3+SiO2
CaSiO3+CO2
(3).催化剂:
2H2O2
2H2O+O22KClO3
2KCl+3O2↑
(4).电解:
2NaCl+2H2O
2NaOH+Cl2↑+2H2↑2Al2O
4Al+3O2
2H2O
O2↑+2H2↑
(5).点燃条件:
Mg条在点燃条件下反应:
3Mg+N2=
Mg3N2
2Mg+O2=
2MgO2Mg+CO2=
C+2MgO
金属在氯气中点燃:
2Na+Cl2
2NaClCu+Cl2
CuCl22Fe+3Cl2
2FeCl3
铁在氯气中点燃:
3Fe+2O2
Fe3O4
(6).特殊条件:
N2+O2
2NOH2+Cl2
2HCl2HClO
2HCl+O22AgBr
2Ag+Br2
4.解析:
由物质颜色特征可知,(Ⅰ)是Fe2O3;由炼铁方程式Fe2O3+3CO
2Fe+3CO2可知,能与Fe2O3在高温条件下反应的氧化物为CO;由反应③信息推知单质(Ⅲ)为C氧化物(Ⅲ)H2O(气),此为制水煤气的重要反应。
其他问题即可解决。
答案:
⑴Fe2O3CO⑵①Fe2O3+3CO
2Fe+3CO2
②CO+H2O
CO2+H2③C+H2O
CO+H2(如写可逆号,同样给分)
【信息点汇总Ⅳ】转换关系特征:
2007年的新大纲中要求,“了解金属钠的物理性质,掌握钠和镁的化学性质”,“了解其他非金属元素(如:
H、O、S、N、P、C、Si)单质及某氧化物、氢化物的性质”。
而这些元素符合以下共同的转化关系:
5.解析:
根据前面总结的物质类型特征,即能与酸反应又能与碱反应物质且生成物为气态化合物,则A为弱酸的铵盐。
又因为X为气态单质,生成物又与X依次能反应,X为O2,A为NH4HSO3或(NH4)2SO3。
答案:
(1)NH4HSO3或(NH4)2SO3
(2)水(碱),酸(盐)
(3)2H2S+3O2=2SO2+2H2O,
(4)4NO+6NH3=5N2+6H2O
6.
(1)HCl(1分)Fe3O4(1分)FeCl3(1分)
(2)催化(1分)氧化(1分)(3)KClO3(1分)H2O2(1分)
(4)MnO2+4HCl(浓)
MnCl2+C12↑+2H2O(2分)
7.
(1)E是Cl2;J是Fe(OH)3。
(2)2OH-+2Al+2H2O=2AlO2-+3H2↑。
(3)2HCl+NaClO=Cl2↑+NaCl+H2O。
8.答案:
(1)H2O;N2;Ag;HCl。
(2)4NH3+5O2
4NO+6H2O。
(3)AgN3。
简析:
抓住题中某一条信息可立即推出G是NH3、Y是HCl、K是AgCl。
再根据G是氨气可逆向推得A是水、D是H2、C是O2、E是N2,正向推出J是NO(跟“反应⑤是工业制X的主要反应之一”相吻合)。
这里要求解题者在推理过程中能够敏捷地抓住题给信息从不同方向作出有用的判断,测试思维的灵活性。
由K是氯化银、Y是盐酸可推出I是硝酸银,进而可得出X是硝酸。
所以H是二氧化氮,F是单质银。
这里主要测试解题者能否在一个全新的问题背景中,运用已掌握的元素化合物基础知识作出判断。
综合以上信息可得知,B物质中含有银、氮两种元素,利用题给数据可计算出B的化学式为AgN3。
这一问难度较高,这是下面三个原因:
第一,这一问是建立在前几问的基础之上的,若答不出前几问,就无法回答这一问;第二,需经过定量计算才能作出判断;第三,“AgN3”是高中化学中没有出现过的一种物质,有的考生想不到或不敢相信自己的计算结果。
9.[解析]
(1)从图中可发现下列反应关系:
“单质B+单质C→化合物甲”,故甲中不含A元素;“单质A+单质C→化合物乙”,故乙中不含有B元素。
(2)从图示信息进行转换,可提炼出“单质A+化合物甲→单质B+化合物乙”该反应属置换反应。
置换反应有如下几种情况:
第一种情况:
金属单质置换出金属单质。
结合铝热反应可获得下列各种可能:
(a)A为铝、B为铁、C为氧气等(铝与金属氧化物如四氧化三铁、三氧化二铁、氧化铜、二氧化锰、五氧化二钒等多种氧化物进行的反应,因而可得出多组答案。
但由于题中限定了是短周期元素,可排除这些可能性)。
第二种情况:
非金属单质置换出非金属单质。
结合一些反应实例可获得答案(b)A、B、C依次为(下同)Cl2、S、H2;(c)O2、S、H2;(d)F2、O2、H2。
(还可进一步分析:
反应中单质表现了何种性质?
总结出:
氧化性A>B。
)这样,就可进而获得更多答案(e)Cl2、Br2、H2;(f)Cl2、I2、H2;(g)Br2、I2、H2;(h)I2、S、H2;(I)C、H2、O2(制水煤气);(j)C、Si、O2(工业上制硅);(k)Br2、S、H2;(l)Cl2、N2、H2;(m)Si、H2、F2。
第三种情况:
金属单质置换出非金属单质。
(n)4)Mg、C、O2。
第四种情况:
非金属单质置换出金属单质。
(o)H2、Cu、O2;(p)H2、Fe、O2;(q)C、Cu、O2(由于铁、铜等不是短周期元素,所以不合题意)。
答案为:
(1)甲;乙。
(2)单质A可以是金属也可以是非金属。
(3)可以有多组答案(见思路精析)。
10.
(1)
;
;
(2)HCl;
;(3)HCl、
、
11.
(1)
、
、
;
(2)铁粉,Ag(3)
、
、
、
;
12.D的式量比C大16,猜想Y是
.
的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A是弱酸的铵盐
(1)
(2)
(3)
(4)
或
13.(17分)
(1)2Al+6H+==