高考探究实验文档格式.docx
《高考探究实验文档格式.docx》由会员分享,可在线阅读,更多相关《高考探究实验文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
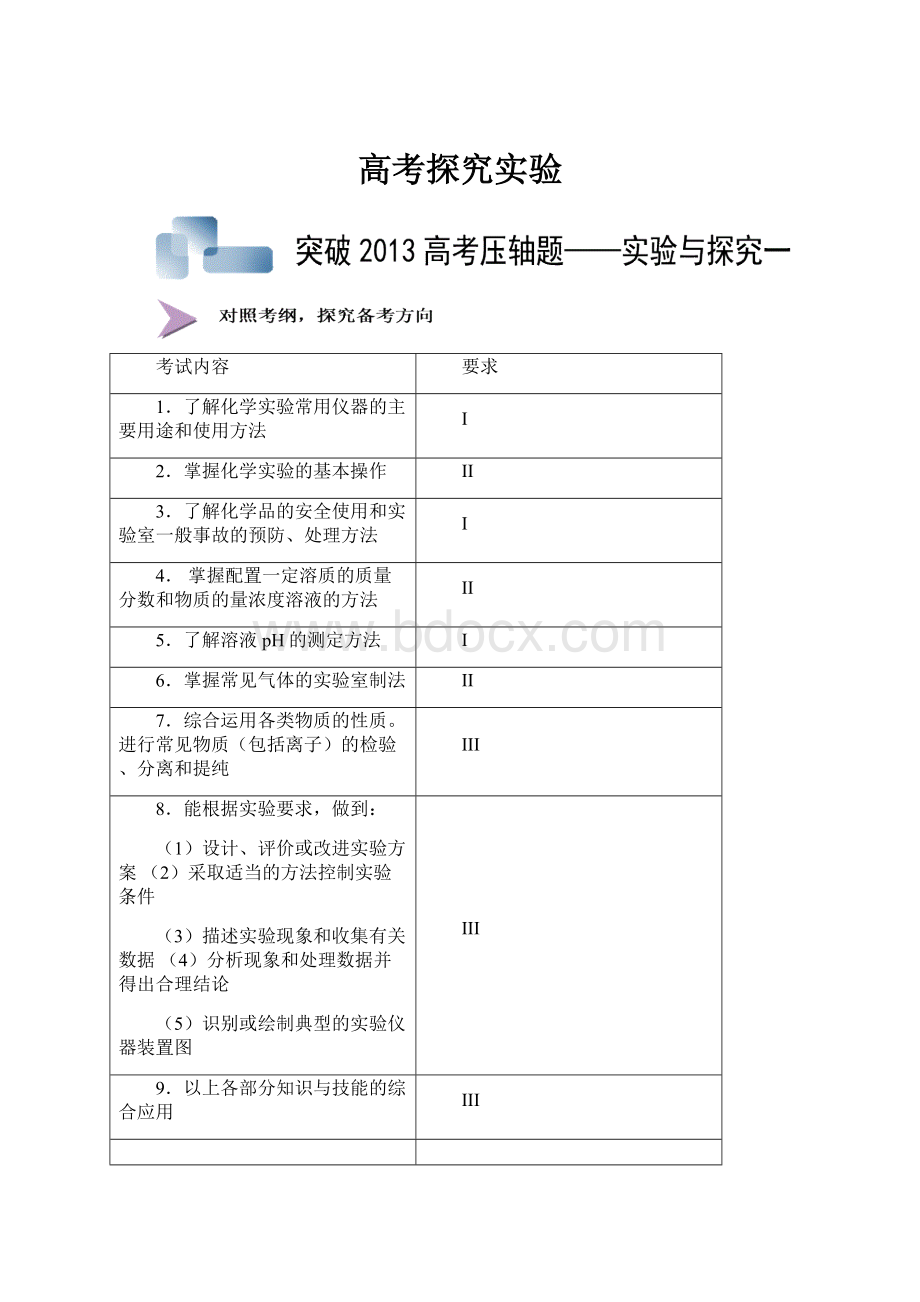
检查时间t4.则:
T1+t2+t3+t4与10分钟的关系?
2、核心方法——实验探究。
实验事实至上的原则;
考查思维整体性与逻辑性原则;
竞争反应原则。
难点分析切入点——陌生的实验事实为切入点,考查思维整体性与逻辑性,以及新旧信息的整合能力。
3、核心内容——元素、原理与实验的综合
元素以氧化还原、酸碱反应为核心,原理以四大平衡及电化学为核心,实验以离子检验、实验装置、方案设计及简单操作为主。
模型一(2012北京27.15分)有文献记载:
在强碱性条件下,加热银氨溶液可能析出银镜。
某同学进行如下验证和对比实验。
装置
实验序号
试管中的药品
现象
实验Ⅰ
2mL银氨溶液和数滴较浓NaOH溶液
有气泡产生;
一段时间后,溶液逐渐变黑;
试管壁附着有银镜
实验Ⅱ
2mL银氨溶液和数滴浓氨水
一段时间后,溶液无明显变化
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料:
a.
+2H2O
Ag++2NH3·
H2O b.AgOH不稳定,极易分解为黑色Ag2O
⑴配制银氨溶液所需的药品是。
⑵经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。
①用湿润的红色石蕊试纸检验NH3,产生的现象是。
②产生Ag2O的原因是。
⑶该同学对产生银镜的原因提出假设:
可能是NaOH还原Ag2O。
实验及现象:
向AgNO3溶液中加入,出现黑色沉淀;
水浴加热,未出现银镜。
⑷重新假设:
在NaOH存在下,可能是NH3还原Ag2O。
用下图所示装置进行实验。
现象:
出现银镜。
在虚线框内画出用生石灰和浓氨水制取NH3的装置简图(夹持仪器略)。
⑸该同学认为在(4)的实验中会有Ag(NH3)2OH生成。
由此又提出假设:
在NaOH存在下,可能是Ag(NH3)2OH也参与了NH3还原Ag2O的反应。
进行如下实验:
①有部分Ag2O溶解在氨水中,该反应的化学方程式是。
②实验结果证实假设成立,依据的现象是。
⑹用HNO3清洗试管壁上的Ag,该反应的化学方程式是。
【例1】(2013房山27.15分)资料显示:
在煤中加入适量石灰石粉可使煤(含S)燃烧时产生的SO2转化成固体CaSO4,从而减少SO2排放,该方法被称为钙基固硫。
这一过程是通过以下两步反应实现的:
㈠CaCO3CaO+CO2㈡2CaO+2SO2+O2=2CaSO4
对此,某实验小组利用下列实验装置和药品对其可行性进行了模拟探究。
已知实验所用样品:
Ⅰ---S粉与CaCO3粉末的混合物
Ⅱ---CaSO4粉末
(1)实验一:
①取样品Ⅰ装入A中。
连续通入过量O2,加热至500℃左右,充分反应发现,B中红色消失、C中出现大量白色浑浊。
停止该步实验的正确操作是。
②取反应后D中溶液滴加过量盐酸,无明显现象。
由此得知实验一过程中:
A中发生反应的化学方程式是;
C中反应的离子方程式是。
③要获得与以上实验事实相一致的结论,可替代B中品红溶液的是。
a.酚酞的NH3·
H2O溶液b.酸性KMnO4溶液
c.酚酞的NaHCO3溶液d.Br2的CCl4溶液
(2)实验二:
连续通入过量O2,并迅速加热升温,控制在1000℃左右,充分反应。
发现B中红色消失,C中出现白色浑浊。
②取反应后D中溶液滴加过量盐酸,出现大量无色气泡,反应的离子方程式是。
③反应结束后,将A中余下固体溶入水中,取其上层清液,滴加BaCl2溶液,立即有白色沉淀出现。
由此得知实验二:
A中发生的反应有(填选“㈠”、“㈡”)。
(3)实验三:
取样品Ⅱ装入A中。
连续通入过量O2,加热至1200℃左右,充分反应,B中红色消失,则A中发生反应的化学方程式是。
比较实验一、二、三可知,如用该方法固硫,可行的基本条件是。
(4)在中学化学实验室里,装置A通常只能选为材料制作的玻璃管,但这种选择有一点不妥,其理由用化学方程式解释是:
。
(5)实验所需O2若改由空气提供,且对上述实验探究事实不产生影响,应在A前添加一装有某药品的装置。
请将该药品和装置图示在图中的虚线框内。
【例2】(2013海淀二模27.14分)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;
存在于多种生产过程以及自然界中。
在人体的很多生理过程中也起着重要作用。
资料:
①H2S可溶于水(约1:
2),其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。
A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为_________________。
②B中的现象是_________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。
则C中发生反应的离子方程式为。
④D中盛放的试剂可以是____________(填标号)。
a.水b.盐酸c.NaCl溶液d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验。
实验操作
实验现象
实验1
将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合
无明显现象
实验2
将H2S通入Na2SO3溶液中
未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀
实验3
将SO2通入Na2S溶液中
有浅黄色沉淀产生
已知:
电离平衡常数:
H2SKa1=1.3×
10-7;
Ka2=7.1×
10-15
H2SO3Ka1=1.7×
10-2;
Ka2=5.6×
10-8
①根据上述实验,可以得出结论:
在_________条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______(填序号)。
A
B
C
D
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。
现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_______。
【例3】(2013东城二模27.14分)
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。
实验操作和现象:
打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;
一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是。
(2)饱和食盐水的作用是。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:
在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)∆H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)∆H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议:
。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。
他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是。
例题1
(1)①撤掉喷灯,继续通入O2至A冷却(1分)②S+O2
SO2(1分)
2SO2+2H2O+O2+2Ba2+=2BaSO4↓+4H+(2分)
③a、b(2分)
(2)②CO32-+2H+=CO2↑+H2O(1分)③
(一)、
(二)(1分)
(3)2CaSO4
2CaO+2SO2↑+O2↑-(2分)燃烧温度需1000℃左右(1分)
(4)石英,SiO2+CaO
CaSiO3(2分)(5)图略(装置+药品)(2分)
例题2
(1)①H2S+CuSO4=CuS↓+H2SO4②蓝色石蕊试纸变红③H2S+2Fe3+=S↓+2H++2Fe2+④d
(2)①酸性(或酸性较强)②C
(3)将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应(或做爆鸣实验,其它合理答案酌情给分)
例题3
(1)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(2)除去氯气中的氯化氢
(3)
(4)将盛NaOH溶液的洗气瓶浸在冰水中
(5)①bd
②向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;
若溶液变红说明酚酞没有被氧化。
模型二(2011北京27、15分)甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
操作
关闭弹簧夹,滴加一定量浓硫酸,加热
A中有白雾生成,铜片表面产生气泡
B中有气泡冒出,产生大量白色沉淀
C中产生白色沉淀,液面上方略显浅棕色并逐渐消失
打开弹簧夹,通入N2,停止加热,一段时间后关闭
从B、C中分别取少量白色沉淀,加稀盐酸
均未发现白色沉淀溶解
⑴A中反应的化学方程式是。
⑵C中白色沉淀是,该沉淀的生成表明SO2具有性。
⑶C中液面上方生成浅棕色气体的化学方程式是。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是;
乙在A、B间增加洗气瓶D,D中盛放的试剂是。
甲
大量白色沉淀
乙
少量白色沉淀
②进行实验,B中现象:
检验白色沉淀,发现均不溶于稀盐酸。
结合离子方程式解释实验现象异同的原因:
⑸合并⑷中两同学的方案进行实验。
B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
Cu+2H2SO4
CuSO4+SO2↑+2H2O⑵H2SO4还原⑶2NO+O2
2NO2
⑷①通N2一段时间,排除装置中的空气饱和NaHSO3溶液
②甲:
SO42-+Ba2+
BaSO4↓,乙:
2Ba2++2SO2+O2+2H2O
2BaSO4↓+4H+
白雾的量远多于装置中O2的量⑸SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
【例4】2013朝阳一模27.(16分)实验室制乙烯时,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。
(气密性已检验,部分夹持装置略)。
实验操作和现象:
操作
现象
点燃酒精灯,
加热至170℃
Ⅰ:
A中烧瓶内液体渐渐变黑
Ⅱ:
B内气泡连续冒出,溶液逐渐褪色
……
实验完毕,
清洗烧瓶
Ⅲ:
A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出
(1)烧瓶内产生乙烯的化学方程式是。
(2)溶液“渐渐变黑”,说明浓硫酸具有性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
①根据甲的观点,使B中溶液褪色反应的化学方程式是。
②乙根据现象Ⅲ认为产生了SO2,在B中与SO2反应使溶液褪色的物质是。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
设计
在A、B间增加一个装有某种试剂的洗气瓶
Br2的CCl4溶液褪色
与A连接的装置如下:
D中溶液由红棕色变为浅红棕色时,E中溶液褪色
a.根据甲的设计,洗气瓶中盛放的试剂是。
b.根据乙的设计,C中盛放的试剂是。
c.能说明确实是SO2使E中溶液褪色的实验是。
d.乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是__。
(4)上述实验得到的结论是。
【例5】27.(13分)某化学小组同学用下列装置(气密性已检验)进行实验。
ⅠⅡⅢⅣ
(1)探究O2与KI溶液发生反应的条件。
甲、乙两同学选用以下试剂进行实验(0.1mol·
L-1KI溶液,30%H2O2溶液、0.1mol·
L-1H2SO4溶液、淀粉溶液、MnO2固体、KMnO4固体),实验记录如下。
向Ⅰ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液。
连接Ⅰ、Ⅳ,打开活塞
Ⅰ中剧烈反应,产生无色气体并伴随大量白雾;
Ⅳ中有气泡冒出,溶液迅速变蓝
向Ⅱ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液和稀硫酸。
连接Ⅱ、Ⅳ,点燃酒精灯
Ⅳ中有气泡冒出,溶液变蓝
甲制取O2的化学方程式是。
乙实验中O2与KI溶液反应的离子方程式是。
甲用Ⅱ加入试剂替换Ⅰ后,Ⅳ中仍加入KI、淀粉溶液,再次实验时Ⅳ中溶液不变蓝。
由此他猜测第一次实验时可能是Ⅰ中的白雾使溶液变蓝。
甲又将Ⅰ中产生的气体直接通入下列溶液(填序号),证明了白雾中含有H2O2。
a.酸性KMnO4b.FeCl2c.Na2S
③由甲、乙两同学的实验,可得出结论:
(2)资料显示:
KI溶液在空气中被缓慢氧化时CO2参与了反应。
丙、丁两同学为探究该反应中CO2的作用,进行下列实验。
丙
向Ⅰ中加入Na2CO3和稀硫酸,Ⅳ中加入KI、淀粉溶液并在上层覆盖少量煤油。
使Ⅰ中发生反应将装置中空气排尽后,再将气体通入Ⅳ的溶液中
Ⅳ中有气泡冒出,溶液不变蓝
丁
向Ⅰ中加入Na2CO3和稀硫酸,Ⅲ中加入必要试剂,Ⅳ中加入KI、淀粉溶液。
依次连接Ⅰ、Ⅲ、Ⅳ,打开活塞
丙实验的目的是。
丁实验的Ⅲ中加入试剂的化学式是。
③为证明CO2所起的作用,可进行的操作是:
取上述丁实验后Ⅳ中溶液,。
例题4
(1)
(2分)
(2)脱水性(1分)
(3)①CH2=CH2+Br2→CH2Br—CH2Br(2分)
②H2O、Br2(2分)(典型细节)
③aNaOH溶液(2分)b浓硫酸(2分)
c加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2(2分
dSO2+2H2O+Br2==4H++2Br-+SO42-、SO42-+Ba2+==BaSO4↓(2分)
或SO2+2H2O+Br2+Ba2+==4H++2Br-+BaSO4↓
(4)乙烯能使Br2的四氯化碳溶液褪色,干燥的SO2不能使Br2的四氯化碳溶液褪色(1分),浓硫酸可以吸收乙烯。
例题5
(1)①2H2O2
2H2O+O2↑O2+4I-+4H+=2I2+2H2O
2a③KI溶液在酸性条件下易被O2氧化(思维定势)
(2)①证明CO2不能氧化I-②Na2O2③滴入CaCl2(或BaCl2)溶液