届高考复习化学物质制备实验设计大题精做解析版Word格式.docx
《届高考复习化学物质制备实验设计大题精做解析版Word格式.docx》由会员分享,可在线阅读,更多相关《届高考复习化学物质制备实验设计大题精做解析版Word格式.docx(16页珍藏版)》请在冰豆网上搜索。
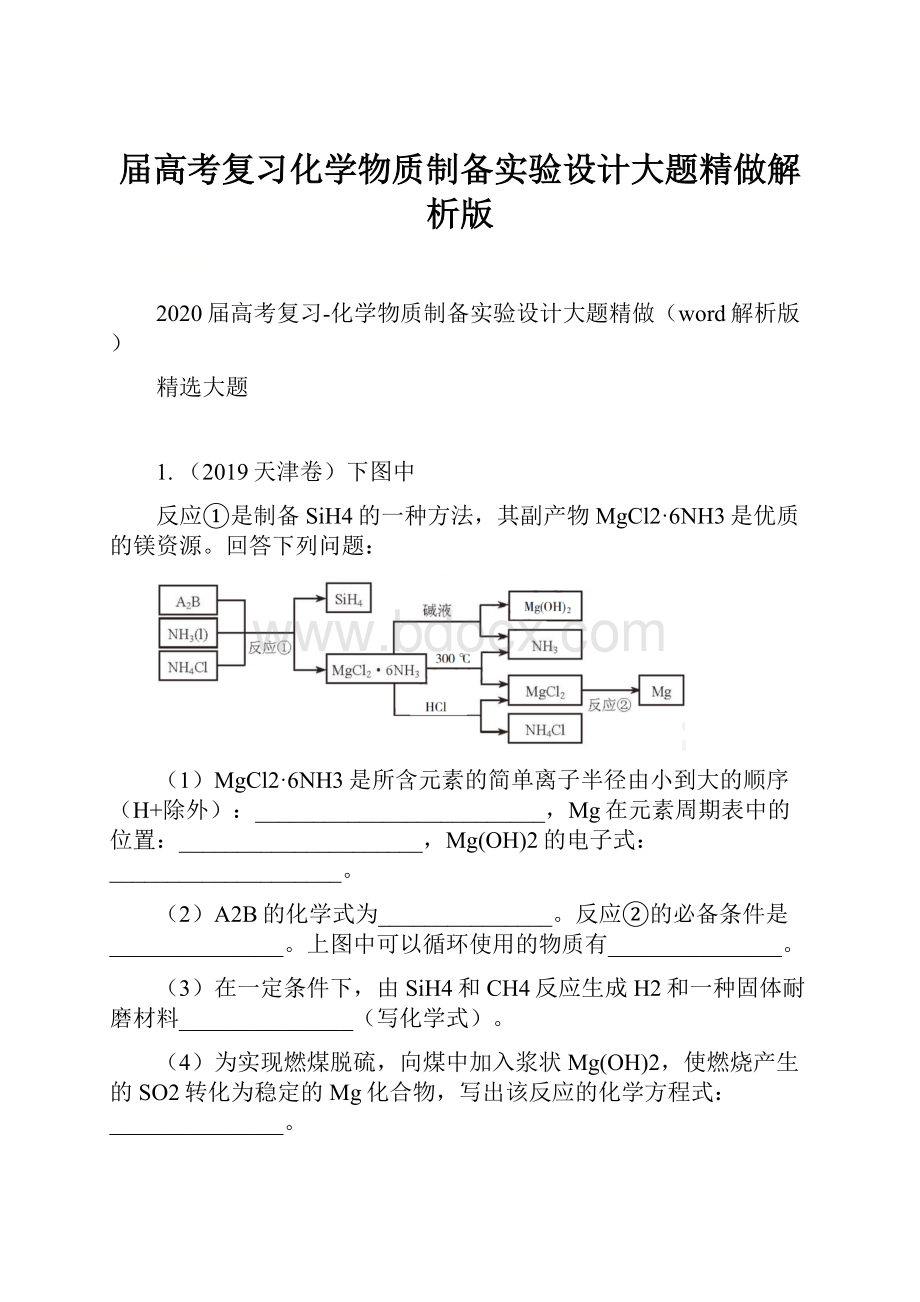
熔融、电解。
反应①需要的是Mg2Si、NH3和NH4Cl,而后续过程又得到了NH3和NH4Cl,所以可以循环的是NH3和NH4Cl。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料,该耐磨材料一定有Si和C,考虑到课本中介绍了碳化硅的高硬度,所以该物质为SiC。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,二氧化硫是酸性氧化物与氢氧化镁这样的碱应该反应得到盐(亚硫酸镁),考虑到题目要求写出得到稳定化合物的方程式,所以产物应该为硫酸镁(亚硫酸镁被空气中的氧气氧化得到),所以反应为:
2Mg(OH)2+2SO2+O2===2MgSO4+2H2O。
(5)利用格氏试剂可以制备
,现在要求制备
,所以可以选择R为CH3CH2,R’为CH3;
或者选择R为CH3,R’为CH3CH2,所以对应的醛R’CHO可以是CH3CH2CHO或CH3CHO。
【答案】
(1)r(H+)<
r(Cl–)第三周期ⅡA族
(2)Mg2Si熔融,电解NH3,NH4Cl
(3)SiC
(4)2Mg(OH)2+2SO2+O2===2MgSO4+2H2O
(5)CH3CH2CHO,CH3CHO
模拟精做
1.(2019四川蓉城联考)半导体工业需要高纯硅,粗硅中含有SiO2、Fe2O3、CuO、C等杂质,提纯硅的方法比较多,其中三氯氢硅(有一定毒性)氢还原法和四氯化硅氢还原法应用较为广泛,下面是实验室模拟工业上三氯氢硅氢还原法的基本原理:
已知:
①Si+3HCl
SiHCl3+H2(主要反应)
Si+4HCl
SiCl4+2H2(次要反应)
2NaCl+H2SO4(浓)
Na2SO4+2HCl↑
②典型硅的重要化合物的部分性质如下表:
熔点(℃)
沸点(℃)
溶解性
SiHCl3
-127
33
易溶于多数有机溶剂
SiCl4
-23
77
(1)粗硅在提纯前,需要进行酸、碱预处理,其目的是_________________________________。
(2)下列装置在实验室可用于制备HCl气体的是_____(填字母代号)。
(3)在1100~1200℃条件下,利用图B在石英管中可以获得硅,写出该反应的方程式_______;
其烧杯中水的作用是__________________________;
该装置使用石英管而不是普通玻璃管的原因是_________。
(4)三氯氢硅氢还原法用SiHCl3在图B中制硅,不足之处有_______________(任意回答一点即可)。
(5)SiCl4与氢气反应也能得到硅,但反应所需温度不同,在工业上往往将三氯氢硅中混入的SiCl4分离后再与氢气反应,你认为最好的分离方法是______________。
(6)工业上如果用四氯化硅氢还原法制硅,其原理如下:
该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
(1)根据题干得粗硅中含有杂质,Fe2O3、CuO能与酸反应,SiO2能与碱反应,故答案为:
除去粗硅中SiO2、Fe2O3、CuO等杂质;
(2)由题干得,实验室中制备HCl气体是用固体NaCl和液体(浓硫酸)加热的反应,可选用装置b,实验室制备HCl也可采用向浓盐酸中滴加浓硫酸,则选用装置a,故可选用的装置为:
a、b;
(3)由图示得反应的方程式为:
SiHCl3+H2
Si+3HCl;
其烧杯中水的作用是:
加热SiHCl3,以便使之变成蒸汽进入石英管;
该装置使用石英管而不是普通玻璃管的原因是:
反应温度较高,普通玻璃不能承受该高温;
(4)由题干信息知三氯氢硅有毒,该装置不足之处在于:
没有进行尾气处理;
(5)根据题干信息三氯氢硅和SiCl4沸点相差较大,最好的分离方法是蒸馏;
(6)由上述分析及题干信息知该方案的不足之处在于:
使用了有毒气体;
三氯氢硅氢还原法中HCl和H2可以直接循环利用,节约了成本,而四氯化硅氢还原法中没有可循环利用的原料。
(1)除去粗硅中SiO2、Fe2O3、CuO等杂质
(2)a、bSiHCl3+H2
Si+3HCl
(3)加热SiHCl3,以便使之变成蒸汽进入石英管反应温度较高,普通玻璃不能承受该高温
(4)没有进行尾气处理
(5)蒸馏
(6)使用了有毒气体;
三氯氢硅氢还原法中HCl和H2可以直接循环利用,节约了成本,而四氯化硅氢还原法中没有可循环利用的原料
2.(2019河南联考)氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。
一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.已知:
氯化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:
______________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是______________________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:
(NH4)2S2O8+2NaOH
Na2S2O8+2NH3↑十2H2O
副反应:
2NH3+3Na2S2O8+6NaOH
6Na2SO4+6H2O+N2
某化学兴趣小组利用上述原理在实验室制备过硫酸钠并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
(实验一)实验室通过如图所示装置制备Na2S2O8。
(3)装置b的作用是______________________。
(4)装置a中反应产生的气体需要持续通人装置c的原因是______________________。
(5)上述装置中还需补充的实验仪器或装置有___________(填字母)。
A温度计B洗气瓶C.水浴装置D.酒精灯
(实验二)测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
①废水中氰化钠的最高排放标准为0.50mg·
L−1。
②Ag++2CN−===[Ag(CN)2]−,Ag++I−===AgI↓,AgI呈黄色,且CN−优先与Ag+反应。
实验如下:
取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂用1.00×
10−4mol·
L−1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(6)滴定终点的现象是____________________________________________。
(7)处理后的废水中氰化钠的浓度为___________mg·
L−1;
处理后的废水是否达到排放标准?
___________(填“是”或“否”)。
(1)取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸,非金属性越强,该元素的最高价氧化物的水化物的酸性越强,则非金属性:
N>
C;
故答案为:
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,即反应生成了HCO
和NH3,离子方程式为:
CN−+H2O2+H2O===HCO
+NH3↑;
(3)由于氨气极易溶于水,使体系内压强快速减小,易发生倒吸,所以b装置是安全瓶,防止倒吸;
作安全瓶,防止倒吸;
(4)装置a中反应产生的O2,将三颈烧瓶中产生的NH3及时排出,减少副反应的发生;
将三颈烧瓶中产生的NH3及时排出,减少副反应的发生;
(5)根据题目信息提示可知,制备反应需要在55℃的条件下进行,所以需要控制温度不能超过90℃,需要水浴加热、温度计和酒精灯;
ACD;
(6)用硝酸银溶液滴定的过程中,当滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失时,说明已经滴定到终点;
滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失;
根据化学计量关系可知,Ag+——2CN−,n(AgNO3)=1.00×
10-4mol·
L-1×
0.0015mL=1.5×
10−7mol,即n(NaCN)=2n(AgNO3)=
1.5×
10−7mol×
2=3.0×
10−7mol,m(NaCN)=3.0×
49g/mol=1.47×
10−5g,氰化钠的浓度为:
=0.147g/L;
0.147g/L<0.50mg/L,所以已达到排放标准。
0.147,是。
(1)取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸,非金属性N>
C
(2)CN−+H2O2+H2O===HCO
+NH3↑
(3)作安全瓶,防止倒吸
(4)将三颈烧瓶中产生的NH3及时排出,减少副反应的发生
(5)ACD
(6)滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失
(7)0.147是
3.(2019安徽阜阳三中二模)醋酸亚铬水合物[Cr(CH3COO)2]2·
2H2O(相对分子质量为376)是一种氧气吸收剂,为红棕色晶体,潮湿时易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。
其制备装置及步骤如下:
①待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
②将装置乙中混合物快速过滤、洗涤和干燥,称量得到[Cr(CH3COO)2]2·
2H2O。
③检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
④关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
(1)正确的实验步骤为:
_________________。
(2)装置甲中连通管a的作用是_______________________________________。
(3)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为______________________
________________________。
(4)实现步骤①中溶液自动转移至装置乙中的实验操作为_______________________。
(5)步骤④目的是___________________________________________。
(6)洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是_________________。
(7)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,实验后得干燥纯净的[Cr(CH3COO)2]2·
2H2O9.48g,则该实验所得产品的产率为____(不考虑溶解的醋酸亚铬水合物)(用百分数表示,保留3位有效数字)。
(1)装置甲:
分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl===ZnCl2+H2↑,同时发生2CrCl3+Zn===2CrCl2+ZnCl2,生成氢气,用来增大压强把生成的CrCl2溶液压入装置乙中;
装置乙:
2Cr2++4CH3COO−+2H2O===[Cr(CH3COO)2]2·
2H2O↓,装置丙是保持装置压强平衡,同时避免空气进入,故正确的实验步骤为:
③④①②;
(2)装置甲中连通管a的作用是平衡气压,使分液漏斗中的盐酸顺利流下;
(3)装置甲:
分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl===ZnCl2+H2↑,同时发生2CrCl3+Zn===2CrCl2+ZnCl2,该反应的离子反应为:
2Cr3++Zn===2Cr2++Zn2+;
(4)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置乙中反应,故答案为:
关闭k1,打开k2;
(5)步骤④目的是让Zn与盐酸反应生成的H2排尽装置内的空气,防止产品被氧化;
(6)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,所以可以选用冷水、无水乙醇和乙醚洗涤[Cr(CH3COO)2]2·
2H2O产品,洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是为了去除可溶性杂质和水分;
(7)CrCl3为
=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则理论上可以得到[Cr(CH3COO)2]2·
2H2O的质量为0.06mol×
0.5
×
376g/mol=11.28g,所得产品的产率为
100%=84.0%。
(1)③④①②
(2)平衡气压,使分液漏斗中的盐酸顺利流下
(3)2Cr3++Zn===2Cr2++Zn2+
(4)关闭K1,打开K2
(5)让Zn与盐酸反应生成的H2排尽装置内的空气,防止产品被氧化
(6)为了去除可溶性杂质和水分
(7)84.0%
4.(2019江苏卷)以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·
H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
①Cl2+2OH−===ClO−+Cl−+H2O是放热反应。
②N2H4·
H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;
实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·
H2O的装置如图−1所示。
NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。
实验中通过滴液漏斗滴加的溶液是_____________;
使用冷凝管的目的是_________________________________。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、HSO
、SO
随pH的分布如图−2所示,Na2SO3的溶解度曲线如图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。
实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:
_______________________,用少量无水乙醇洗涤,干燥,密封包装。
【解析】步骤I中Cl2与NaOH溶液反应制备NaClO;
步骤II中的反应为NaClO碱性溶液与尿素水溶液反应制备水合肼,;
步骤III分离出水合肼溶液;
步骤IV由SO2与Na2CO3反应制备Na2SO3。
(1)温度超过40℃,Cl2与NaOH溶液发生歧化反应生成NaClO3、NaCl和H2O,反应的化学方程式为3Cl2+6NaOH
5NaCl+NaClO3+3H2O,离子方程式为3Cl2+6OH−
5Cl−+ClO
+3H2O。
由于Cl2与NaOH溶液的反应为放热反应,为了减少NaClO3的生成,应控制温度不超过40℃、减慢反应速率;
实验中控制温度除用冰水浴外,还需采取的措施是:
缓慢通入Cl2。
(2)步骤II中的反应为NaClO碱性溶液与尿素水溶液反应制备水合肼,由于水合肼具有强还原性、能与NaClO剧烈反应生成N2,为了防止水合肼被氧化,应逐滴滴加NaClO碱性溶液,所以通过滴液漏斗滴加的溶液是NaClO碱性溶液。
NaClO碱性溶液与尿素水溶液在110℃继续反应,N2H4·
H2O沸点约118℃,使用冷凝管的目的:
减少水合肼的挥发。
(3)①向Na2CO3溶液中通入SO2制备NaHSO3溶液,根据图示溶液pH约为4时,HSO
的摩尔分数最大,则溶液的pH约为4时停止通入SO2;
实验中确定何时停止通入SO2的实验操作为:
测量溶液的pH,若pH约为4,停止通SO2。
②由NaHSO3溶液制备无水Na2SO3,首先要加入NaOH将NaHSO3转化为Na2SO3,根据含硫微粒与pH的关系,加入NaOH应调节溶液的pH约为10;
根据Na2SO3的溶解度曲线,温度高于34℃析出Na2SO3,低于34℃析出Na2SO3·
7H2O,所以从Na2SO3溶液中获得无水Na2SO3应控制温度高于34℃。
由NaHSO3溶液制备无水Na2SO3的实验方案为:
边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。
(1)3Cl2+6OH−
+3H2O缓慢通入Cl2
(2)NaClO碱性溶液减少水合肼的挥发
(3)①测量溶液的pH,若pH约为4,停止通SO2
②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤
5.(2019四川华大新高考联盟质量检测)富马酸亚铁(C4H2O4Fe)常用于治疗缺铁性贫血,也可作食品营养强化剂,它可由糠醛(
)和硫酸亚铁制备。
已知
回答下列问题
I.制备富马酸(实验装置如图所示,夹持装置已略去)
(1)将45.0g氯酸钠、0.2g五氧化二钒置于三颈烧瓶中,加入适量水,滴加糠醛并加热至90~100℃,维持此温度3~4h。
实验中冷凝管的作用是_________,冷却液宜从_______
____(填a”或“b”)处进入。
(2)冰水冷却使其结晶,并通过___________操作可以得到富马酸粗品。
(3)再用1mol·
L-1HCl溶液重结晶,得到纯富马酸。
该操作中用1mol·
L-1HCl溶液的原因是_____________。
Ⅱ.合成富马酸亚铁
(4)取富马酸溶于适量水中,加入碳酸钠并加热、搅拌,调节pH6.5~6.7,产生大量气泡。
写出该反应的化学方程式:
___________。
(5)将硫酸亚铁溶液和适量的Na2SO3溶液缓慢加入上述反应液中,维持温度100℃并充分搅拌3~4h。
①该操作过程中加入适量的Na2SO3溶液,其目的是___________。
②写出生成富马酸亚铁的离子方程式:
_____________。
(6)过滤、干燥得到产品。
过滤时滤纸要紧贴漏斗内壁,原因是________。
Ⅲ.产品纯度测定
(7)取0.300g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL煮沸过的冷水和2滴邻二氮菲指示液,此时溶液呈红色;
立即用0.1000mol·
L−1硫酸铈(Ⅳ)铵[(NH4)2Ce(SO4)3]标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。
平行测定三次,平均消耗17.30mL标准液,则样品的纯度为___________。
(1)冷凝管的作用是冷凝,防止有机物挥发造成反应物转化率降低。
冷凝管中冷却液的流向一般都是“下进上出”,即从a处进入。
因此,本题正确答案为:
冷凝回流,提高糠醛的转化率及减少富马酸的挥发;
a;
(2)从溶液中提取溶质需经过结晶、过滤、干燥等操作,故结晶后需过滤。
过滤;
(3)富马酸是弱电解质,微溶于冷水,加入盐酸后可抑制富马酸的电离,降低在水中的溶解。
加盐酸,使HOOC-CH=CH-COOH
(OOC-CH=CH-COO)2-+2H+平衡逆向移动,促使富马酸晶体析出,提高产量。
(4)取富马酸溶于适量水中,加入碳酸钠并加热、搅拌,调节pH6.5~6.7,产生大量气泡,说明富马酸和碳酸钠反应生成富马酸的钠盐和水及二氧化碳气体,反应的化学方程式为HOOC-CH=CH-COOH+Na2CO3
NaOOC-CH=CH-COONa+H2O+CO2↑。
HOOC-CH=CH-COOH+Na2CO3
(5)①Fe3+可以被SO
还原为Fe2+,所以加入适量的Na2SO3溶液是为了防止富马酸亚铁(或Fe2+或富马酸根离子)被氧化。
防止富马酸亚铁(或Fe2+或富马酸根离子)被氧化;
②根据信息可以得出富马酸亚铁为沉淀,所以反应方程式为NaOOC-CH=CH-COONa+FeSO4→Fe(OOC-CH=CH-COO)↓+Na2SO4,离子方程式为(OOC-CH=CH-COO)2−+Fe2+→Fe(OOC-CH=CH-COO)↓。
(OOC-CH=CH-COO)2−+Fe2+→Fe(OOC-CH=CH-COO)↓。
(6)过滤时滤纸若未紧贴漏斗内壁,会留有气泡,导致滤纸破损,使过滤速率较慢。
防止滤纸与漏斗壁之间留有气泡,影响过滤速率(或防止滤纸破损,影响过滤效果)。
(7)由反应关系可:
n(C4H2O4Fe)=n(Fe2+)=n(Ce4+)=0.1000mol/L×
17.30×
10−3L=1.730×
10−3mol,则样品的纯度:
w(C4H2O4Fe)=
100%≈
98.03%。
(1)冷凝回流,提高糠醛的转化率及减少富马酸的挥发a
(2)过滤
(3)加盐酸,使HOOC-CH=CH-COOH
(OOC-CH=CH-COO)2−+2H+平衡逆向移动,促使富马酸晶体析出,提高产量
(4)HOOC-CH=CH-COOH+Na2CO3
NaOOC-CH=CH-COONa+H2O+CO2↑
(5)防止富马酸亚铁(或Fe2+或富马酸根离子)被氧化