高考化学钠及其化合物大题培优 易错 难题及详细答案Word下载.docx
《高考化学钠及其化合物大题培优 易错 难题及详细答案Word下载.docx》由会员分享,可在线阅读,更多相关《高考化学钠及其化合物大题培优 易错 难题及详细答案Word下载.docx(39页珍藏版)》请在冰豆网上搜索。
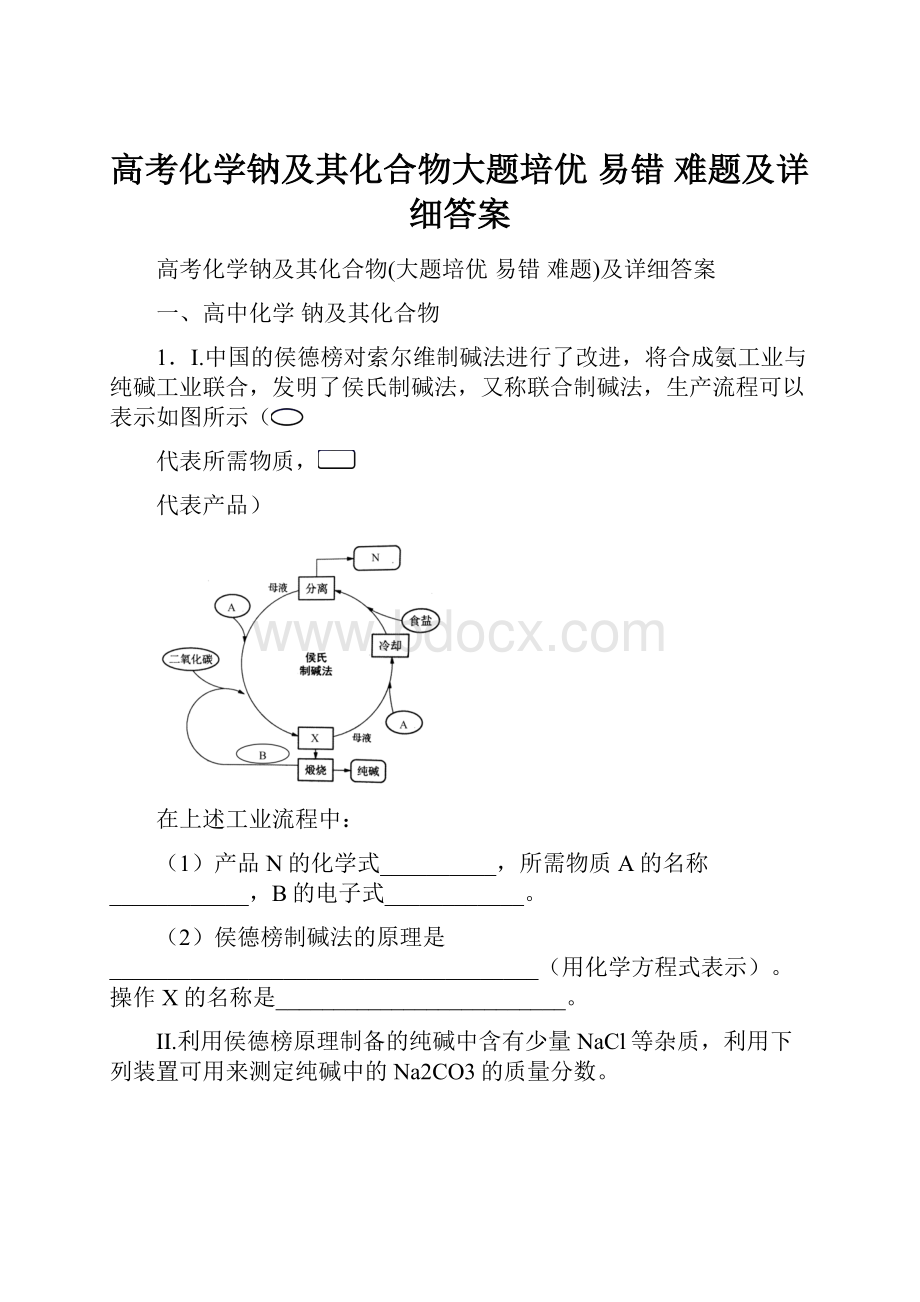
【分析】
联合制碱法:
以食盐、氨和二氧化碳为原料来制取纯碱,二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,A为NH3,B为CO2,反应为:
CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,经过滤、洗涤得NaHCO3微小晶体,再加热制得纯碱产品。
【详解】
(1)产品N是氯化铵,化学式为NH4Cl,所需物质A的名称是氨气,CO2的电子式:
;
(2)侯德榜制碱法的原理是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
操作X后得滤液和固体,则操作为过滤;
(3)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是确保CO2充分被吸收;
为防止空气中的CO2造成实验误差,装置A中的液体应选用氢氧化钠溶液;
(4)装置B与D之间必须添加一装置C,吸收水分,否则使测定结果偏高;
装置C为:
,装置中盛放的是浓硫酸;
(5)根据此实验,干燥管D增加二氧化碳质量
g,通过差量法可知,纯碱中Na2CO3的质量分数为
,如果缺少装置E,外界的二氧化碳、水蒸气会被干燥管D吸收,则实验所得纯碱样品的纯度会偏高。
2.1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。
有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式_______
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是_______。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:
将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
请回答:
①写出甲中发生反应的离子方程式_______。
②乙装置中的试剂是_______。
③实验结束后,分离出NaHCO3晶体的操作是_______(填分离操作的名称)。
第二位同学:
用如图装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入_______气体,再从b管中通入_______气体。
②装置c中的试剂为_______(选填字母)。
e.碱石灰f..浓硫酸g.无水氯化钙
【答案】N2+3H2
2NH3cCaCO3+2H+=Ca2++H2O+CO2↑饱和碳酸氢钠溶液过滤NH3(氨)CO2(二氧化碳)g
(1)工业合成氨反应,利用N2、H2在高温、高压、催化剂作用下制NH3;
(2)a.碳酸氢钠易溶于水;
b.碳酸氢钠固态时受热易分解,在水溶液中受热不分解;
c.碳酸氢钠的溶解度相对较小,易结晶析出,促使平衡向生成物方向移动;
(3)第一位同学:
将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠;
甲装置中,CaCO3与盐酸反应制CO2气体,但CO2中混有HCl;
乙中加入饱和NaHCO3溶液,以除去CO2中的HCl;
在丙装置中,CO2通入含氨的饱和食盐水中,生成NaHCO3和NH4Cl;
丁装置用于吸收随未反应CO2逸出的NH3;
用如图装置进行实验(其它装置未画出);
由于CO2在水中的溶解度不大,所以应先通NH3,后通CO2,最后还需吸收未反应的NH3。
(1)工业合成氨反应,利用N2、H2在高温、高压、催化剂作用下制NH3,反应方程式N2+3H2
2NH3;
答案为:
N2+3H2
(2)a.碳酸氢钠易溶于水,a不合题意;
b.碳酸氢钠固态时受热易分解,对侯德榜制碱反应不产生影响,b不合题意;
c.碳酸氢钠的溶解度相对较小,易结晶析出,促使平衡向生成物方向移动,从而使NaHCO3结晶析出,c符合题意;
故选c;
(3)第一位同学:
①甲中CaCO3与盐酸反应制CO2气体,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑;
CaCO3+2H+=Ca2++H2O+CO2↑;
②乙装置的作用是除去CO2中的HCl,所以加入饱和NaHCO3溶液;
饱和碳酸氢钠溶液;
③实验结束后,分离出NaHCO3结晶析出,则分离此固体与液体的操作是过滤;
过滤;
①由于CO2在水中的溶解度不大,所以应先通NH3,后通CO2,即从a管通入NH3(氨)气体,再从b管中通入CO2(二氧化碳)气体;
NH3(氨);
CO2(二氧化碳);
②e.碱石灰(氢氧化钠与氧化钙的混合物)不能吸收NH3,e不合题意;
f..浓硫酸呈液态,不能放在干燥管内,f不合题意;
g.无水氯化钙呈固态,能够放在干燥管内,且能吸收NH3,g符合题意;
故选g。
【点睛】
常温常压下,1体积水约能溶解1体积的二氧化碳气体,二氧化碳是酸性气体,若将其通入碱性溶液中,则由于能与碱发生反应,使其在溶液中的溶解度增大数倍,从而增大了产品的质量,提高了生产效率。
3.
(1)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再产生CO2气体为止,在此过程中,溶液中的碳酸氢根离子浓度的变化是___。
A.先变大后变小B.先变小后变大C.一直变小D.保持不变
(2)有含0.2molNa2CO3和含0.3molHCl的两种溶液中:
①将Na2CO3溶液逐滴加入HCl溶液中;
②将HCl溶液逐滴加入Na2CO3溶液中。
①②两种操作生成的CO2之比为___。
(3)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。
请通过计算和推理完成下列各小题:
①取A与足量的盐酸反应:
若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值,则A的组成可能有___种。
若固体混合物A的质量m(A)为定值,生成气体的量为定值,则A的可能组成是(填写化学式):
___、___;
___、___。
(可以不填满)
②若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0g,则混合固体A的总物质的量是___mol。
【答案】A3:
26NaHCO3MgCO3KHCO3CaCO30.2
(1)向碳酸钠的浓溶液中逐滴加入稀盐酸,先发生反应:
CO32-+H+=HCO3-,然后发生反应:
HCO3-+H+=H2O+CO2↑。
(2)将Na2CO3溶液逐滴加入HCl溶液中,发生的反应为:
CO32-+2H+=H2O+CO2↑;
将HCl溶液逐滴加入Na2CO3溶液中,则先发生反应:
(3)①若等物质的量的盐生成等量的气体,则符合A与足量的盐酸反应,若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值;
若等质量的盐生成等量的气体,则符合A与足量的盐酸反应,若固体混合物A的质量m(A)为定值,生成气体的量为定值。
②根据原子守恒计算。
(1)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再产生CO2气体为止,在此过程中,先发生反应:
HCO3-+H+=H2O+CO2↑,所以溶液中的碳酸氢根离子浓度的变化是先变大后变小,故选A。
①将Na2CO3溶液逐滴加入HCl溶液中,发生反应CO32-+2H+=H2O+CO2↑,Na2CO3是过量的,生成的CO2的物质的量根据HCl的量计算为0.15mol;
②将HCl溶液逐滴加入Na2CO3溶液中,先发生反应:
CO32-+H+=HCO3-,0.2molCO32-消耗0.2molHCl,剩余0.1molHCl,生成0.2molHCO3-,再发生反应:
HCO3-+H+=H2O+CO2↑,剩余的0.1molH+消耗了0.1molHCO3-,生成了0.1molCO2。
所以①②两种操作生成的CO2之比为0.15:
0.1=3:
2。
(3)①若等物质的量的盐生成等量的气体,则符合A与足量的盐酸反应,若固体混合物A的物质的量n(A)为定值,生成气体的量即为定值。
四种碳酸盐物质的量相等时,生成的气体的量都相等,四种盐有6种组合;
NaHCO3和MgCO3的摩尔质量相等,当两者质量相等时,和足量盐酸反应,能生成等量的气体,KHCO3和CaCO3的摩尔质量也相等,符合要求。
故答案为6,NaHCO3和MgCO3,KHCO3和CaCO3。
②CO2通过足量的澄清石灰水生成的沉淀均为10.0g,即0.1mol,根据碳守恒,生成的CO2即为0.1mol。
先将A加热,剩余固体再与足量的盐酸反应,A中的碳元素均转化成CO2,所以A中的碳元素为0.2mol,则固体A的总物质的量是0.2mol。
4.欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可用以下四种方法。
方法一:
方法二:
方法三:
方法四:
不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一:
加入足量的试剂A是___________(填写A的化学式),可将HCO3-转化为沉淀并称重。
操作1、2、3、4的名称依次是溶解、____、洗涤和干燥(烘干);
(2)方法二:
在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要用到的是__________,应选择甲基橙作指示剂;
(3)在方法二中计算该样品中NaHCO3的质量分数为_____________;
(4)在方法三中,根据所用的实验装置,除了称量样品质量外,还需测定的实验数据是_____________________;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是_________,偏低的原因可能是__________(均文字简述);
(6)方法四的实验原理是________________(用化学方程式表示)。
【答案】Ca(OH)2或Ba(OH)2过滤100mL容量瓶0.042V/m×
100%装有碱石灰的干燥管在实验前后的质量碱石灰可能还会吸收空气中的水蒸气和CO2气体装置内会留存部分CO2气体2NaHCO3
Na2CO3+H2O+CO2↑
(图甲)固态样品加试剂A使碳酸氢跟生成沉淀,再经过过滤、洗涤、干燥称量沉淀的质量,从而根据碳守恒计算碳酸氢钠的质量,进而计算质量分数;
(图乙)固态样品加水溶解成100ml溶液,取20ml加指示剂,用标准盐酸进行滴定,从而计算出碳酸氢钠的质量分数;
(图丙)固态样品加稀硫酸充分溶解,再经过浓硫酸干燥,用碱石灰吸收生成的二氧化碳气体,根据二氧化碳的质量计算碳酸氢钠的质量,进而计算质量分数;
不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数。
(1)与HCO3-反应钠产生沉淀的试剂有Ca(OH)2或Ba(OH)2;
操作1、2、3、4的名称依次是溶解、过滤、洗涤、干燥;
(2)方法二操作1的步骤是溶解、转移、洗涤、定容、摇匀,用到的仪器有玻璃棒、烧杯、量筒、胶头滴管、100mL容量瓶,还需100mL的容量瓶;
(3)由所用盐酸的体积可计算出20mL的待测液中碳酸氢钠的物质的量,原液是待测液的5倍,所以,样品中NaHCO3的质量分数为V(HCl)×
10-3×
0.100×
5×
84/m×
100%=
(4)方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量;
(5)偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;
偏低的原因是装置中会有残留的二氧化碳未被吸收;
(6)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数,化学方程式是2NaHCO3
Na2CO3+H2O+CO2↑。
5.Ⅰ.
(1)用锌片,铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气________L(标准状况下),导线中通过________mol电子。
(2)将agNa投入到bgD2O(足量)中,反应后所得溶液的密度为dg/cm3,则该溶液物质的量浓度是_______;
Ⅱ.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g)+B(g)⇌2C(g)+2D(g)。
反应进行到10s末时,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是________。
(3)10s末,生成物D的浓度为________。
【答案】1.120.1
mol/L0.04mol•L-1•s-11.5mol•L-10.4mol•L-1
Ⅰ.
(1)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:
Zn-2e-=Zn2+,铜为正极,电极反应为2H++2e-=H2↑,锌片的质量减少了3.25克,则物质的量为
=0.05mol,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×
0.05mol=0.1mol,则V(H2)=0.05mol×
22.4L/mol=1.12L,故答案为:
1.12;
0.1;
(2)将agNa投入到bgD2O(足量)中,发生2Na+2D2O=2NaOD+D2↑,agNa的物质的量为
=
mol,生成的氢氧化钠为
mol,D2的物质的量为
mol,质量为
mol×
4g/mol=
g,反应后溶液的质量为ag+bg-
g=(a+b-
)g,溶液的体积为
cm3,则该溶液物质的量浓度c=
mol/L,故答案为:
mol/L;
Ⅱ.
(1)v(C)=
=0.04mol•L-1•s-1,故答案为:
0.04mol•L-1•s-1;
(2)3A(g)+B(g)⇌2C(g)+2D(g)。
反应进行到10s末时,测得A的物质的量为1.8mol,C的物质的量为0.8mol,则反应的A为1.2mol,反应前A的物质的量浓度是
=1.5mol•L-1,故答案为:
1.5mol•L-1;
(3)3A(g)+B(g)⇌2C(g)+2D(g)。
反应进行到10s末时,测得C的物质的量为0.8mol,则生成的D为0.8mol,10s末,生成物D的浓度为
=0.4mol•L-1,故答案为:
0.4mol•L-1
。
本题的难点为I.
(2),要注意生成的氢气的质量的计算,同时注意c=
中V的单位是“L”。
6.现有下列几种物质:
①盐酸;
②Na2O;
③Na2O2;
④Al(OH)3;
⑤Na2CO3;
⑥H2O;
⑦CO2;
⑧乙醇;
⑨Cu;
⑩NaOH溶液。
(1)其中属于电解质的有___________(填写序号,下同),属于碱性氧化物的有_______。
(2)④与⑩反应的离子方程式为______________________________________。
(3)Na2O2因能发生下列反应被用作供氧剂:
2Na2O2+2CO2=2Na2CO3+O2,该反应中,氧化剂与还原剂的物质的量之比为:
______。
(4)如用超氧化钾(KO2)作供氧剂,写出它和CO2反应的化学方程式,并标出电子转移的方向和数目______________________________________________________。
【答案】②③④⑤⑥②Al(OH)3+OH-=AlO2-+2H2O1:
1
或
(1)①盐酸为混合物,不属于电解质;
②Na2O为离子化合物,属于电解质、碱性氧化物;
③Na2O2为离子化合物,属于电解质,过氧化物;
④Al(OH)3为离子化合物,属于电解质;
⑤Na2CO3为离子化合物,属于电解质;
⑥H2O属于电解质、氧化物;
⑦CO2不属于电解质,为氧化物;
⑧乙醇属于非电解质;
⑨Cu为单质,不属于电解质;
⑩NaOH溶液为混合物,不属于电解质;
(2)NaOH与氢氧化铝反应生成偏铝酸钠和水;
(3)过氧化钠中部分氧原子化合价升高为0价,部分降低为-2价,则过氧化钠既是氧化剂,又是还原剂,且物质的量之比为1:
1;
(4)超氧化钾(KO2)中O2-平均价态为-0.5价,部分氧原子化合价升高为0价,部分降低为-2价,则升高的氧原子数目为降低氧原子数目的3倍。
综上所述,属于电解质的为②③④⑤⑥;
碱性氧化物的为②;
(2)NaOH与氢氧化铝反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(4)超氧化钾(KO2)中O2-平均价态为-0.5价,部分氧原子化合价升高为0价,部分降低为-2价,则升高的氧原子数目为降低氧原子数目的3倍,则单线桥法为
7.某港口化学品堆场发生火灾,消防队在未被告知着火可燃物类别的情况下,用水灭火时,发生了剧烈爆炸。
事后有关部门初步认定危化品部分清单:
钾、钠、氯酸钾、烧碱、氯化铵。
试回答:
⑴请你分析用水灭火时,随后发生了剧烈爆炸的原因是_____________________________。
⑵请写出氯化铵中NH4+的检验方法____________________________(简要说明操作步骤)。
⑶钠燃烧产物中可作为消防员呼吸面具供氧剂的是_________________(写化学式)。
⑷硝酸钾受热分解产生KNO2和O2,写出该反应的化学方程式______________________。
【答案】钠、钾能与水发生剧烈的放热反应,并释放出氢气。
氯酸钾受热分解产生氧气,氢气和氧气混合受热发生爆炸将氯化铵溶于水,取少量溶液于试管中,滴入浓氢氧化钠溶液并加热,在试管口上方用湿润的红色石蕊试纸检验,若发现试纸变蓝,则说明该溶液中含有NH4+Na2O22KNO3
2KNO2+O2↑
钠、钾等物质遇水会发生剧烈反应并产生氢气,而氯酸钾分解会产生氧气,氢氧混合受热后会发生爆炸,后面再根据要求来作答即可。
(1)根据分析,钠、钾与水发生剧烈反应并放出氢气,而氯酸钾受热产生氧气,氢气和氧气混合后发生剧烈的爆炸;
(2)铵离子可以通过加水溶解后,加入浓碱并加热的方法来检验,因为高中阶段只有氨气这一种碱性气体;
实验操作为:
将氯化铵溶于水,取少量溶液于试管中,滴入浓氢氧化钠溶液并加热,在试管口上方用湿润的红色石蕊试纸检验,若发现试纸变蓝,则说明该溶液中含有NH4+,
(3)过氧化钠可以作呼吸面具中的供氧剂,化学式为Na2O2;
(4)硝酸钾受热分解产生
和
的过程是一个自身氧化还原反应,氮从+5价降低到+3价,得2个电子,氧从-2价升高到0价,失2个电子,据此来写出氧化还原方程式即可:
8.碳酸钠和碳酸氢钠在一定条件下可以相互转化。
(1)向碳酸钠溶液中通入二氧化碳,可以得到碳酸氢钠,请写出该反应的化学方程式_________。
(2)请设计实验方案除去碳酸钠固体中混有的少量碳酸氫钠_________。
(3)请设计实验方案除去碳酸氢钠溶液中混有的少量碳酸钠_________。
(4)充分加热碳酸钠和碳酸氢钠的混合物95g,完全反应后得到气体5.6L(标准状况),求混合物中碳酸钠的质量分数_________。
【答案】Na2CO3+CO2+H2O=2NaHCO3加热碳酸钠固体,NaHCO3受热分解生成Na2CO3和H2O、CO2,从而除去了杂质向NaHCO3溶液中通入CO2,使Na2CO3反应生成了NaHCO3,从而除去了杂质55.8%
(1)碳酸钠溶液通入二氧化碳气体生成碳酸氢钠;
(2)碳酸钠较稳定,碳酸氢钠加热容易分解;
(