江西省五市八校届高三第二次联考化学试题docWord文档下载推荐.docx
《江西省五市八校届高三第二次联考化学试题docWord文档下载推荐.docx》由会员分享,可在线阅读,更多相关《江西省五市八校届高三第二次联考化学试题docWord文档下载推荐.docx(13页珍藏版)》请在冰豆网上搜索。
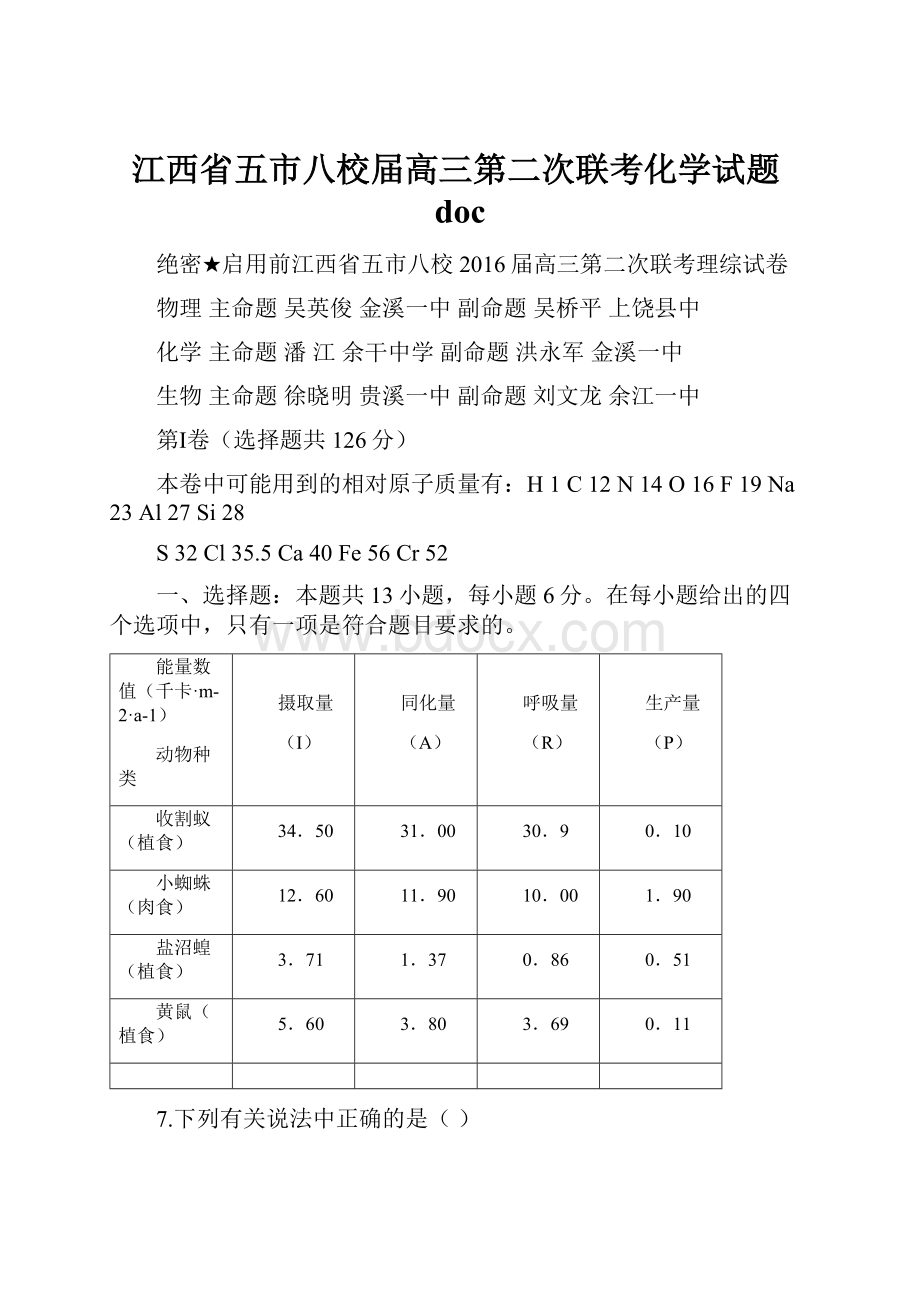
10.00
1.90
盐沼蝗(植食)
3.71
1.37
0.86
0.51
黄鼠(植食)
5.60
3.80
3.69
0.11
7.下列有关说法中正确的是()
A.近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管
D.纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一
8.常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.水电离的c(H+)=1xl0-13mol/L的溶液中:
K+、Na+、SiO32-、SO42-
B.1.0mol/L的CH3COOH溶液:
K+、Fe3+、NO3﹣、Cl﹣
C.在c(OH﹣)/c(H+)=1×
1012的溶液:
NH4+、Ca2+、C1﹣、K+
D.甲基橙显黄色的溶液:
Na+、CO32﹣、NO3﹣、SO32﹣
9.短周期主族元素X、Y、Z、W的原子序数依次增大。
X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构。
下列说法正确的是()
A.单质的沸点:
Y>
Z
B.X、Y、Z三种元素不可能形成离子化合物
C.X的最高价氧化物对应的水化物的酸性比W的强
D.Y分别与Z、W形成的化合物中化学键类型不相同
10.下列图示且与对应的叙述不相符的是()
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
B.图2表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
C.图3表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示恒温恒容条件下,2NO2(g)
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
11.下表中的实验操作能达到实验目的的是()
选项
实验操作
实验目的
A
将浓硫酸和碳单质混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊
检验气体产物中CO2的存在
B
将NaOH的乙醇溶液加入溴乙烷中,加热,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色
证明溴乙烷的消去反应有乙烯生成
C
先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀
检验溶液中是否含有SO42-
D
常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:
盐酸pH小于醋酸pH
证明相同条件下,在水中HCl电离程度大于CH3COOH
12.乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中不正确的是()
①分子式为C12H20O2②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:
加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异
构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C②④⑥ D.②⑤⑥
13.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该
电池的叙述不正确的是( )
A.该电池能够在高温下工作
B.电池的负极反应为:
C6H12O6+6H2O-24e-=6CO2+24H+
C.放电过程中,质子(H+)从负极区向正极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况
下CO2气体22.4L
26.(14分)醋酸亚铬水合物{[Cr(CH3COO)2]2·
2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。
实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。
已知二价铬不稳定,极易被氧气氧化,不与锌反应。
制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)=ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)=2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)=[Cr(CH3COO)2]2·
2H2O(s)
请回答下列问题:
(1)仪器1的名称是。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是(选下面的A、B或C);
目
的是。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门(填“A”或“B”,下同),打开阀门。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;
实验后得干燥纯净的[Cr(CH3COO)2]2·
2H2O9.48g,则该实验所得产品
的产率为(不考虑溶解的醋酸亚铬水合物)。
27.(15分)工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
⑴步骤①所得废渣的成分是(写化学式),操作I的名称。
⑵步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)
2RAn(有机层)+nH2SO4
(水层)
②中萃取时必须加入适量碱,其原因是。
③中X试剂为。
⑶⑤的离子方程式为。
⑷25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH
1.3
1.4
1.5
1.6
1.7
1.8
1.9
2.0
2.1
钒沉淀率%
88.1
94.8
96.5
98.0
98.8
96.4
93.1
89.3
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<
。
(已知:
25℃时,Ksp[Fe(OH)3]=2.6×
10-39)
⑸该工艺流程中,可以循环利用的物质有和。
28.(14分)含氮化合物的研发与绿色反展、经济可持续发展有着密切关联。
(1)氨是一种重要化工原料。
合成氨原料气H2,可用天然气为原料制得,有关反应能量变
化如下图所示。
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:
(2)氮的氧化物有着广泛用途,又是环境的污染物。
(i)在150℃时,将0.4molNO2气体充入体积为2L的真空密闭容器中,发生反应:
2NO2(g)
N2O4(g)。
每隔一定时间测定容器内各物质的物质的量,数据如下表:
时间/S
20
40
60
80
N(NO2)/mol
0.4
n1
0.26
n3
n4
N(N2O4)/mol
0.05
n2
0.08
①当反应在150℃达到平衡时,该反应平衡常数K=________。
(填数值)
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为______________。
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):
n(NO2)=1:
1,可用尿素溶液除去,其作用原理是:
NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成对环境无污
染的物质。
若用1mol尿素吸收该尾气,则能吸收氮氧化物___________g。
(3)氨气,CO2在一定条件下可合成尿素,其反应为:
2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(g)
右图表示合成塔中氨碳比a与CO2转化率ω的关系。
a为[n(NH3)/n(CO2)],b为水碳比[n(H2O)/n(CO2)]。
则:
①b应控制在____;
A.1.5~1.6B.1~1.1C.0.6~0.7
②a应控制在4.0的理由是_____________________。
36.【化学选修——化学与生活】
(15分)
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
已知:
①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:
2Na2SiO3+2NaAlO2+4H2O===Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为
、________。
(2)滤渣A的主要成分是
;
硅铝酸盐沉淀写成氧化物的形式是
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是
(4)若该工厂用mkg铝土矿共制得nkgAl(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为
(5)若将铝溶解,下列试剂中最好选用
(填编号)。
A.浓硫酸B.稀硫酸C.稀HNO3D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是
,配位数为
37.【化学——选修3:
物质结构与性质】
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。
A的基态原子2p能级有3个单电子;
C的基态原子2p能级有1个单电子;
E原子最外层有1个单电子,其次外层有3个能级且均排满电子;
D与E同周期,价电子数为2。
(1)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是。
(2)A、B、C三种元素的氢化物稳定性由强到弱的顺序为(用化学式表示)。
(3)A的最简单氢化物分子的空间构型为_______,其中A原子的杂化类型是________。
(4)A的单质中δ键的个数为,π键的个数为。
(5)写出基态E原子的价电子排布式:
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为
ρg·
cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。
(用ρ、NA的计算式表示)
38【化学——选修5:
有机化学】
以有机物A为原料合成重要精细化工中间体TMBA(
)和抗癫痫药物H(
)的路线如图(部分反应略去条件和试剂):
I.RONa+R′X→ROR′+NaX;
II.RCHO+R′CH2CHO
+H2O(R、R′表示烃基或氢)
(1)A的名称是 ;
C能发生银镜反应,则C分子中含氧官能团的名称是 .
(2)①和②的反应类型分别是 、 .
(3)E的结构简式是 ,试剂a的分子式是 .
(4)C→D的化学方程式是 .
(5)D的同分异构体有多种,其中属于芳香族酯类化合物的共有 种.
(6)F与新制Cu(OH)2悬浊液发生反应的化学方程式是 .
(7)已知酰胺键(
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 .
江西省五市八校2016届高三第二次联考化学参考答案
7
8
9
10
11
12
13
26.(14分)
(1)分液漏斗(2分)
(2)C(2分)让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化(2分)
(3)B(2分)A(2分)(4)使锌与CrCl3充分反应得到CrCl2(2分)
(5)84.0%(2分)
27.(15分)
(1)SiO2(1分);
过滤(1分)
(2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量等](3分);
H2SO4(2分)
(3)NH3·
H2O+VO3-=NH4VO3↓+OH-(2分)
(4)1.7~1.8(或1.7、1.8其中一个)(2分),2.6×
10-3mol·
L-1(2分)
(5)氨气(或氨水)(1分);
有机萃取剂(1分)
28.(14分)
(1)CH4(g)+H2O(g)==CO(g)+3H2(g)△H=+171.1KJ/mol(3分)
(2)(i)①2.8(2分)②0.10mol/L(2分)(ii)76g(2分)
(3)①C(2分)
②a等于4.0,CO2转化率迅速提高到最大值;
而a在4.0之后增大,c(NH3)转化率无明显增大。
(3分)
36.
(1)2OH-+Al2O3==2AlO2-+H2O;
SiO2+2OH-==SiO32-+H2O(各2分)
(2)Fe2O3、Na2Al2Si2O8(各1分)Na2O·
Al2O3.·
2SiO2(2分)
(3)Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率(或合理答案);
(2分)
(4)5100n/27m%或1700n/9m%(2分)
(5)B(1分)
(6)[AlF6]3-;
6(各1分)
37.
(1)H2O分子间存在氢键(2分)
(2)HF>
H2O>
NH3(2分)
(3)三角锥形(2分)sp3(2分)(4)1(1分)2(1分)
(5)3d104s1(2分)(6)
(3分)
38.
(1)苯酚(1分);
羟基、醛基(2分).
(2)加成反应、氧化反应(各1分).
(3)
(1分),C2H4O(1分)
(4)
+2Br2→
+2HBr(2分)
(5)6(2分)
(6)
(7)
+NaOH→
+H2NC(CH3)2(2分)