重点推荐人教版高中化学必修一期末测评2Word格式.docx
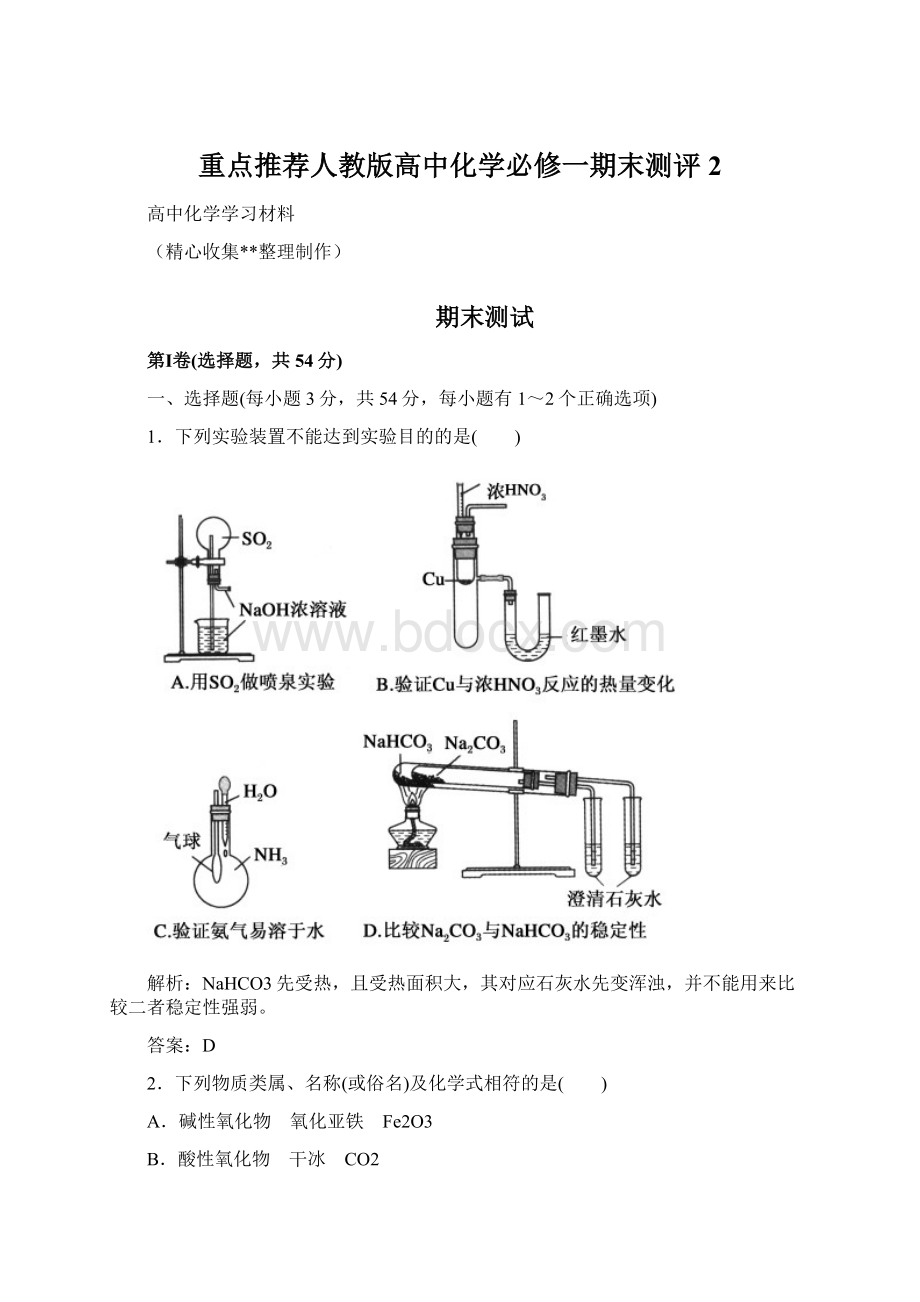
《重点推荐人教版高中化学必修一期末测评2Word格式.docx》由会员分享,可在线阅读,更多相关《重点推荐人教版高中化学必修一期末测评2Word格式.docx(17页珍藏版)》请在冰豆网上搜索。
B.实验Ⅱ:
烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:
试管中溶液中产生红色沉淀
D.实验Ⅳ:
放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
溶液分层后,上层无色,下层呈紫色,A错误;
烧杯中出现的白色沉淀不会溶解,B错误;
实验Ⅲ试管中溶液变成红色,无沉淀生成,C错误;
浓H2SO4吸水会使饱和CuSO4溶液析出晶体,D正确。
6.下列叙述正确的是( )
A.SO2具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3见光易分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价
A中,SO2作漂白剂是因其与有色物质化合而生成不稳定的无色物质;
B中,Na与MgCl2溶液反应时,Na首先与水反应生成NaOH,NaOH再与MgCl2反应,最终得到Mg(OH)2沉淀;
D中,金属铁与非金属反应时,产物中铁元素的价态和非金属的氧化性强弱有关,如铁与硫粉在加热时得到FeS。
C
7.下列是某同学对某些概念的理解和判断,下列各判断或说法正确的是( )
A.某物质灼烧时,焰色反应为黄色,则该物质一定是金属钠
B.酸性氧化物:
与水反应生成酸的物质
C.胶体:
分散质颗粒直径在1nm~100nm之间的分散系,能产生丁达尔效应
D.物质的量:
衡量物质微粒个数的单位
焰色反应呈黄色的可以是钠,也可以是钠的化合物,A错误;
酸性氧化物是指能够与碱反应生成盐和水的氧化物,B错误;
物质的量是表示含有一定数目粒子集合体的物理量,D错误。
8.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )
A.NaOH溶液[Ba(OH)2溶液]
B.FeSO4溶液(KSCN溶液)
C.KI(淀粉溶液)
D.Na2SO3溶液(BaCl2溶液)
NaOH在空气中变质会生成Na2CO3,与Ba(OH)2反应有白色沉淀生成,可以鉴别;
FeSO4在空气中被氧化为Fe2(SO4)3,遇KSCN溶液显红色,可以鉴别;
KI在空气中被氧化成I2,遇淀粉变蓝色,可以鉴别;
Na2SO3在空气中被氧化为Na2SO4,SO
和SO
都能与BaCl2反应生成白色沉淀,不能鉴别。
9.奥运会会旗是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环的物质间一定条件下能发生常见反应,不能相连环的物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,则下列适合的一组可能是( )
选项
蓝
黑
红
黄
绿
SiO2
CuSO4溶液
O2
NaOH溶液
Ag
稀H2SO4
CO2
Fe
Al(OH)3
NH3
NaOH
Mg
KOH溶液
Al
Fe2O3
根据相连环物质间一定条件下能发生常见反应可知:
在A项中,只有CuSO4溶液与Ag一组不反应;
在B项中,O2与Fe发生化合反应、Fe与稀H2SO4发生置换反应、稀H2SO4与NaOH溶液以及CO2与NaOH溶液发生复分解反应;
在C项中,NH3在纯O2中燃烧发生置换反应生成氮气和水、NH3与稀H2SO4发生化合反应,稀H2SO4与NaOH溶液以及Al(OH)3与NaOH溶液发生复分解反应,但稀H2SO4与Al(OH)3能反应不符合题意;
在D项中,CO2与KOH溶液以及Al与Fe2O3能反应不符合题意。
10.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。
实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O。
下列说法正确的是( )
A.ClO2是氧化产物
B.KClO3在反应中得到电子
C.H2C2O4在反应中被还原
D.1molKClO3参加反应有2mol电子转移
方程式中KClO3―→ClO2为还原反应,KClO3作氧化剂得1mol电子,ClO2为还原产物;
H2C2O4―→CO2为氧化反应;
H2C2O4为还原剂,失电子被氧化,CO2为氧化产物。
11.用试纸检验气体性质是一种重要的实验方法。
如下表所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )
试剂B
湿润的试纸A
现象
结论
碘水
淀粉试纸
变蓝
碘具有氧化性
浓氨水、生石灰
蓝色石蕊试纸
变红
氨气为碱性气体
Na2SO3、硫酸
品红试纸
褪色
SO2具有漂白性
Cu、浓硝酸
淀粉KI试纸
NO2为酸性气体
解析:
淀粉遇碘变蓝色是淀粉的性质而非碘的氧化性,A项错误;
NH3可以使红色石蕊试纸变蓝,B项错误;
NO2与水反应生成HNO3,具有氧化性,可将KI氧化生成I2,使淀粉变蓝,D项错误。
12.下列各组物质在溶液中反应时,以任意比混合均能用同一离子方程式表示的是( )
A.AlCl3溶液和NaOH溶液
B.Ba(OH)2溶液与稀硫酸
C.Na2CO3溶液和稀盐酸
D.Fe和稀硝酸
A项中,AlCl3过量时,生成Al(OH)3沉淀,OH-过量时生成AlO
;
C项中Na2CO3过量时,生成HCO
,而HCl过量时,生成CO2,D项中Fe过量时,生成Fe2+,而HNO3过量时,生成Fe3+,故A、C、D三项均不符合题意。
B项中不论谁过量,离子反应均为Ba2++2OH-+2H++SO
===BaSO4↓+2H2O。
13.在生产、生活及化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行检验,以确定物质的组成。
下列有关物质检验的说法正确的是( )
A.炭粉、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开
B.(NH4)2SO4、K2SO4、NH4Cl三种物质不能用一种试剂通过化学反应区别开
C.可以用NaOH溶液检验FeCl3溶液中是否混有FeCl2
D.用湿润的淀粉KI试纸可以检验氯化氢气体中是否含有氯气
稀盐酸分别与C、CuO、Fe混合,现象依次为无现象、溶液变蓝、放出气体,故能区别开,A项不正确;
向(NH4)2SO4、K2SO4、NH4Cl中分别加入Ba(OH)2溶液,现象依次为产生白色沉淀及放出有刺激性气味的气体、只产生白色沉淀、只放出有刺激性气味的气体,故B项不正确;
Fe(OH)3呈红褐色沉淀,会掩盖Fe(OH)2白色沉淀,故C项不正确。
14.已知:
①在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝;
②在上述蓝色溶液中,滴加过量的Na2SO3溶液,蓝色逐渐消失;
③取实验②生成的溶液滴加BaCl2溶液,有白色沉淀生成。
下列判断正确的是( )
A.上述实验证明氧化性:
ClO->I2>SO
B.上述实验③中的白色沉淀是BaSO4,一定不含有BaSO3
C.实验①中硫酸的作用是作氧化剂和酸化剂
D.实验②证明SO
既有氧化性又有还原性
据题意有:
ClO-+2I-+2H+===Cl-+I2+H2O、SO
+I2+H2O===2I-+SO
+2H+,所以可知氧化性:
因为②中加入了过量的Na2SO3溶液,所以③中含有BaSO3沉淀;
①中硫酸只起到酸化作用;
②中只能证明SO
有还原性。
15.下列推断正确的是( )
A.SiO2是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试剂,充分振荡后溶液呈红色
SiO2与NaOH溶液反应的化学方程式为SiO2+2NaOH===Na2SiO3+H2O,符合酸性氧化物的定义,A项正确;
Na2O与CO2反应生成Na2CO3,Na2O2与CO2反应生成Na2CO3和O2,B项错误;
NO在常温下与空气中的O2迅速反应生成NO2,化学方程式为2NO+O2===2NO2,C项错误;
新制氯水中存在H+和HClO,具有酸性和漂白性,滴加紫色石蕊试液振荡后,溶液先变红后褪色,D项错误。
16.某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;
再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;
若向原溶液中加入铝粉,有气体放出。
该溶液可能大量存在的一组离子是( )
A.K+、H+、NO
、Na+B.H+、Br-、SO
、NO
C.SO
、Br-、OH-、Fe2+D.OH-、Br-、SO
、K+
溶液无色,则C项错误;
加入足量饱和氯水,溶液呈橙黄色,说明溶液中含有Br-,再加BaCl2溶液产生白色沉淀,可能是SO
与氯水反应产生的SO
与Ba2+反应生成BaSO4沉淀,也可能在原溶液中含SO
,A项错误;
加入铝粉后有气体放出,说明溶液中含H+或OH-,而B项中Br-与H+、NO
不能共存,因为HNO3可将Br-氧化为Br2,B项错误,D项正确。
17.现有25mL2mol·
L-1的Na2CO3溶液和75mL1mol·
L-1的稀盐酸。
①将Na2CO3溶液逐滴滴加到盐酸中;
②将盐酸逐滴滴加到Na2CO3溶液中。
在标准状况下生成气体的情况是( )
A.均为0.84LB.均为0.56L
C.①>②D.①<②
将Na2CO3溶液逐滴滴加到盐酸中发生的反应为:
Na2CO3+2HCl===2NaCl+H2O+CO2↑。
将盐酸逐滴滴加到Na2CO3溶液中发生的反应为:
Na2CO3+HCl===NaHCO3+NaCl,NaHCO3+HCl===NaCl+H2O+CO2↑。
通过计算可知提供的盐酸是不足量的,因此①产生的气体多。
18.将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。
待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。
则下列说法正确的是( )
A.Mg和Al的总质量为8g
B.原稀硫酸溶液的物质的量浓度为5mol·
L-1
C.生成的H2在标准状况下的体积为11.2L
D.NaOH溶液的物质的量浓度为5mol·
由图象可知,沉淀Mg(OH)2为0.15mol,Al(OH)3为(0.35-0.15)mol=0.20mol,则镁和铝的总质量为0.15mol×
24g·
mol-1+0.20mol×
27g·
mol-1=9g,故A项不正确;
与Al(OH)3反应的NaOH为0.24L-0.20L=0.04L,由两者反应关系式Al(OH)3~NaOH可得c(NaOH)=5mol·
L-1,即D项正确;
根据已推出数据可求得c(H2SO4)=11mol·
L-1,标准状况下V(H2)=10.08L,故B、C两项不正确。
第Ⅱ卷(非选择题,共56分)
二、非选择题(共56分)
19.(4分)下列有关实验操作或判断不正确的是________。
A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大
B.用干燥的pH试纸测定氯水的pH
C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸并搅拌
D.实验室制取NO气体时,既可用排水法收集又可用排空气法收集
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
F.观察钾元素焰色反应的操作:
先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
G.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
氯水具有漂白性,可使pH试纸褪色,故B项错误;
NO与空气中的O2反应,不能用排空气法收集,D项错误;
NaOH固体易潮解,不能放在纸上称量,E项错误;
铂丝蘸取KCl之前,应在火焰上烧至无色,F项错误。
BDEF
20.(8分)实验室要配制500mL、0.1mol·
L-1Na2CO3溶液,回答下列问题。
(1)应用托盘天平称取十水碳酸钠晶体________g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时实际称量的碳酸钠晶体是________g。
(1g以下用游码)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为________(操作步骤可用多次)。
A.调整零点
B.将游码移至刻度尺的零刻度处
C.将碳酸钠晶体放入小烧杯中称量
D.称量空的小烧杯
E.将砝码放回砝码盒内
F.记录称量结果
(4)配制Na2CO3溶液时需用的主要仪器有________。
(5)若实验遇下列情况,溶液的浓度是偏高、偏低还是不变?
A.加水时超过刻度线________。
B.忘记将洗涤液加入容量瓶________。
C.容量瓶内壁附有水珠而未进行干燥处理________。
D.定容后摇匀,液面低于刻度线________。
(1)n(Na2CO3)=0.5L×
0.1mol·
L-1=0.05mol
m(Na2CO3·
10H2O)=0.05mol×
286g·
mol-1=14.3g。
(2)用托盘天平称量时,m(砝码)+m(游码)=m(物)
放反后,则m(物)+m(游码)=m(砝码)
则m(物)+0.3g=14g,m(物)=13.7g。
(5)误差分析可根据c=
来判断,A使V大,B中n减少,C无影响,D也无影响。
(1)14.3'
(2)13.7'
(3)B、A、D、F、C、F、E、B
(4)烧杯、天平、玻璃棒、容量瓶、胶头滴管、药匙
(5)偏低 偏低 不变 不变
21.(10分)下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。
气体B与气体C相遇产生大量的白烟生成E,A是强碱,D是海水中浓度最高的盐(部分反应物和生成物及水已略去)。
请回答下列问题:
(1)写出乙与丙生成B的化学方程式:
________________。
(2)写出甲和A溶液反应的离子方程式:
______________。
(3)检验E中的阳离子时,取少量E于试管中,___________则证明E中有该阳离子。
(4)写出实验室制取B的化学方程式:
(5)B常用作工业制某酸的原料,写出由B制该酸过程中的化学方程式:
______________________________________________。
(1)N2+3H2
2NH3
(2)2Al+2OH-+2H2O===2AlO
+3H2↑
(3)加入NaOH溶液,加热,用湿润的石蕊试纸靠近试管口,试纸变蓝
(4)2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
(5)4NH3+5O2
4NO+6H2O
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO
22.(6分)
(1)在标准状况下,某气体A的密度是2.15g·
L-1,则它的摩尔质量是________,该气体在相同温度和压强下其相对于氧气的密度是________。
若气体A是单质,同质量的A与氧气所含的原子数________(填“相等”或“不相等”)。
(2)三种正盐的混合溶液中含有0.2molNa+、0.25molMg2+、0.4molCl-,则SO
为________mol。
(3)某物质的相对分子质量为M,在温度为T时的溶解度为Sg,此时测得饱和溶液的密度为dg·
cm-3,则该饱和溶液中该物质的物质的量浓度为________。
(4)现实验室要用质量分数为40%的浓氢氧化钠(密度为1.2g·
mL-1)来配制浓度为0.6mol·
L-1的稀氢氧化钠100mL,问需要这种浓碱的体积是________L。
(1)气体A的摩尔质量为2.15g·
L-1×
22.4L·
mol-1=48g·
mol-1。
由阿伏加德罗推论得知,同温同压下,气体密度之比等于其摩尔质量之比,即
=1.5。
若气体A为单质,由于摩尔质量为48g·
mol-1,则气体A只可能是O3,因此同质量的A与氧气所含的原子数相等。
(2)由溶液中正负离子所带电荷总数为零得,n(SO
)=
[n(Na+)+2n(Mg2+)-n(Cl-)]=
×
(0.2mol+2×
0.25mol-0.4mol)=0.15mol。
(3)由c=
得,该物质的量浓度
=
mol·
L-1。
(1)48g·
mol-1 1.5 相等
(2)0.15
(3)
(4)0.005
23.(7分)在Na+浓度为0.5mol·
L-1的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子
K+、Ag+、Mg2+、Ba2+
阴离子
NO
、CO
、SiO
、SO
取100mL该溶液进行如下实验(气体体积在标准状况下测定):
序号
实验内容
实验结果
Ⅰ
向该溶液中加入足量稀HCl
产生白色沉淀并放出0.56L气体
Ⅱ
将Ⅰ的反应混合液过滤,洗涤沉淀、灼烧至恒重,称量所得固体质量
固体质量为2.4g
Ⅲ
在Ⅱ的滤液中滴加BaCl2溶液
无明显现象
试回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是________(填离子符号)。
(2)实验Ⅰ中生成沉淀的离子方程式为______________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要的计算,填写下表中阴离子的浓度:
(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?
”)
CO
SiO
SO
c/mol·
(4)判断K+是否存在,若存在则求其最小浓度,若不存在则说明理由:
_____________________________________________
_______________________________________________。
(1)Ag+、Mg2+、Ba2+
(2)SiO
+2H+===H2SiO3(胶体)
(3)
?
0.25
0.4
(4)存在,其最小浓度为0.8mol·
24.(13分)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。
为了验证甲、乙两同学的判断是否正确,丙同学设计了如下图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去)。
请回答:
(1)上述实验中生成二氧化硫气体的化学方程式为_____________________________________________________。
(2)乙同学认为还可能产生氢气的理由是_____________。
(3)丙同学在安装好装置后,必不可少的一步操作是___________________________________________________。
(4)A中加入的试剂可能是________,作用是________;
B中加入的试剂可能是________,其作用是____________________;
E中加入的试剂可能是______________,作用是________________。
(5)可以证明气体X中含有氢气的实验现象:
C中:
______________________________________________,
D中:
如果去掉装置B,还能否根据D中的现象判断气体X中含有氢气?
________(填“能”或“不能”),原因是______________
__________________________________________________。
本题对Zn与浓H2SO4反应的产物进行两种推测,而后设计实验进行验证。
设计时既要验证有无SO2生成,又要验证有无H2生成。
验证SO2可用品红溶液,验证H2可利用它的还原性,使其通过灼热的CuO,再通过无水硫酸铜判断是否有水生成来推断H2的存在。
同时应注意通入C中的气体必须干燥,也要防止空气中水蒸气进入D中,以免对H2的检验产生干扰。
(1)Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O
(2)当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2
(3)检查装置的气密性
(4)品红溶液 检验SO2 浓H2SO4 吸收水蒸气 碱石灰 防止空气中的水蒸气进入D中
(5)黑色粉末变成红色'
白色粉末变成蓝色'
不能'
通过品红溶液、酸性KMnO4溶液后,混合气体中可能含H2O,会干扰H2的检验
25.(8分)50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_