聊城市某重点高中高二化学上学期期初分班教学测试试题Word格式文档下载.docx
《聊城市某重点高中高二化学上学期期初分班教学测试试题Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《聊城市某重点高中高二化学上学期期初分班教学测试试题Word格式文档下载.docx(26页珍藏版)》请在冰豆网上搜索。
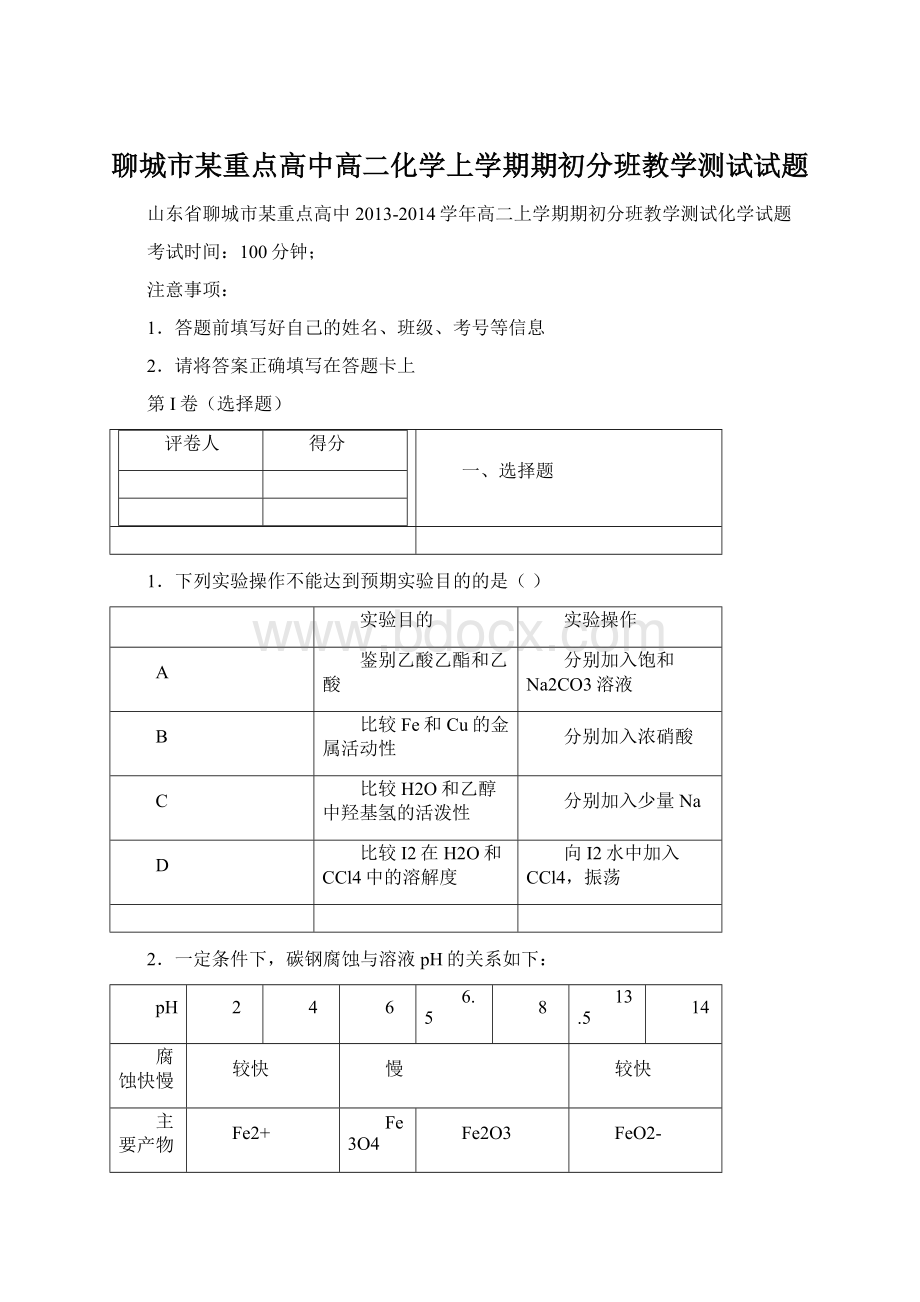
Fe2+
Fe3O4
Fe2O3
FeO2-
下列说法不正确的是()
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e—=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
3.工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)ΔH=akJ/mol
在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度
时间/min
n/mol
10
20
40
50
T1
n(CH4)
0.50
0.35
0.25
0.10
T2
0.30
0.18
……
0.15
A.10min内,T1时υ(CH4)比T2时小B.温度:
T1<T2
C.ΔH:
a<0D.平衡常数:
K(T1)<K(T2)
4.适宜用分液漏斗进行分离的一组混合物是()
A.乙酸和乙醇B.水和氯化钠C.水和花生油D.四氯化碳和碘
5.下列化学用语的书写正确的是()
A.乙酸的分子式:
C2H4O2
B.乙烯的结构简式C2H4
C.F原子结构示意图:
D.四氯化碳的电子式:
6.下列物质中,含有非极性键的共价化合物是()
A.CH3CH3B.Na2O2C.NaClD.N2
7.下列装置能够组成原电池的是()
8.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是()
A.蛋白质和脂肪B.蛋白质和高级烃C.淀粉和油脂D.纤维素和油脂
9.在固定体积的密闭容器中进行如下反应:
2SO2(g)+O2(g)
2SO3(g)。
已知反应过程某一时刻SO2、O2、SO3浓度(mol•L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是()
A.SO2、O2分别为0.4mol•L-1、0.2mol•L-1B.SO2为0.25mol•L-1
C.SO2、SO3均为0.15mol•L-1D.SO3为0.4mol•L-1
10.现代医学证明,硒是人体中14种必需的营养元素之一,缺硒与贫血、冠心病、不孕症、癌症等疾病直接相关。
因此,硒被誉为“生命的奇效元素”。
已知硒元素与氧元素同主族,则下列关于硒的叙述中不正确的是()
A.H2Se比H2O稳定
B.最高价氧化物的水化物化学式为H2SeO4
C.它有两种氧化物SeO2和SeO3
D.其单质常温下呈固态
11.把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由右图表示。
在下列因素中对产生H2速率有影响的是()
①盐酸的浓度②镁条的表面积③溶液的温度④Cl-的浓度
A.①④B.③④C.①②③D.②③
12.某有机物A的结构为
,下列有关说法正确的是()
A.1molA能跟2molNaOH溶液反应B.能发生加聚反应
C.能发生分子内酯化反应D.A分子中所有原子在同一平面上
13.实验室中的药品常按物质的性质、类别等有规律地摆放。
现有部分药品按某种规律摆放在实验桌上,如下图。
做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是
14.判断下列有关化学基本概念的依据正确的是
A.溶液与胶体:
不同的本质原因是能否发生丁达尔效应
B.纯净物与混合物:
是否仅含有一种元素
C.氧化还原反应:
反应前后元素化合价是否变化
D.强电解质与弱电解质:
水溶液中导电性的强弱
15.在某无色透明的酸性溶液中,能大量共存的离子组是
A.Na+、K+、SO42-、HCO3- B.Na十、Ba2+、NO3-、SO42-
C.Na+、K+、Cl-、NO3- D.Fe3+、K+、SO42-、OH-
16.下列化学用语表达正确的是
A.磷原子的原子结构示意图:
B.钠离子的电子式:
C.甲烷的结构式:
D.质子数为8,中子数为10的核素:
10O
17.下列叙述正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.同一主族的元素,原子半径越大,氧化性越强
C.ⅦA族元素形成的单质,其熔点随元素原子序数增大而降低
D.从上到下,ⅦA族元素形成的氢化物稳定性逐渐减弱
18.下列措施中,能减慢化学反应速率的是
A.食物储存在冰箱里
B.将块状固体药品研细后再反应
C.用MnO2作H2O2分解反应的催化剂
D.用30%H2SO4溶液代替5%H2SO4溶液与锌粒反应
19.下列装置中能构成原电池的是
20.下图是电解饱和NaCl溶液的装置,其中c、d为石墨电极。
则下列有关的判断正确的是
A.a为阳极、b为阴极B.c为阴极、d为阳极
C.电解过程中,d处加酚酞变红D.电解过程中,氯离子浓度不变
第II卷(非选择题)
二、填空题
21.钛铁矿的主要成分为FeTiO3(可表示为FeO·
TiO2),含有少量MgO、CaO、SiO2等杂质。
利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
已知:
FeTiO3与盐酸反应的离子方程式为:
FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是。
(2)滤渣A的成分是。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。
反应温度过高时,Ti元素浸出率下降的原因是。
(5)反应③的化学方程式是。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12+3LiFePO4
Li7Ti5O12+3FePO4
该电池充电时阳极反应式是。
22.A、B均为重要的有机化工原料。
请回答下列问题:
(1)A分子内含有苯环,其名称是。
(2)B分子中只有一种氢原子,2molB反应生成1molC的化学方程式是:
。
(3)B的一种同分异构体能发生银镜反应,该反应的化学方程式是:
(4)D分子内有3个甲基,其结构简式是。
(5)F的结构简式是。
F和L反应生成G是加成反应,L的结构简式。
(6)A与B反应生成J的化学方程式是。
(7)K分子内含有六元环,可发生水解反应,其结构简式是。
23.I.下图表示4个碳原子相互结合的方式。
小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是(填编号);
属于烯烃的是(填编号);
(2)上图中与B互为同分异构体但不属于同种类的物质的是:
(填编号)
II.课本“交流•研讨”栏目有这样一组数据:
破坏1mol氢气中的化学键需要吸收436kJ能量;
破坏1/2mol氧气中的化学键需要吸收249kJ的能量;
形成水分子中1molH—O键能够释放463kJ能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。
①kJ;
②kJ;
③kJ。
三、实验题
24.某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
实验现象
I
打开活塞a,滴加氯水,关闭活塞a
A中溶液变为红棕色。
II
吹入热空气
A中红棕色明显变浅;
B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。
III
停止吹入空气,打开活塞b,逐滴加入H2O2溶液
开始时颜色无明显变化;
继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。
(1)A中反应的离子方程式是。
(2)实验操作II吹入热空气的目的是。
(3)装置C的作用是,C中盛放的药品是。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式。
(5)由上述实验得出的结论是。
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):
25.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号
操作
①
分别在试管A、B中加入5mL5%H2O2溶液,各滴入2滴1mol/LFeCl3溶液。
待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;
将试管B放入盛有40℃左右热水的烧杯中浸泡。
试管A中不再产生气泡;
试管B中产生的气泡量增大。
②
另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2溶液
试管A、B中均未明显见到有气泡产生。
(1)过氧化氢分解的化学方程式为__________________________________________。
(2)实验①的目的是______________________________________________________。
实验中滴加FeCl3溶液的目的是_________________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是__________________________________(用实验中所提供的几种试剂)。
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________________。
26.实验室用下图所示装置来制取乙酸乙酯,回答下列问题:
(1)请写出本实验中发生的主要反应方程式。
(2)配置混合溶液时,加入试剂的正确顺序是(填“A”或“B”)。
A.先加乙醇,再慢慢注入浓硫酸和乙酸B.先加浓硫酸,再慢慢注入乙醇和乙酸
(3)浓硫酸的作用是。
(4)饱和Na2CO3溶液的作用是。
(5)实验完成后,右边试管液面上有透明的不溶于水的油状液体生成。
若要分离10mL该液体混合物需要用到的主要玻璃仪器是,这种分离方法叫做。
27.对于H2O2分解反应,Cu2+也有一定的催化作用。
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。
请回答相关问题:
①定性分析:
如图甲可通过观察_________________________,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________________________。
②定量分析:
用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。
实验中需要测量的数据是________________________。
四、推断题
28.
(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;
B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;
D的单质跟盐酸反应,生成D3+和氢气;
E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构。
①写出元素符号:
A,C,E。
②B、D的最高价氧化物对应水化物相互反应的离子方程式为:
③写出E2C的电子式:
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。
下图是元素周期表的一部分。
①阴影部分元素N在元素周期表中的位置为第周期第族。
根据元素周期律,预测:
酸性强弱H3AsO4H3PO4。
(用“>
”或“<”表示)
②元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:
在相同条件下Se与H2反应的限度比S与H2反应限度 。
(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
④下列说法正确的是
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
29.一种高分子化合物(VI)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
回答下列问题:
(1)化合物III中所含官能团的名称是、。
(2)化合物III生成化合物IV的副产物为。
(提示:
原子利用率100%,即原子全部都转化成产物)
(3)CH2=CH2与溴水反应方程式:
(4)写出合成路线中从化合物IV到化合物V的反应方程式:
(5)下列关于化合物III、IV和V的说法中,正确的是( )
A.化合物III可以发生氧化反应
B.化合物III不可以与NaOH溶液反应
C.化合物IV能与氢气发生加成反应
D.化合物III、IV均可与金属钠反应生成氢气
E.化合物IV和V均可以使溴的四氯化碳溶液褪色
(6)写出化合物I与氧气在Cu催化下反应的产物。
参考答案
1.B
【解析】
试题分析:
A、乙酸与碳酸钠反应生成气体,正确;
B、浓硝酸具有强氧化性,能与Fe、Cu反应,错误;
C、钠与水反应比与乙醇反应剧烈,说明水中的羟基氢活泼,正确;
D、I2由水溶液中被萃取到CCl4中,说明I2在CCl4中的溶解度更大,正确。
考点:
本题考查实验方案与原理。
2.C
A、pH<
4为强酸性,发生析氢腐蚀,正确;
pH>
6的溶液,氧气得电子,发生吸氧腐蚀,正确;
C、pH>
14的溶液氧气与水反应得电子:
O2+2H2O+4e‾=4OH‾,错误;
D、煮沸后除去了氧气,碳钢的腐蚀速率会减小,正确。
本题考查铁的腐蚀原理以及电极方程式的书写。
3.D
A、10min内,T2反应的CH4多,T2反应速率大,正确;
B、因为T2反应速率大,所以T1<T2[来,正确;
T2温度高,平衡时CH4的物质的量大,平衡向逆反应方向移动,正反应放热,K(T1)>
K(T2),C项正确,D项错误。
本题考查化学反应速率和化学平衡。
4.C
乙酸和乙醇互溶,不会分层,不能用分液漏斗分离,可以用蒸馏法分离提纯,故A错;
氯化钠易溶于水,不会分层,不能用分液漏斗分离,可以用蒸发结晶分离,故B错;
花生油的主要成分是油脂,油脂不溶于水,有分层现象,花生油位于上层,可用分液漏斗分离,故C正确;
碘易溶于四氯化碳,不会分层,不能用分液漏斗分离,可以用蒸馏分离,故D错。
考查分液漏斗的使用,涉及混合物分离和提纯的溶解、蒸发、结晶、蒸馏、分液以及常见无机物和有机物的溶解性等。
5.A
乙酸的结构简式为CH3COOH,则分子式为C2H4O2,故A正确;
乙烯的结构简式为CH2=CH2,其分子式为C2H4,故B错;
氟元素的原子序数为9,则氟原子的核电荷数为9,氟原子核外第一层电子数为2,第二层电子数为7,氟离子的核电荷数为9,氟离子核外第一层电子数为2,第二层电子数为8,故C错;
四氯化碳的分子式为CCl4,1分子的CCl4中含有4个C—Cl键,每个氯原子最外层还有6个电子,四氯化碳电子式中每个氯原子周围都还要加上6个小黑点,不能将非共用电子对省略,故D错。
考查化学用语,涉及原子结构示意图、离子结构示意图、共价化合物的电子式、结构简式、分子式等。
6.A
CH3CH3就是乙烷,乙烷是碳氢化合物,碳、氢都是非金属元素,因此乙烷是共价化合物,含有6个C—H键、1个C—C键,C—H键是极性键,C—C键是非极性键,故A正确;
Na2O2就是过氧化钠,钠是活泼金属,氧是活泼非金属,因此过氧化钠是离子化合物,且既含有离子键又含有非极性键,故B错;
NaCl就是氯化钠,钠是活泼金属,氯是活泼非金属,因此氯化钠是离子化合物,且只含有离子键,故C错;
N2就是氮气,氮气是氮元素的单质,氮是非金属,因此氮气只含有非极性键,故D错。
考查物质结构,涉及金属元素、非金属元素、共价化合物、离子化合物、单质、非极性键、极性键、离子键等。
7.C
A项,电极材料都是Cu,没有活泼性不同的两种金属作电极,不能构成原电池,故A错;
B项,电极材料是活泼性不同的Zn、Cu,且Zn与稀硫酸能自发地进行置换反应,但是两个烧杯的溶液缺少盐桥,没有构成闭合回路,故B错;
C项,电极材料是活泼性不同的Zn、Cu,且Zn与硫酸铜能自发地进行置换反应,且构成了闭合回路,故C正确;
D项,电极材料是活泼性不同的Zn、Cu,但是乙醇是非电解质,不仅不能构成闭合回路,且Zn不能与乙醇自发地进行氧化还原反应,故D错。
考查原电池的构成条件,涉及原电池的两个电极材料、电解质溶液、自发发生的氧化还原反应、闭合回路等。
8.B
蚕丝的主要成分是蛋白质,石蜡的主要成分是碳原子数目较多的烷烃、环烷烃或高级烃,故B正确。
考查基本营养物质,涉及日常生活中广泛应用的蚕丝、蜡烛的主要成分、糖类、油脂、蛋白质等。
9.B
用假设法、三行数据法先求逆反应进行到底时各组分浓度的极限值,再求正反应进行到底时各组分浓度的极限值,然后根据可逆反应不能进行到底或转化率不可能是100%判断各组分浓度的取值范围,从而确定答案。
先假设逆反应进行到底,则:
2SO3(g)
各组分的起始浓度/mol•L-10.20.10.2
各组分的变化浓度/mol•L-10.20.10.2
各组分的平衡浓度/mol•L-10.40.20
再假设正反应进行到底,则:
各组分的平衡浓度/mol•L-1000.4
由于正、逆反应都不可能进行到底,则达到平衡时二氧化硫的浓度:
0<
c(SO2)<
0.4mol•L-1,氧气的浓度:
c(O2)<
0.2mol•L-1,三氧化硫的浓度:
c(SO3)<
0.4mol•L-1,故AD均错,B正确;
若二氧化硫的浓度减小,说明反应正向进行,则三氧化硫的浓度增大,不可能二者同时减小,故C错。
考查可逆反应的特点,涉及物质的量在化学方程式中的应用、可逆反应、各组分三行数据(起始浓度、变化浓度、平衡浓度)的关系、各组分浓度的极限值和取值范围、反应物浓度和生成物浓度变化关系等。
10.A
从上到下,同主族元素非金属性递减,则O的非金属性大于硒,非金属性越强,气态氢化物越稳定,故A错;
同主族元素原子的最外层电子数相同,氧无最高正价,由于硫的最高价氧化物和水化物的化学式为H2SO4,根据相似性可得硒的最高价氧化物的水化物的化学式为H2SeO4,故B正确;
由于硫的氧化物有SO2、SO3,根据相似性可得硒的氧化物为SeO2和SeO3,故C正确;
由于同主族非金属单质的溶沸点逐渐增大,硫单质常温下呈固态,则溶沸点更高的硒单质呈固态,故D正确。
考查第VIA族元素及其化合物的性质,涉及同主族元素非金属性强弱顺序、气态氢化物的化学式及稳定性、最高价氧化物对应水化物的化学式、主要氧化物的化学式、同主族非金属单质溶沸点的大小顺序及状态等。
11.C
盐酸的浓度决定了氢离子浓度,氢离子浓度的大小决定了它与镁的置换反应速率的大小,故①正确;
镁条是固体反应物,其浓度是常数,但是表面积越大,与氢离子置换的速率越大,故②正确;
镁是活泼金属,与酸的置换反应是放热反应,随着反应的进行,溶液的温度逐渐升高,因此反应速率先增大后减小,故③正确;
由于氯化氢和氯化镁都是易溶易电离化合物,则氯离子没有反应,所以其浓度对产生氢气速率无影响,故④错。
考查影响化学反应速率的因素,涉及浓度、温度、固体反应物的表面等。
12.BC
有机物A的官能团是碳碳双键、羟基和羧基,只有羧基能电离出氢离子,则1molA最多能与1molNaOH反应,故A错;
碳碳双键在一定条件下能发生加聚反应,故B正确;
羧基和羟基在一定条件下能发生酯化反应,故C正确;
苯分子和乙烯分子都是共面的分子,但是甲烷分子是四面体分子,有机物A分子中来自苯、乙烯等的原子可以共面,但是来自甲烷衍生的—CH2—、—CH2OH中的原子不可能共面,故D错。
考查官能团结构和性质,涉及多官能团有机物的结构简式、最多消耗NaOH的物质的量、加聚反应、酯化反应、原子共面等。
13.C
氯化钡是盐,A中是酸,B中是酸碱指示剂,C中是盐,D中是碱,因此应把它放回的位置是C,答案选C。
考查物质分类的判断
点评:
该题是基础性试题的考查,难度不大。
明确物质的分类依据是答题的关键。
14.C
溶液与胶体:
不同的本质原因是分散质微粒直径大小不同,而不是丁达尔效应,A不正确;
由一种物质组成的是纯净物,由不同种物质组成的是混合物,与是否仅含有一种元素无关系,B不正确;
反应前后元素化合价是否变化是判断反应是氧化还原反应的依据,C正确;
在溶液中完全电离的电解质是强电解质,存在电离平衡的是弱电解质,与溶液导电性强弱无关系,D不正确,答案选C。
考查常见化学基