高考化学备考 以离子性质为基础的无机推断题文档格式.docx
《高考化学备考 以离子性质为基础的无机推断题文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学备考 以离子性质为基础的无机推断题文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
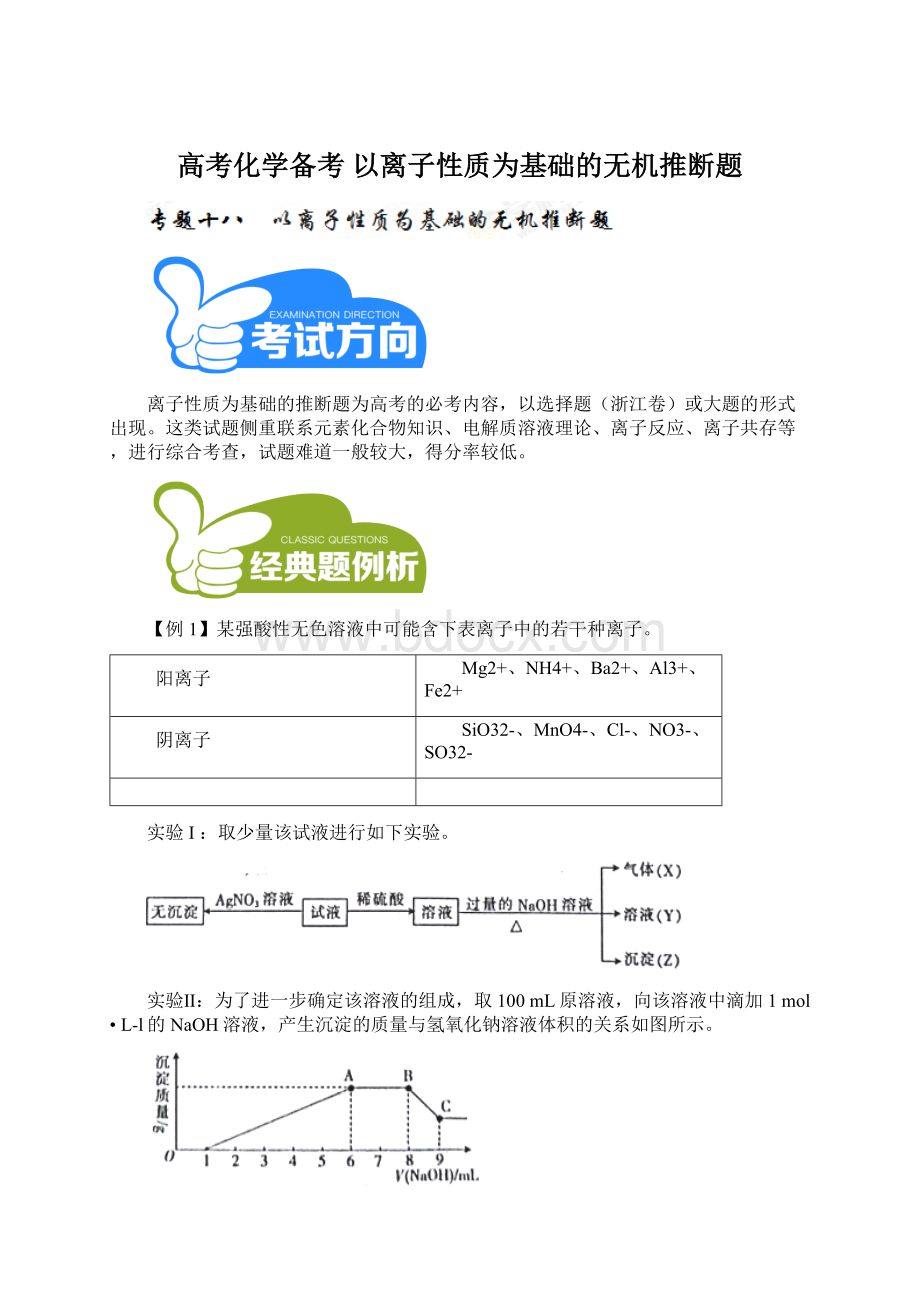
Al(OH)3+OH-==AlO2-+2H2O0.1360.08
(1)根据以上分析可知不进行实验就可以推断出上表中的离子一定不存在的有4种,即亚铁离子、硅酸根离子、高锰酸根离子和亚硫酸根离子。
(2)通过实验I可以确定该溶液中一定存在的阴离子是NO3-。
氨气是碱性气体,检验氨气的方法是用镊子夹一块湿润的红色石蕊试纸靠近气体X,试纸变蓝;
根据以上分析可知沉淀Z的化学式为Mg(OH)2。
(3)实验Ⅱ的图象中BC段发生氢氧化铝的溶解,对应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(4)A点消耗氢氧化钠6mL,则与金属阳离子反应的氢氧化钠是5mL,物质的量是0.005mol。
溶解氢氧化铝消耗氢氧化钠是1mL,物质的量是0.001mol,所以生成的氢氧化铝是0.001mol,则与镁离子反应的氢氧化钠是0.002mol,氢氧化镁是0.001mol,所以对应的固体质量为0.001mol×
(58+78)g/mol=0.136g。
(5)与氢离子反应的氢氧化钠是1mL,物质的量是0.001mol,即氢离子是0.001mol。
与铵根反应的氢氧化钠是2mL,物质的量是0.002mol,即铵根是0.002mol,根据溶液显电中性可知硝酸根的物质的量是
0.001mol+0.002mol+0.001mol×
3+0.001mol×
2=0.008mol,所以该溶液中阴离子的浓度为
0.008mol÷
0.1L=0.08mol•L-l。
点睛:
根据离子的特征反应及离子间的共存情况,进行离子推断时要遵循以下三条原则:
(1)互斥性原则。
判断出一定有某种离子存在时,将不能与之共存的离子排除掉,从而判断出一定没有的离子。
(2)电中性原则。
溶液呈电中性,溶液中一定有阳离子和阴离子,不可能只有阳离子或阴离子。
(3)进出性原则。
离子检验时,加入试剂会引入新的离子,某些离子在实验过程中可能消失(如溶液中的AlO2-在酸过量时转化为Al3+),则原溶液中是否存在该种离子无法判断。
学科#网
【例2】某无色溶液X,由Na+、Mg2+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:
(1)气体A的成分是_______(填化学式,下同),气体B的成分是_______。
(2)X溶液中一定存在的离子是______________。
(3)写出步骤①中发生反应的所有离子方程式:
______________。
(4)写出步骤②中形成白色沉淀的离子方程式:
(5)通过上述实验,溶液X中不能确定是否存在的离子是______________;
只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是______________。
【答案】CO2NH3CO32-、AlO2-、Na+CO32-+2H+=H2O+CO2↑、AlO2-+4H+=Al3++2H2OAl3++3HCO3-=Al(OH)3↓+3CO2↑SO42-在沉淀乙中加入足量盐酸,若白色沉淀能完全溶解,则X中不存在SO42-;
若不完全溶解,则X中存在SO42-
含有SO42-,根据溶液电中性原则可知含有Na+,所以溶液中一定含有CO32-、AlO2-、Na+,则
(1)气体A的成分是CO2,气体B的成分是NH3;
(2)X溶液中一定存在的离子是CO32-、AlO2-、Na+;
(3)步骤①中发生反应的所有离子方程式有CO32-+2H+=H2O+CO2↑、AlO2-+4H+=Al3++2H2O;
(4)步骤②
明确相关离子的性质、发生的化学反应是解答的关键,注意进行离子推断时要遵循以下三条原则:
离子检验时,加入试剂会引入新的离子,某些离子在实验过程中可能消失(如本题中的AlO2-在酸过量时转化为Al3+),则原溶液中是否存在该种离子无法判断。
解答时,首先,必须以扎实全面的基础知识作后盾。
扎实全面的基础知识是考生认真、准确解答试题的前提和基础。
例如考生要对离子的性质、离子的特征、离子间的反应关系要有准确全面的认识。
其次,必须要有正确清晰的解题思路和正确灵活的解题方法。
解决此类问题我们注意一下几点:
1、“能组先组”通过离子反应确定化合物的化学式时,如果通过离子共存可以确定的化学式,我们应先确定化学式再来做推导。
2、注意分析离子因
(1)、复分解反应(难溶、难电离、易挥发)
(2)因氧化还原反应(特别注意NO3—在酸性条件下)(3)、双水解(4)、离子颜色而不能共存或不能存在的离子。
(以上知识点我们要重点熟练掌握)
3、“确一排它”:
当确定了一种离子的存在就要去排除一些不能共存的离子。
4、“因过量而干扰的离子”:
注意添加了某些溶液后引入了新的离子而不能确定该离子
5、“电中性原则”:
最后要注意溶液是呈电中性原则,有大量的阳离子必含有阴离子,有大量阴离子必含阳离子。
1.水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。
经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。
某同学对其再进行如下的实验:
已知:
在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素
N
S
Na、Mg、Cl
Al
Ca
污染主体
机动车尾气
燃煤污染
海盐离子
土壤扬尘
建筑粉尘
根据实验结果可判断该地区大气颗粒物污染主体有___________。
【答案】
[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-BaSO4、BaCO38Al+3NO3-+5OH-+18H2O
3NH3↑+8[Al(OH)4]-Mg2+、Ca2+、CO32-机动车尾气、燃煤污染、土壤扬尘
(3)由流程,沉淀2中加盐酸,沉淀部分溶解并产生气体,结合已知中离子色谱检验结果可得,沉淀2应为BaSO4和BaCO3的混合物。
(4)流程中,溶液3加入铝粉和NaOH加热条件生成的气体2能使湿润的pH试纸变蓝,则气体2为氨气,由已知:
在加热与强碱性条件下,铝单质可以将NO3-还原为氨气,所以“溶液3
气体2”的离子方程式为:
8Al+3NO3-+5OH-+18H2O
3NH3↑+8[A1(OH)4]-。
(5)根据试样溶液加过量NaOH溶液没有产生沉淀,可得Mg2+含量较低;
根据沉淀1完全溶解于NaOH溶液,可得沉淀1中没有CaCO3,Ca2+和CO32-含量较低,所以根据上述实验可推断该地区大气颗粒物中Mg2+、Ca2+、CO32-含量较低。
(6)根据实验结果可判断该地区大气颗粒物中Mg2+、Ca2+、CO32-含量较低,结合表中提供的信息可得:
机动车尾气、燃煤污染、土壤扬尘是该地区大气颗粒物污染主体。
2.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶
液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是_________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是__________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为______________。
(4)甲同学最终确定原溶液中所含阳离子是__________,阴离子是_________(写离子符号)。
【答案】K+、Fe3+3Fe2++4H++NO3-=3Fe3++NO↑+2H2O3NO2+H2O=2HNO3+NOFe2+、Cu2+Cl-、NO3-、SO42-
(3)Ⅲ中所得红棕色气体为NO2,与水反应的化学方程式为:
3NO2+H2O=2HNO3+NO。
(4)由Ⅰ、Ⅱ已知一定没有K+和Fe3+,由Ⅲ可知一定含有Fe2+,则一定不含CO32-,根据加酸,溶液仍澄清可知不含SiO3-,加盐酸后溶液中的阴离子种类不变,所以溶液中一定含有Cl-,加入BaCl2溶液,有白色沉淀生成,可知原溶液中含有SO42-,故溶液中肯定含有的离子有:
Fe2+、NO3-、Cl-、SO42-,因为含有5种离子且离子浓度相等,根据溶液显电中性可知一定含有Cu2+,因此含有的5种离子为Fe2+、NO3-、Cl-、SO42-、Cu2+,其他离子均不存在。
甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-。
3.在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
K+、Ag+、Mg2+、Ba2+
NO3-、CO32-、SiO32-、SO42-
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号
实验内容
实验结果
Ⅰ
向该溶液中加入足量稀HCl
产生白色沉淀并放出0.56L气体
Ⅱ
将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量
固体质量为2.4g
Ⅲ
在Ⅱ的滤液中滴加BaC12溶液
无明显现象
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是____________。
(2)实验I中生成沉淀的离子方程式为____________________。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?
”)
NO3-
CO32-
SiO32-
SO42-
c/mol·
L-1
_______
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由_______________。
【答案】Ag+、Mg2+、Ba2+SiO32-+2H+
=H2SiO3↓(或SiO32-+2H++H2O=H4SiO4↓)?
0.250.40存在,其最小浓度为0.8mol/L
(3)标准状况下0.56LCO2的物质的量为0.025mol,根据C原子守恒,则原溶液中CO32-的物质的量浓度为:
0.025mol÷
0.1L=0.25mol•L-1;
实验II所得固体是SiO2,质量为2.4g,根据Si原子守恒,则原溶液中SiO32-的物质的量浓度为:
2.4g÷
60g•mol-1÷
0.1L=0.4mol•L-1;
由实验III可得,溶液中一定不存在SO42-;
已确定存在的阴离子为:
0.25mol•L-1CO32-、0.4mol•L-1SiO32-,已知的阳离子为:
0.5mol•L-1Na+,根据电荷守恒,一定存在K+,不确定是否存在NO3-。
(4)由上述分析知,一定存在K+,若不存在NO3-时K+浓度最小,由电荷守恒可得
c(K+)+c(Na+)=2c(CO32-)+2c(SiO32-),即c(K+)+0.5mol•L-1=2×
0.25mol•L-1+2×
0.4mol•L-1,解得
c(K+)=0.8mol•L-1。
4.一份溶液中可能大量含有K+、A13+、H+、NH4+、Cl-、Br-、I-、ClO-、A1O2-等离子中的若干种。
为了确定溶液的组成,进行了如下操作:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示:
则该溶液中一定存在的离子是________,一定不大量存在的离子是__________。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-、与通入氯气的体积(标准状况下)关系如下表所示,回答下列问题:
Cl2的体积(标准状况下)
2.8L
5.6L
11.2L
n(Cl-)
1.25mol
1.5mol
2mol
n(Br-)
1.4mol
0.9mol
n(I-)
amol
当通入的氯气为2.8L(标准状况下)时,溶液中发生反应的离子方程式为___________,原溶液中n(Cl-)为____mol;
通入氯气的体积在2.8L~5.6L(标准状况下)之间时的有关离子方程式为(如有多个反应,请分开书写)_________________,原溶液中Cl-、Br-、I-的物质的量浓度之比为_______________。
【答案】Al3+、H+、NH4+ClO-、AlO2-Cl2+2I-=2Cl-+I21Cl2+2I-=2Cl-+I2、Cl2+2Br-=2Cl-+Br210:
15:
4
(2)在含有Cl-、Br-、I-的混合溶液中,由于还原性大小顺序为:
I->
Br-,通入Cl2时,Cl2先与I-反应,再与Br-反应。
2.8LCl2的物质的量为0.125mol,当第一次通入0.125molCl2时,仍有amolI-剩余,
5.某强酸性溶液X:
可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,转化关系如图所示。
反应过程中有一种气体在空气中会变为红棕色。
(1)由题给信息可知,溶液X中确定不存在的阴离子有_______________。
(2)沉淀C是______(填化学式),由此可确定溶液X中肯定不存在的阳离子有________。
(3)气体A是________(填化学式),产生气体A的离子方程式为________________。
(4)________(填“能”或“不能”)根据沉淀E确定溶液X中存在Fe3+,理由是________。
(5)步骤④中发生反应的离子方程式为________________。
(6)根据题给信息和图中转化关系,可以确定溶液X中肯定存在的离子有________,可能存在的离子有________。
检验可能存在的离子是否存在的方法是________。
【答案】CO32-、SiO32-、NO3-BaSO4Ba2+NO3Fe2++4H++NO3-=3Fe3++NO↑+2H2O不能溶液B中含有由Fe2+氧化得到的Fe3+,故无法确定溶液X中是否存在Fe3+AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-Al3+、NH4+、SO42-、Fe2+Fe3+取少量溶液X于试管中,滴加几滴KSCN溶液,若溶液变红色,则溶液X中含有Fe3+;
若溶液不变红色,则溶液X中不含有Fe3+
【解析】溶液显酸性,则一定不存在CO32-、SiO32-;
X与硝酸钡溶液反应生成气体A、溶液B和沉淀C,则C一定是硫酸钡,一定含有SO42-,则一定不存在Ba2+。
A一定是NO,在空气中转化为红棕色NO2,这说明含有还原性离子亚铁离子,因此一定不存在NO3-;
溶液B与过量氢氧化钠反应生成气体D是氨气,一定存在铵根离子,沉淀E一定是氢氧化铁,与盐酸反应生成氯化铁,G是剩余盐酸和氯化铁的混合溶液。
溶液F中通入过量的CO2生成沉淀H,H是氢氧化铝,所以原溶液中含有铝离子,其中铁离子不能确定。