高三一轮复习铁及其化合物Word文档格式.docx
《高三一轮复习铁及其化合物Word文档格式.docx》由会员分享,可在线阅读,更多相关《高三一轮复习铁及其化合物Word文档格式.docx(29页珍藏版)》请在冰豆网上搜索。
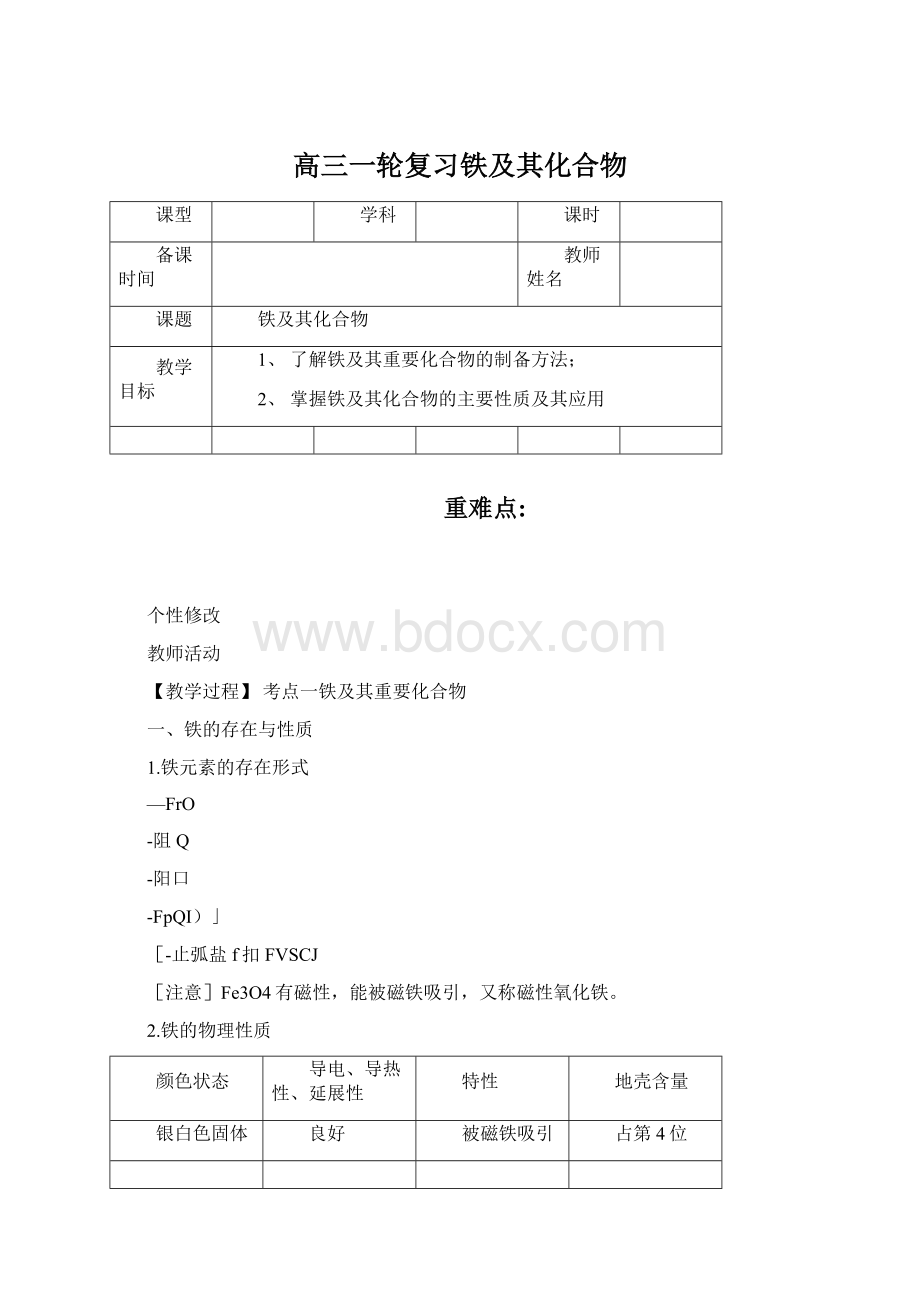
3Fe+4H2O(g)高温,Fe3O4+4H2。
(3)与酸的反应
化学方程式或现象
稀H2SO4
Fe+H2SO4===FeSO4+H2f
稀HNO3
Fe不足
Fe+4HNO3===Fe(NO3)3+NOf+2H2O
Fe过量
3Fe+8HNO3===3Fe(NO3)2+2NOf+4H2O
浓HNO3、浓H2SO4
常温下钝化
(4)与某些盐溶液的反应
1与CuSO4溶液反应的离子方程式:
Fe+Cu2+===Fe2++Cu。
2与FeCl3溶液反应的离子方程式:
2Fe3++Fe===3Fe2+。
[注意]
(1)Fe与Cl2反应生成FeCl3,Fe与盐酸反应生成FeCl2。
(2)铁在潮湿的空气中生成铁锈的主要成分是Fe2O3,而铁在纯氧中燃烧的产物是Fe3O4。
(3)铁与硫蒸气反应生成的是FeS而不是Fe2S3;
铁与碘蒸气反应生成的是Fel2而不是Fel3。
4.生铁的冶炼
(1)原料:
铁矿石、焦炭、空气、石灰石。
⑵设备:
高炉。
(3)主要反应
1还原剂的生成:
C+02=高温=82,CO2+c=3温=2CO;
2铁的还原:
Fe2O3+3CO===温=2Fe+3CO2;
咼温木咼温
3造渣反应:
CaCO3=====CaO+CO2f,CaO+SiO2=====CaSiO3。
二、铁的氧化物与氢氧化物
1.铁的氧化物
(1)物理性质
化学式
FeO
Fe2O3
Fe3O4
俗称
铁红
磁性氧化铁
色态
黑色粉末
红棕色粉末
黑色晶体
溶解性
难溶于水
铁的价态
+2价
+3价
+2价,+3价
(2)化学性质
FeO、Fe2O3、Fe3O4分别与盐酸反应的离子方程式为
FeO+2H+===Fe2++H2O,
Fe2O3+6H+===2Fe3++3出0,
Fe3O4+8H===2Fe3+Fe2+4出0。
2.铁的氢氧化物
Fe(OH)2
Fe(OH)3
白色固体
P红褐色固体
与盐酸反应
Fe(OH)2+2H+===Fe2++2H20
Fe(OH)3+3H+===Fe3++3出0
受热分解
一
△
2Fe(0H)3====Fe2O3+3H2O
制法
可溶性亚铁盐与碱反应:
Fe2++2OH—===Fe(OH)2J
可溶性铁盐与碱反应:
Fe3++3OH—===Fe(OH)3J
二者的关系
空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀
迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+
2H2O===4Fe(OH)3
[注意]
(1)Fe3O4的组成可用氧化物的形式表示为FeO・F0O3,即有1/3的铁显+2价,
2/3的铁显+3价。
⑵Fe(NO3)2溶液酸化后,H十、NO3具有强氧化性,会将Fe"
氧化成Fe3S
考点二铁盐和亚铁盐
一、掌握亚铁盐、铁盐的化学性质
1.亚铁盐含有Fe"
的溶液呈浅绿色,既有氧化性,又有还原性。
(1)氧化性:
Fe"
与Zn反应的离子方程式:
Zn+Fe2===Fe+Zn2。
(2)还原性
1向FeCl2溶液中滴入几滴KSCN溶液,再加入氯水(或通入CI2),若溶液变红色,证明Fe2
+具有还原性。
反应原理:
2Fe2++Cl2===2Fe3++2C「。
2向少量酸性KMnO4溶液中加入FeCl2溶液,若溶液紫红色褪去,证明Fe"
具有还原性。
MnO4+5Fe2++8H+===5Fe3++Mn2++4H2。
。
2.
Fe3+具有较强的氧化性。
KSCN溶液,再加入过量活泼金属(如Fe),若溶液红色褪去,2Fe3++Fe===3Fe2+。
-KI溶液,若溶液变成蓝色,证明Fe3*具有氧化性。
反应原理:
铁盐
含Fe3+的溶液呈黄色,
1向FeCI3溶液中滴入几滴证明Fe3+具有氧化性。
2向FeCI3溶液中加入淀粉
2Fe3+2I===12+2Fe2。
3向FeCI3溶液中通入H2S气体,若出现黄色浑浊,证明Fe3+具有氧化性。
2Fe3+H2S===2Fe2++SJ+2H十。
(2)
FeCI3+3H2O===:
特性:
含有Fe3+的盐溶液遇到KSCN时变成红色。
(3)FeCI3易水解:
将其饱和溶液滴入沸水中制备胶体的化学方程式为
Fe(OH)3(胶体)+3HCI。
3.Fe2+、Fe3+的相互转化
2+强氧化剂如①B「2
Fe还原剂如②FeFe
上述转化中标号反应的离子方程式为
12Fe2++Br2===2Fe3++2Br—;
22Fe3++Fe===3Fe2+。
二、明晰Fe2+、Fe3+的检验方法
1.Fe2+的检验
⑴I样品溶液
滴加――N溶液无现象滴双氯水溶液变红色,证明含有Fe2+
(2)样品溶液加入氢氧—钠溶液产生白色絮状沉淀,迅速变成灰绿色,最终变为红褐色,证明有Fe2+
⑶I样品溶液[加入K3[—―CN6]溶液生成蓝色沉淀,证明有Fe2+
2.Fe3十的检验
⑴|样品溶液滴加――^溶液溶液变红色,证明含有Fe3+
(2)|样品溶液|加入氢氧化钠溶液产生红褐色沉淀,证明有Fe3+存在
3.混合溶液中Fe3+>
Fe2+的检验
⑴Fe3+的检验
1|混合溶液|滴加――N溶液溶液变红色,说明含有Fe3+
2|混合溶液|淀粉――J试纸试纸变蓝色,说明含有Fe3+
⑵Fe2+的检验
滴加口性
1|混合溶液Ikm—―性液酸性KMno4溶液紫红色褪去,说明含有Fe"
2|混合溶液|滴加溴水漠水褪色,说明含有Fe"
③混合溶液
滴加Q——cN6]溶液生成蓝色沉淀,说明含有Fe2+
三、“铁三角”的转化
1.“铁三角”转化关系
只旳it总件
2.具体应用
(1)
卩©
2+不共存no3(HJ、
判断离子能否共存
ClO、Mn04(H)。
不存
IF尹的盐濟液}
、Fe3+HC03、C02「等水解相互促进的离子。
加少量相应的酸剧止F占水解°
⑶物质的制备
〈制警无水的砸Ch〉一
〈制备眩体〉一
在□□气粧中加热蒸干FfCh浴蔽.
向沸水屮加人恤和FeCh常液井
査沸至右红褂色胶状物岀现为止、
縛巩固练习
考点一铁及其重要化合物
一、铁的存在与性质
1•判断正误(正确的打■”,错误的打“X”)。
⑴铁具有导电、导热、延展性及被磁体吸引的特性(V)
(2)纯铁与02反应在表面生成Fe3O4薄膜,对内部金属起保护作用(V)
(3)用铁制容器可以运输浓硝酸和浓硫酸(V)
(4)Fe与稀HN03、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应(X)
(5)Fe在足量CI2中燃烧生成FeCl3,在少量Cb中燃烧生成FeCl2(X)
⑹根据ci2、s与铁的反应可以判断氯元素和硫元素的非金属性强弱(V)
二、铁的氧化物与氢氧化物
2•将下列物质的颜色和用途或性质用短线连接起来。
1Fe2O3a.红褐色
2Fe(OH)2b•红棕色
3Fe(OH)3c.白色
4Fe2+d•棕黄色
5Fe3+e.浅绿色
答案:
①一b—C;
②一c
A•具有较强的还原性
B•易被氧化成灰绿色最终变成红褐色
C.红色油漆、涂料
D.受热分解成红棕色粉末
E・具有较强的氧化性
B;
③一a—D;
④一e—A;
⑤一d—E
、掌握亚铁盐、铁盐的化学性质
3•除去括号中的杂质,并写出反应的离子方程式。
⑴FeCl2(Fe3+)除去方法:
,离子方程式:
。
⑵FeCl3(FeCl2)除去方法:
离子方程式:
(3)Fe2(SO4)3(FeSO4)除去方法:
离子方程式:
⑷FeCl2(Cu2+)除去方法:
⑴加入过量铁粉,过滤2Fe3++Fe===3Fe2+
⑵加入氯水或通入Cl22Fe2++Cl2===2Fe3++2C「⑶滴加H2O22Fe^+H2O2+2H===2Fe3*+2出。
⑷加入过量铁粉,过滤Fe+Cu2+===Cu+Fe2
4•判断正误(正确的打“V”,错误的打“X”)。
(1)检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN
溶液,观察实验现象()
(2)向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色,则溶液中一定含有Fe2+()⑶检验Fe(NO3)2晶体是否氧化变质的方法是将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN
溶液,观察溶液是否变红()
(4)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+()
解析:
检验Fe2+时,先加入氯水,会将溶液中的Fe2+氧化成Fe3+而无法用KSCN溶液检
验,应先加入KSCN溶液,再加入氯水,
(1)、⑵错误,⑷正确;
(3)中由于Fe(NO3)2溶液中含有NO3,加入稀H2SO4后,N03(H+)会将Fe2+氧化成Fe3+。
故不能用KSCN溶液检验Fe3+而判断Fe(NO3)2是否变质。
⑴x
(2)x(3)x⑷V
题型
(一)铁及其化合物的性质
【诊断1】判断正误(正确的打“V”,错误的打“x”)。
(1)(2016全国乙卷)1molFe溶于过量硝酸,电子转移数为2Na(x)
(2)(2016四川高考)常温下,将铁片浸入足量浓硫酸中,铁片不溶解,说明常温下,铁与浓硫酸不发生化学反应(x)
(3)(2016海南高考)将铁屑放入稀HNO3中,证明Fe比H2活泼(x)
(4)(2016上海高考)用NaOH溶液可以除去氧化铁中混有的二氧化硅(V)
(5)(2016上海高考)Fe与Cl2反应生成FeCh,推测Fe与12反应生成Fe“(x)
(6)(2015全国卷n)下列过程没有发生化学反应:
用含硅胶、铁粉的透气小袋与食品一起密封包装(x)
盐酸蒸发十,
(7)(2015江•苏高考)如下所示的物质间转化能一步实现:
Fe2O3>
FeCl3(aq)―蒸一>
无水
FeCl3(x)
(8)(2015广东高考)3mol单质Fe完全转化为Fe3O4,失去8Na个电子(V)
(9)(2014北京高考)铁表面自然形成的氧化层能保护内层不被空气氧化(x)
(10)(2015重庆高考)使用如图所示装置观察Fe(OH)2的生成(V)
题型
(二)氢氧化亚铁的制备
【诊断2】
(1)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是
水配制的NaOH溶液反应制备。
②除去蒸馏水中溶解的。
2常采用的方法。
3生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液
液面下,再挤出NaOH溶液。
这样操作的理由是。
(1)因为Fe(OH)2在空气中容易被氧化为红褐色的Fe(OH)3,因此要较长时间看到
Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。
①、②原理相同,都是先用氢气将装置中
的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;
③的原理为铁作阳极产生Fe"
与电解
水产生的OH「结合生成Fe(OH)2,且液面用汽油保护,能防止空气进入;
⑤中液面加苯阻止了
空气进入;
④由于带入空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉
淀。
⑵①Fe2+易水解,要加入稀硫酸防止其水解;
Fe2*易被空气中的。
2氧化,要加Fe粉防止
Fe2+被氧化。
②气体的溶解度随温度升高而降低,所以煮沸后的水中溶解的O2较少。
(1)①②③⑤
(2)①稀硫酸、铁屑②煮沸③避免生成的Fe(0H)2沉淀接触02
题型
(一)铁盐、亚铁盐的性质
【诊断3】判断正误(正确的打“V”,错误的打“X”)。
(1)(2016全国丙卷)FeCl3腐蚀Cu制印刷电路板是由于铁比铜的金属性强(X)
(2)(2016四川高考)Fe"
与出02在酸性溶液中的反应:
2Fe2++H2O2+2H+===2Fe++
2H2O(V)
(3)(2016江苏高考)向Fe2(SO4)3溶液中加入过量铁粉:
Fe3*+Fe===2Fe2+(X)
(4)(2016江苏高考)室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液
变蓝色,说明Fe3+的氧化性比12的强(V)
(5)(2016上海高考)用NaOH溶液和盐酸能除去FeCl2溶液中混有的CuCl2(X)
(6)(2015全国卷I)将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液会观察到有气体
生成,溶液呈血红色,说明稀硝酸将Fe氧化为Fe3+(X)
(7)(2015广东高考)向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液,加入H2O2后溶
液变成血红色,说明Fe"
既有氧化性又有还原性(X)
【诊断4】
(2016全国甲卷)某班同学用如下实验探究Fe*、Fe3+的性质。
回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol「1的溶液。
在FeCl2溶液中需
加入少量铁屑,其目的是。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
Cl2可将Fe2*氧化。
FeCL溶液与氯水反应的离子方程式为。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,
再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是
:
1IFeCl3溶液混合。
分别取
O
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生
反应的离子方程式为;
一段时间后,溶液中有气泡出现,并
放热,随后有红褐色沉淀生成。
产生气泡的原因是;
生成沉淀的原因是
(用平衡移动原理解释)。
(1)Fe2+具有很强的还原性,易被空气中的O2氧化为Fe3+,在FeCl2溶液中加入少量
铁屑,可防止Fe2*被氧化。
⑵Fe2*被氧化为Fe3*,CI2被还原为C「,反应的离子方程式为2Fe2*+Cl2===2Fe3*+2Cl
反应。
(5)酸化的FeCl2溶液与H2O2反应,Fe2+被氧化为Fe3+,H2O2被还原为H2O,反应的离子方程式为H2O2+2Fe2++2H*===2Fe3++2H2O。
Fe3+对H2O2的分解起催化作用,当反应一段时_Fe3+..…间后,会发生反应:
2H2O2=====2H2O+O2T,故溶液中产生气泡。
由于H2O2分解反应放热,
促使Fe3++3H2OFe(OH)3+3H+平衡右移,最终出现Fe(OH)3红褐色沉淀。
⑴防止Fe2+被氧化
(2)2Fe2++Cl2===2Fe3++2C「
⑶隔绝空气(排除氧气对实验的影响)
(4)Fe2+Fe3+可逆反应
(5)2Fe2++H2O2+2H+===2Fe3++2H2O
Fe3+催化H2O2分解产生O2H2O2分解反应放热,促进Fe3+的水解平衡正向移动
题型
(二)“铁三角”转化关系及应用
【诊断5】从某含有FeCl2、FeCIsCuCl2的工业废液中回收铜并制备氯化铁晶体的流程如
下:
则下列说法正确的是
A.试剂a是铁、试剂b是稀硫酸
B.操作I、操作n、操作川所用仪器相同
C.试剂c是氯气,相应的反应为2Fe2++Cb===2Fe3++2Cl
D.用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
选CA项,由最终要得到氯化铁晶体及流程图知,b是盐酸,错误;
B项,操作I
和操作n是过滤,操作川为蒸发结晶,所用仪器不相同,错误;
C项,滤液Z和X中均含有氯化亚铁,因此c为氯气,正确;
D项,高锰酸钾能氧化氯离子而褪色,因此不能用于检验是否含有亚铁离子,错误。
1.一定质量的某铁的氧化物FexOy,与足量的4mol•L1硝酸溶液充分反应,消耗硝酸溶
液700mL,生成2.24LNO(标准状况)。
则该铁的氧化物的化学式为()
A.FeOB.Fe2O3
C.Fe3O4D.Fe4O5
选C铁的氧化物FexOy与足量的4mol•L硝酸溶液充分反应,生成Fe(NO3)3,硝
224I
酸被还原生成NO,n(NO)=224I」mo「°
」mol,根据氮原子守恒可得,3n[Fe(NO3)3]+
n(NO)=n(HNO3),3n[Fe(NO3)3]+0.1mol=0.7Lx4mol一1,n[Fe(NO3)3]=0.9mol,令氧
化物FexOy中Fe元素的平均化合价为a,根据得失电子守恒可得,0.9molx(3—a)=0.1molx(5
88
—2),解得a=3,由化合物中正负化合价代数和为0可得3x=2y,x:
y=3:
4,故该氧化物的
化学式为Fe3O4。
2.下列物质反应后一定有+3价铁生成的是。
①过量的Fe与Cl2加热时发生反应
2Fe与过量稀H2SO4反应后,再向其中加KNO3
3Fe与过量的S加热时发生反应
4Fe(NO3)2溶液中加少量盐酸
5
+H—NO3Fe3+;
Fe与S反应只生
Fe和Fe2O3的混合物溶于盐酸中
Fe与Cl2反应只生成FeCl3;
Fe^量稀-H2SO4Fe2
成FeS;
Fe"
H—NO3Fe^;
Fe2O3溶于盐酸生成Fe3+,当混合物中Fe不足时,溶液中仍有Fe3+,当Fe足量时,溶液中无Fe3+。
①②④
3•下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物。
r-c-L
回答卜列冋题:
(1)写岀物质的化学式:
A:
B:
C:
(2)向F中逐滴滴加试剂①的现象为。
(3)写出下列反应的方程式:
C-E的离子方程式:
C-F的离子方程式:
G—H的离子方程式:
从D到红色粉末B,是Fe2O3生成的过程,B是Fe2O3,I是Fe(OH)3,H是Fe(OH)2,D是单质铁,试剂①是盐酸或硫酸,G是亚铁盐,试剂②是碱溶液,A是单质和B生成C和D,是铝热反应,A是Al,C是Al2O3。
(2)F为偏铝酸盐,AIO2与酸反应,观察到的现象是先产生白色沉淀Al(OH)3,继而Al(OH)3
溶于酸中,生成Al3+。
(3)C-E,是Al2O3和酸反应生成铝盐;
C-F是Al2O3和强碱反应生成
偏铝酸盐;
G-H是亚铁盐转化为Fe(OH)2。
(1)AlFe2O3Al2O3Fe(OH)3
(2)开始有白色沉淀生成,继续滴加沉淀溶解
⑶Al2O3+6H+===2Al3++3H2OAl2O3+2OH一===2AlO2+H2OFe2++2OH一
===Fe(OH)2J
4.
下列除杂的操作不正确的是()
FeCl3:
加入NaOH溶液充分反应后过滤
FeCl2:
先加入H2O2将Fe2+氧化成Fe3+,再加入CuO充分反应
后过滤
选CFeCl3溶液中存在水解平衡:
FeCl3+3H2OFe(OH)3+3HCl,加入Mg与
H+反应,平衡右移,使Fe3+转化成Fe(OH)3而除去,A正确;
加入过量铁粉,FeCl3与Fe反应生成FeCl2而达到除杂的目的,B正确;
C项中加入NaOH溶液,Cu2+、Fe3+均转化成氢氧化
物沉淀,不符合除杂要求,错误;
先用H2O2将Fe2氧化成Fe「,再利用FeCb的水解,加入
CuO与H+反应将Fe3+转化成Fe(OH)3而除去,D正确。
5.(2017黄冈模拟)一种新型高效净水剂PAFC(聚合氯化铁铝[AIFe(OH)nCl6-n]m),广泛用于日常生活用水和工业污水的处理。
某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原
料制取PAFC,设计生产流程如下:
请回答下列问题:
⑴用10mol•L1的浓盐酸配制2mol的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还
有
A.容量瓶B.烧杯
C.烧瓶D.胶头滴管
⑵下列关于PAFC的说法中正确的是。
A.PAFC是一种有机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH「,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
⑶步骤n中取样分析的目的是。
A.测定溶液中Fe»
与Fe3*的含量比
B.测定原料是否完全溶解
C•测定溶液中Fe2+的含量,以确定加入NaCIO3的量D.测定溶液中Al3+的含量
⑷写出向溶液中加入NaCIO3时,发生反应的离子方程式