福建省福州市届高三高考模拟化学试题含答案Word格式文档下载.docx
《福建省福州市届高三高考模拟化学试题含答案Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《福建省福州市届高三高考模拟化学试题含答案Word格式文档下载.docx(11页珍藏版)》请在冰豆网上搜索。
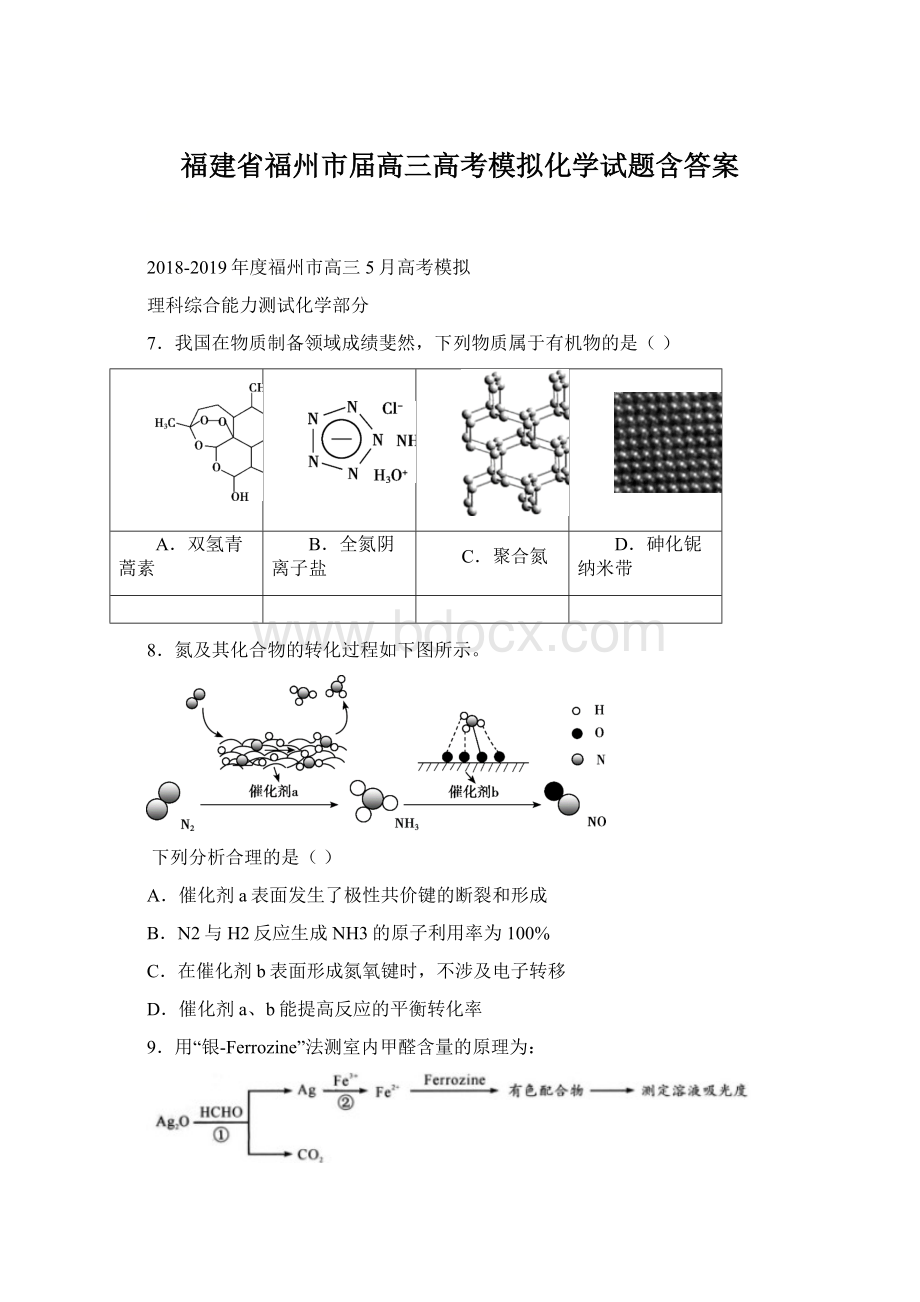
①
②
③
④
A.用装置①制备SO2B.用装置②检验和收集SO2
C.用装置③稀释反应后溶液D.用装置④测定反应后溶液中c(H+)
11.我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如下图所示:
下列说法不正确的是()
A.异戊二烯所有碳原子可能共平面
B.可用溴水鉴别M和对二甲苯
C.对二甲苯的一氯代物有2种
D.M具有芳香族同分异构体
12.如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是()
A.阳极的电极反应式为:
NO-3e-+2H2O=NO2-+4H+
B.物质B与物质C是同一种物质
C.A物质可为氨气
D.阴、阳两极转移的电子数之比为5∶3
13.短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成的一种化合物M具有如下性质:
下列推断正确的是()
A.原子半径:
Z>
Y>
X>
W
B.最高价氧化物对应的水化物酸性:
X
C.W、Y、Z组成的化合物只含共价键
D.W分别与X、Y、Z组成的二元化合物都易溶于水
26.(14分)
Ⅰ.含CN-电镀废水的一种方法如下图(CN-和CNO-中N的化合价均为-3价)
含CN-的废水
含CNO-的废水
N2、CO2、Cl2
某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。
操作步骤:
ⅰ.先关闭装置甲的活塞,再将含CN-废水与过量NaClO溶液混合,取200mL混合液[其中c(CN-)相当于0.200mol·
L-1]加入装置甲中。
ⅱ.待装置甲中充分反应后,打开活塞,使溶液全部流入装置乙中,关闭活塞。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)装置甲玻璃仪器名称为;
装置乙中反应的离子方程式为 。
(2)装置丙中的试剂是 ,装置丁的作用是 。
(3)假定上述实验中的气体都被充分吸收。
若干燥管Ⅰ增重1.408g。
则CN-被处理的百分率为 。
(4)你认为用此装置进行实验,CN-实际被处理的百分率与(3)中比较会 (填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由 。
Ⅱ.防治空气污染,燃煤脱硫很重要。
目前,科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:
A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:
B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:
C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是 (填方案编号)。
27.(14分)硼氢化钠(NaBH4)是有机合成中常用的还原剂。
一种制备硼氢化钠工艺如下(部分条件和产物省略):
已知:
MgH2、NaBH4遇水蒸气剧烈反应并放出H2。
回答下列问题:
(1)Mg2B2O5•H2O中B的化合价为_______________。
MgH2和NaBO2必须在干燥条件下合成硼氢化钠,其原因是_____________________________________________。
(2)难溶的Mg2B2O5与浓氢氧化钠溶液反应的离子方程式为______________________。
(3)SOCl2溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧时加入SOCl2的目的是____________________________________________。
(4)已知镁-H2O2酸性燃料电池反应为Mg+H2O2+H2SO4
MgSO4+2H2O。
常温下,电解质溶液为200mL0.1mol·
L-1硫酸溶液。
①写出正极的电极反应式:
______________________________。
②若电路中有0.038mol电子转移时,则溶液pH约为________(忽略体积变化,不考虑H2O2电离)。
(5)“有效氢”是衡量含氢还原剂的还原能力指标,定义为1g含氢还原剂的还原能力与多少克H2相当。
NaBH4的“有效氢”等于_________________(结果保留2位小数)。
(6)工业上,可以利用NaBO2、HCHO和生石灰在加热下生成NaBH4和难溶的盐,写出化学方程式_______________________________________________。
28.(15分)将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ
克劳斯法
Ⅱ
铁盐氧化法
Ⅲ
光分解法
①反应Ⅰ的化学方程式是。
②反应Ⅱ:
+1H2S=
Fe2++S↓+(将反应方程式补充完整)。
③反应Ⅲ体现了H2S的稳定性弱于H2O。
结合原子结构解释二者稳定性差异的原因:
。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。
我国科研人员设想将两个反应耦合,
实现由H2S高效产生S和H2,电子转移过程如下图。
过程甲、乙中,氧化剂分别是___________。
(3)按照设计,科研人员研究如下。
①首先研究过程乙是否可行,装置如右图。
经检验,n极区产生了Fe3+,p极产生了H2。
n极区产生Fe3+的可能原因:
ⅰ.Fe2+-e-=Fe3+
ⅱ.2H2O-4e-=O2+4H+,________________________(写离子方程式)。
经确认,ⅰ是产生Fe3+的原因。
过程乙可行。
②光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。
研究S产生的原因,设计如下实验方案:
___________________________________。
经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。
过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如下图。
进一步研究发现,除了Fe3+/Fe2+外,I3-/I-也能实现上图所示循环过程。
结合化学用语,说明I3-/I-能够使S源源不断产生的原因:
_________________________________________。
35.【化学——选修3:
物质结构与性质】
(15分)
氮是极其重要的化学元素。
我国科学家最近成功合成了超高含能材料聚合氮和金属氮。
基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。
已知氧的第一电离能为1369kJ·
mol-1、第二电离能为3512kJ·
mol-1、第三电离能为5495kJ·
mol-1,其第二电离能增幅较大的原因是_________________________________________________________________。
(4)某含氨配合物CrCl3·
6NH3的化学键类型有配位键、极性共价键和___________。
CrCl3·
6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、___________、[Cr(NH)4Cl2]Cl·
2NH3。
(5)NH4N3是高能量度材料,其晶胞如下图所示。
N3-是直线型结构,N3-中氮原子的杂化类型是___________。
在VSEPR模型中NH4+的几何构型名称为______________。
(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为_________________g·
cm-3。
36.【化学——选修5:
有机化学基础】
某药物H的一种合成路线如下:
(1)C的名称是______________。
(2)F→H的反应类型为______________。
B→C的试剂和条件是_____________。
(3)H有多种同分异构体,在下列哪种仪器中可以显示物质中化学键和官能团类型______(填字母)。
A.质谱仪B.元素分析仪C.红外光谱仪D.核磁共振氢谱仪
(4)写出D→E的化学方程式___________。
(5)在E的同分异构体中,同时满足下列条件的是_____________________(结构简式)。
①既能发生银镜反应,又能发生水解反应;
②属于芳香族化合物;
③苯环上只有2个取代基;
④核磁共振氢谱有六组峰,且峰面积之比为3:
3:
2:
1:
1。
(6)参照上述流程,以D和乙醛为原料合成
(其他无机试剂自选),设计合成路线:
____________________________________________________________。
参考答案
7.A8.B9.D10.C11.D12.C13.B
26.(14分):
(1)分液漏斗(1分)2CNO-+6ClO-+8H+
N2↑+2CO2↑+3Cl2↑+4H2O(2分)
(2)浓硫酸(1分) 吸收混合气中的Cl2(2分)
(3)80.0%(2分)
(4)偏高(2分) 部分Cl2在装置丁中没有被吸收而在干燥管Ⅰ中被吸收(2分)
(或“偏低-部分CO2残留在装置内没有在干燥管Ⅰ中被完全吸收”或“无法确定-部分Cl2在干燥管Ⅰ中被吸收,部分CO2没有在干燥管Ⅰ中被吸收”等合理答案均给分)
(5)方案①(2分)
27.(14分)
(1)+3(1分)MgH2、NaBH4会与水蒸气反应(1分)
(
2)Mg2B2O5+H2O+2OH-=2Mg(OH)2+2BO2-(2分)
(3)提供HCl抑制MgCl2水解(2分)
(4)①H2O2+2e-+2H+=2H2O(2分)②2(2分)
(5)0.21(2分)
(6)NaBO2+2HCHO+2CaO=NaBH4+2CaCO3(2分)
28.(15分)
(1)①
(2分)
②
③O与S位于同主族,原子半径S>
O,得电子能力S<
O,非金属性S<
O,氢化物稳定性H2S<
H2O(2分)
(2)
、
(3)①
②将
溶液换成
溶液(2分)
(4)
在电极上放电:
。
在溶液中氧化
:
和
循环反应。
(3分)
35.【物质结构与性质——选修3】
Ⅰ.
(1)7(1分)球形(1分)ns2np5(1分)
(2)Be(OH)2+2OH-=BeO22-+2H2O(2分)3(2分)sp2(1分)
(3)从左到右,随着核电荷数增加,原子半径逐渐减小,原子核对外层价电子的吸引能力逐渐增大,故元素的第一电离能从左到右逐渐增大(2分)
II.(4)B(1分)
(5)AlCl3是分子晶体,NaCl是离子晶体(2分)
(6)
36.【有机化学基础——选修5】
(1)氧化反应(1分)
(3)2(1分)
(5)碳碳双键、羧基(多写苯基或苯环不扣分)(2分)
(每个结构简式1分,共2分)
(7)
(5分)