一种新型酸性乙醇电池用磺酸类质子作溶剂Word文档格式.docx
《一种新型酸性乙醇电池用磺酸类质子作溶剂Word文档格式.docx》由会员分享,可在线阅读,更多相关《一种新型酸性乙醇电池用磺酸类质子作溶剂Word文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
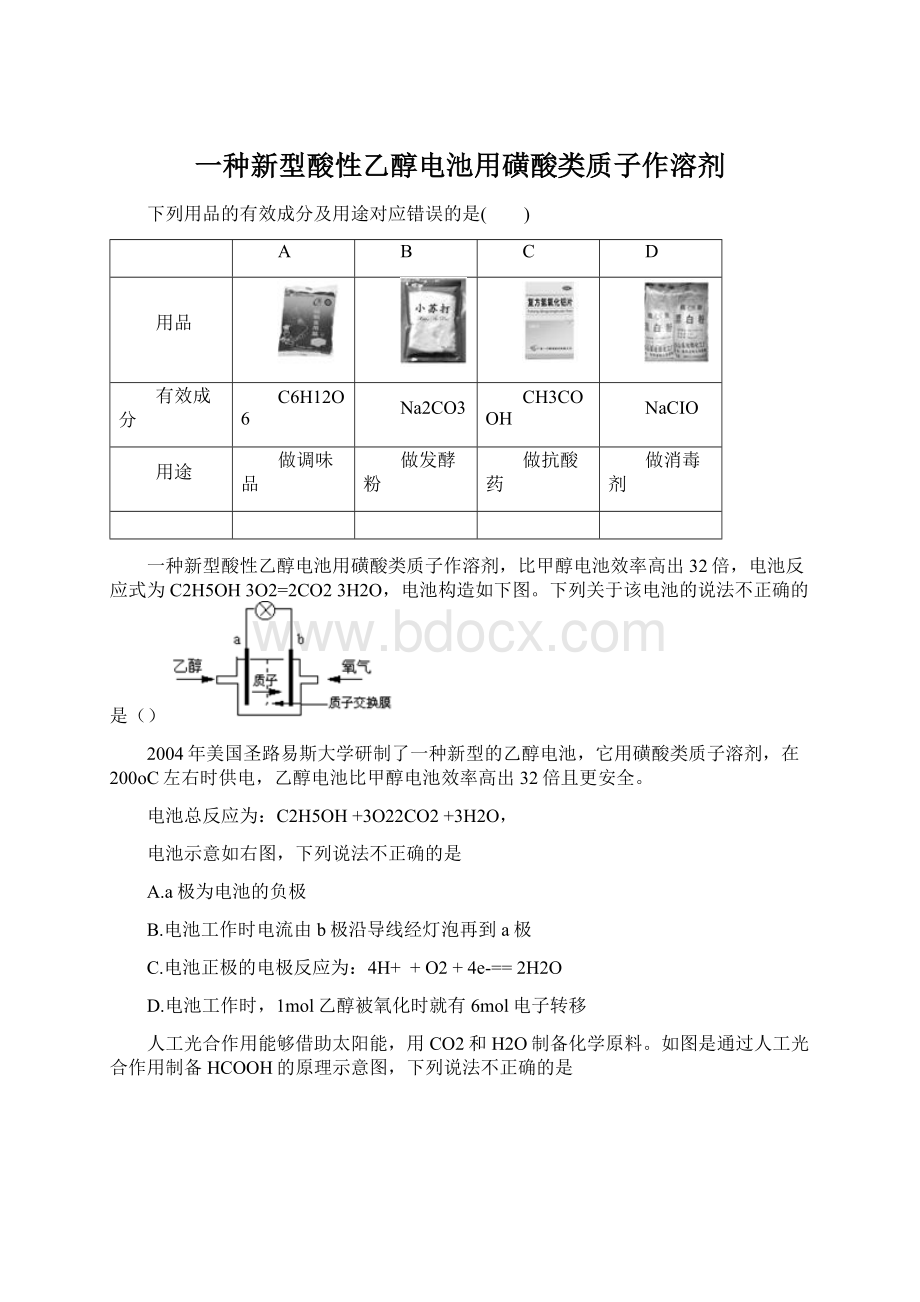
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:
4H+
+
O2
+
4e-==
2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。
如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
(
)
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2+2H++2e-====HCOOH
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。
其反应原理如下:
电池:
Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:
2Al+3H2OAl2O3+3H2↑电解过程中,以下判断正确的是:
电池
电解池
H+移向Pb电极
每消耗3molPb
生成2molAl2O3
正极:
PbO2+4H++2e—=Pb2++2H2O
阳极:
2Al+3H2O-6e—=Al2O3+6H+
下列有关电化学装置完全正确的是
∙热激活电池可用作火箭、导弹的工作电源。
一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。
该电池总反应为:
PbSO4+2LiCl+Ca=====CaCl2+Li2SO4+Pb。
下列有关说法正确的是
A.
正极反应式:
Ca+2Cl--2e-
=====
CaCl2
B.放电过程中,Li+向负极移动
C.
没转移0.1mol电子,理论上生成20.7Pb
D.
常温时,在正负极间接上电流表或检流计,
指针不偏转
A.正极反应式:
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7gPb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
镁燃料电池作为一种高能化学电源,具有良好的应用前景。
下图是镁—空气燃料电池工作原理示意图。
下列有关该电池的说法正确的是(
)
A.该电池Mg作负极,发生还原反应
B.该电池的正极反应式为:
O2+2H2O+4e-=4OH-
C.电池工作时,电子通过导线由碳电极流向Mg电极
D.当电路中通过0.2mol电子时,消耗的O2体积为1.12L
某种聚合物锂离子电池放电时的反应为Lil-xCoO2+LixC6=6C+LiCoO2,其电池如图所示。
下列说法不正确的是
A.放电时,LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C.充电时,将电池的负极与外接电源的负极相连
D.放电时,电池的正极反应为Lil-xCoO2+xLi++xe-=LiCoO2
某新型二次锂离子电池结构如右图,电池内部是固体电解质,充电、放电时允许Li+在其间通过(图中电池内部“→”表示放电时Li+的迁移方向.充电、放电时总反应可表示为:
LiCoO2+6C
放电
充电
Li1-xCOO2+LixC6.下列说法正确的是( )
A.外电路上的“→”表示放电时的电流方向
B.充电时发生还原反应的物质是LixC6
C.放电时负极的电极反应为:
LiCoO2-xe-=Li1-xCOO2+xLi+
D.外电路有0.1mole-通过,发生迁移的Li+的质量为0.7x
g
用如图所示装置进行实验,下列叙述不正确的是
A.K与N连接时,铁被腐蚀
B.K与N连接时,石墨电极产生气泡
C.K与M连接时,一段时间后溶液的pH增大
D.K与M连接时,石墨电极反应:
4OH--4e-=2H2O+O2↑
某兴趣小组设计如图所示的微型实验装置。
实验时,先断开K2,闭合K1,两极均有气泡产生;
一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
A.断开K2,闭合K1时,总反应的离子方程式为:
2H++2Cl-
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:
Cl2+2e-=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
16据报道,我国拥有完全自主产权的氢氧燃料电池车将在奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液.下列有关电池的叙述不正确的是( )
A.正极反应式为:
O2+2H2O+4e-═4OH-
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:
2H2+O2═2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
答案(找作业答案--->
>
上魔方格)
A.通入氢气的一极为电池的负极,发生氧化反应,电极反应式为2H2-4e-+4OH-=4H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故A正确;
B.工作一段时间后,电池中生成水,溶液体积增大,电解液中KOH的物质的量浓度减小,依据电极反应可知,物质的量不变,故B正确;
C.正极反应为O2+2H2O+4e-=4OH-,负极反应为H2-2e-+2OH-=2H2O,则总反应式为:
2H2+O2=2H2O,故C正确;
D.n(Cl2)=0.01mol,根据化合价可知转移电子0.2mol,故D错误;
故选D.
17.
观察下列几个装置示意图,有关叙述正确的是()
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的x电极是外接电源的正极
观察下列几个装置示意图,有关叙述正确的是(
18.
19.用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下左图所示。
下列说法中,正确的是
A.若a极是铜,b极为铁时,当电池消耗1.6gO2,b极上析出6.4g铜#N7a2d2X+_
B.燃料电池工作时,正极反应为:
O2+2H2O+4e-=4OH-'
_'
W'
V3F;
_*Y'
P
C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量。
2K(H5N3E/F"
_
D.若a、b两极均是石墨时,b极反应为4OH--4e-=O2↑+2H2O6@;
W(X.O.P$Q
011年7月19日,美国能源部西北太平洋国家实验室的科学家和来自中国武汉大学访问学者组成的研究小组合作开发钠离子充电电池,研究人员采用廉价的钠离子同时使用纳米氧化锰和锂材料作电极制作出了钠离子充电电池,其工作示意图如下。
关于该电池说法中正确的是
[
]
A.放电时A极作正极
B.放电时Na+向负极移动
C.充电时是将化学能转化为电能
D.充电时阳极反应为:
Li-e-=Li+
21.1)一种新型锂电池是将化学式为Li4Ti5O12的物质作为电池的正极材料,在放电的过程中变为化学式为Li4Ti5O12的物质。
①Li4Ti5O12中Ti元素的化合价为
,锂电池的突出优点是
。
②该锂电池是一种二次电池,放电时的负极反应式为
,充电时的阳极反应式为
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:
在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·
xH2O的化学方程式为
②滴定终点的现象是
③滴定分析时,称取TiO2试样0.2g,消耗0.1mol·
L-1NH4Fe(SO4)2栎准溶液20ml.则TiO2的质量分数为____
④若在滴定终点,读取滴定管刻度时,俯视标准溶液的液面,使其测定结果
(填“偏大”、“偏小”或“无影响”)o
(3)已知:
则TiCl4(I)+4Na(l)=Ti(s)+4NaCl(s)的△H=
KJ·
mol-1。
答案
(1)①+4(1分)体积小、比能量高、携带方便。
(1分)
②Li-e-=Li+(1分)Li7Ti5O12-3e-=Li4Ti5O12+3Li+(2分)
(2)①TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl(2分)②溶液变成红色(1分)
③80%(2分)④偏小(1分)
(3)-970.2(2分)
解析
(1)①根据化合物化合价代数和等于零,锂为+1价,氧为-2价,则钛为+4价;
②放电发生原电池反应,负极Li-e-=Li+;
充电发生电解池反应,阳极与外接电源的正极相连失去电子,发生氧化反应,Li7Ti5O12-3e-=Li4Ti5O12+3Li+;
(2)①TiCl4水解生成TiO2•xH2O,根据TiO2的化学式,应有2mol水参与反应,故方程式为TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl。
③n(NH4Fe(SO4)2)=0.1mol/Lⅹ0.02L=0.002mol,此反应是氧化还原反应,根据电子得失守恒,n(NH4Fe(SO4)2)=n(TiO2),m(TiO2)=0.002molⅹ80g·
mol-1,0.002ⅹ80/0.2=0.80。
④滴定终点,俯视读数,读出的数值偏大,则体积差值偏小,故测定结果偏低。
(3)根据盖斯定律,把题中的方程式组合就可得到结果。
TiCl4(l)=Ti(s)+2Cl2(g),ΔH=804.2KJ·
mol-
4Na(s)+2Cl2(g)="
4NaCl(s)"
ΔH=-2ⅹ882.0KJ·
4Na(l)="
4Na(s)"
ΔH=-4ⅹ2.6KJ·
以上三个相加,就得到△H=-970.2KJ·
22.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。
若用左图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。
已知两极材料分别为石墨和铁:
(1)a极材料为
,电极反应式为
(2)电解液d可以是
,则白色沉淀在电极上生成;
电解液d也可
以是
,则白色沉淀在两极间的溶液中生成。
A.纯水
B.NaCl溶液
C.NaOH溶液
D.CuCl2溶液
(3)液体c为苯,其作用是
,在加苯之前对d溶液
进行加热煮沸处理,目的是
(4)为了在短时间内看到白色沉淀,可以采取的措施是
A.改用H2SO4作电解液
B.适当增大电源电压
C.适当缩小两极间距离D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为
答案
(1)Fe,Fe-2e=Fe2+
(2)C,B
(3)隔绝空气,防止生成的Fe(OH)2被空气氧化;
排净溶液中溶解的氧气,防止生成的Fe(OH)2在溶液中被氧化
(4)B、C
(5)白色沉淀迅速变为灰绿色,最后变为红褐色
解析试题分析:
Fe(OH)2是借助反应Fe2++2OH-=Fe(OH)2↓生成的,所以
(1)只有以Fe作为阳极,才能通过电极反应Fe-2e-=Fe2+提供Fe2+,a电极和电源的正极相连,所以a电极材料应该是Fe。
(2)OH-应该由电解质溶液提供或通过电解生成,C选项中的NaOH溶液符合要求;
A中导电性差,一般不用;
B选项,a极发生反应:
Fe-2e-=Fe2+,b极发生反应:
2H++2e-=H2↑,溶液中c(OH-)增大,符合题意。
(3)苯的密度小于水的,在上层,隔绝空气,防止生成的Fe(OH)2被空气氧化;
排净溶液中溶解的氧气,防止生成的Fe(OH)2在溶液中被氧化。
(4)为了在短时间内看到白色沉淀,就必须加快反应的进行,所以可以采取的措施是适当增大电源电压或适当缩小两极间距离,即答案选BC。
(5)当电解一段时间,看到白色沉淀后,再反接电源继续电解,则此时阳极不再是铁,而是溶液中的OH-放电生成氧气,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色。
考点:
考查氢氧化亚铁制备实验的有关判断
点评:
该题是高考中的常见题型,属于中等难度的试题。
试题综合性强,侧重对学生实验能力和解题方法的指导与训练,有利于培养学生规范、严谨的实验设计、操作能力,提高学生的应试能力,提升学生的学科素养。