高考化学复习总结氧族元素原子结构和元素性质解析Word格式.docx
《高考化学复习总结氧族元素原子结构和元素性质解析Word格式.docx》由会员分享,可在线阅读,更多相关《高考化学复习总结氧族元素原子结构和元素性质解析Word格式.docx(8页珍藏版)》请在冰豆网上搜索。
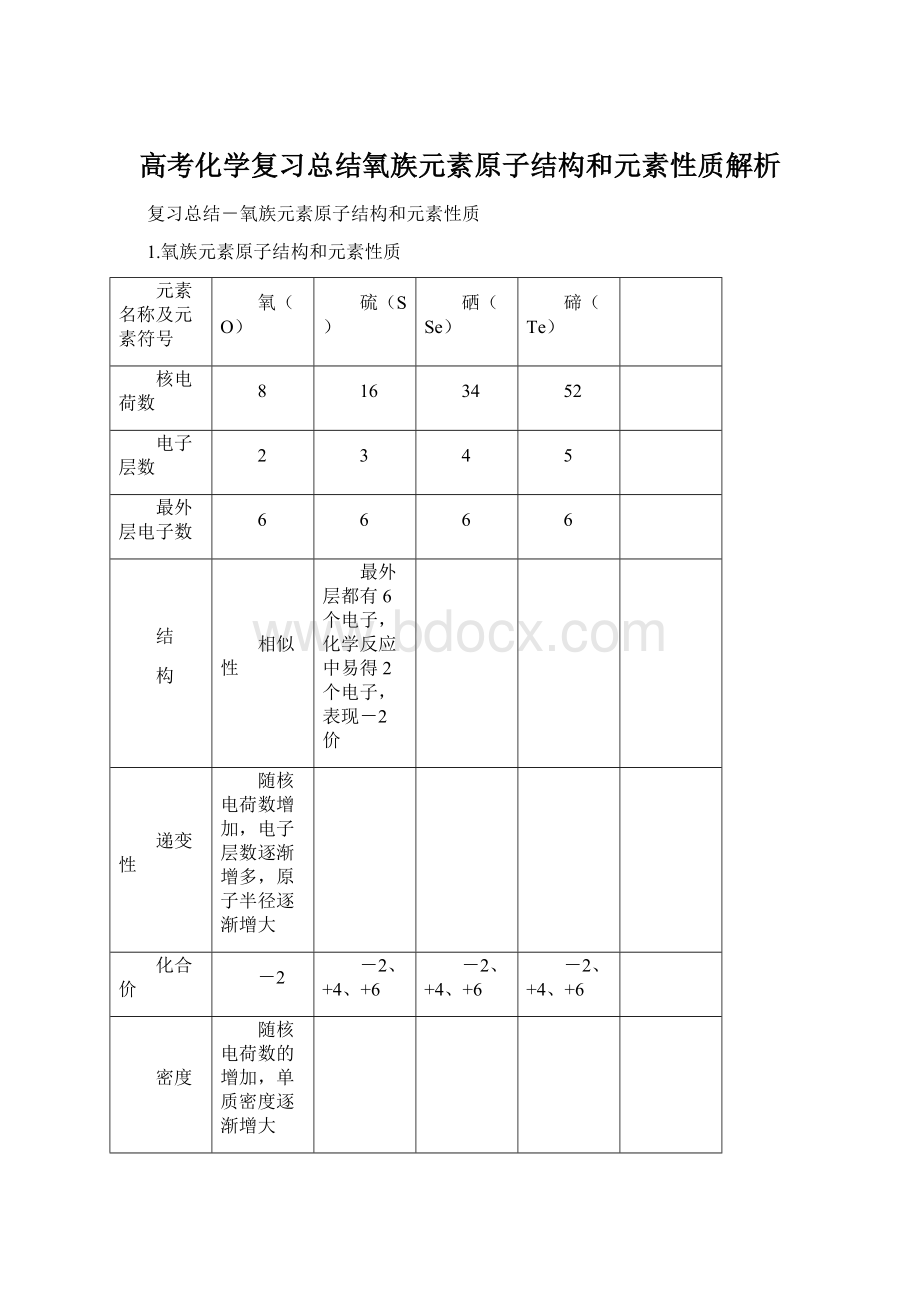
构
相似性
最外层都有6个电子,化学反应中易得2个电子,表现-2价
递变性
随核电荷数增加,电子层数逐渐增多,原子半径逐渐增大
化合价
-2
-2、+4、+6
密度
随核电荷数的增加,单质密度逐渐增大
熔沸点
随核电荷数的增加,单质熔沸点逐渐升高
与H2化合难易
点燃剧烈化合
加热时化合
较高温时化合
不直接化合
氢化物稳定性
随核电荷数的增加,气态氢化物稳定性逐渐减弱
氧化物化学式
——
SO2、SO3
SeO2、SeO3
TeO2、TeO3
氧化物对应水化物化学式
H2SO3、H2SO4
H2SeO3、H2SeO4
H2TeO3、H2TeO4
最高价氧化物水化物酸性
随核电荷数增加,最高价态氧化物的酸性逐渐减弱(O除外)
元素的非金属性
随核电荷数增加,元素非金属性逐渐减弱
2.价态与氧化性、还原性的规律
-20+4+6
H2S及-2价硫化物中,硫的价态最低,硫元素只具还原性,浓硫酸中,硫的价态最高,硫元素只具氧化性,而单质硫、二氧化硫、亚硫酸、亚硫酸盐中的硫处于中间价态,既具有氧化性,又具有还原性。
3.H2S和S2-有较强的还原性,应掌握以下规律:
S2-I-Br-Cl-F-
SI2Br2Cl2O2F2
[说明]O2、Cl2因条件不同,位置可能有变化。
[举例]如H2S+I2====S↓+2HI2H2O+2F2====O2+4HF
显然,上述关系式中,S2-应具较强的还原性,易被氧化。
氧化剂:
HNO3、浓H2SO4
KMnO4、O2、Cl2、Br2、I2等
S2-S↓
[说明]S2-被氧化时,常产生单质硫的浅黄色沉淀,这是实验中的重要现象,依此可推断。
4.掌握下列物质的性质及其应用
(1)硫:
氧化性、还原性
(2)硫化氢:
不稳定性、还原性(包括可燃性)
(3)氢硫酸:
不稳定性、弱酸性、还原性(S-2)、氧化性(H+)
(4)二氧化硫:
酸性氧化物的性质、还原性、氧化性、漂白性
(5)亚硫酸:
酸性、不稳定性、氧化性、还原性
(6)浓硫酸:
酸性、难挥发性(高沸点)、稳定性、吸水性、脱水性、强氧化性
+4+4+4
5.二氧化硫、亚硫酸、亚硫酸盐的还原性比较
按SO2H2SO3Na2SO3顺序还原性增强。
H2SO3、Na2SO3通常就可被O2氧化。
因此,保存和使用时要防止被氧化变质。
而SO2则需在催化剂、加热条件下才能转化为SO3。
那么SO2通常可被哪些氧化剂氧化呢?
如溴水、高锰酸钾溶液等。
6.掌握二氧化硫的漂白原理,以及与HClO漂白原理的差异,并对高中阶段出现的具有漂白能力的物质进行归纳总结。
氯水、臭氧、过氧化钠、过氧化氢
二氧化硫
漂白原理
氧化漂白
非氧化漂白
漂白效果
永久性
暂时性
7.掌握SO
的鉴别方法并思考如何检验SO
[引导小结并投影板书]
SO
:
加盐酸酸化后,再加可溶性钡盐
加稀硫酸后,将气体通入品红溶液中
8.对比SO2和CO2的性质,掌握区分两者的方法
如何实现上述转化,写出有关的化学方程式,并思考体现了物质什么样的化学性质。
△
点燃
①S+H2====H2S*②S+Fe====FeS
*③S+2Cu====Cu2S④S+O2SO2
*⑤H2S+Cl2====S↓+2HCl(O2、Br2、I2、浓H2SO4等*⑥H2S+CuSO4====CuS↓+H2SO4
⑦H2S+2NaOH====Na2S+2H2O*⑧FeS+2H+====Fe2++H2S↑(非氧化性酸
*⑨Na2S+2HCl====2NaCl+H2S↑(非氧化性酸⑩Na2S+CuSO4====Na2SO4+CuS↓
催化剂
11SO2+H2O====H2SO312SO2+2NaOH====Na2SO3+H2O
13SO2+2H2SS↓+2H2O*142SO2+O22SO3
15SO3+H2O====H2SO416SO3+2NaOH====Na2SO4+H2O
*172Na2SO3+O2====2Na2SO418H2SO4+BaCl2===BaSO4↓+2HCl
*192H2SO4(浓+Cu====CuSO4+SO2↑+2H2O20Na2SO4+BaCl2====BaSO4↓+2NaCl
*212H2SO3+O2====2H2SO422Na2SO3+H2SO4====Na2SO4+H2O+SO2↑
[强调]注意上述画“*”号的反应
[设疑]
(1)对比14与17、21,说明什么?
(2)反应⑧⑨可加酸为非氧化性酸,如HCl、稀H2SO4,能否加浓H2SO4或HNO3?
(3)反应⑤体现了H2S的什么性质?
(4)对比通常酸和盐的反应,反应⑥有何特点?
(5)反应⑨体现了浓H2SO4什么性质?
(6)反应18、20的离子方程式怎样写?
[回答]
(1)说明SO2转化为亚硫酸、亚硫酸盐之后,还原性增强,更易被氧气氧化。
(2)FeO、Na2S均因含-2价硫而具有还原性
(3)反应⑤体现了H2S的还原性。
(4)反应⑥违背通常强酸制弱酸的规律,比较特殊。
(5)反应19体现了浓H2SO4的强氧化性和酸性。
(6)反应18、20的离子方程式相同:
+Ba2+====BaSO4↓
本章含硫化合物中,SO2、H2S均为有毒气体,是大气污染物,因此实验和使用时应注意安全,注意环保。
三、环境保护
[练习]1.下列关于硒的叙述,错误的是()
A.硒化氢有毒,有恶臭,比H2S更易分解
B.H2SeO3是弱酸
C.硒在空气中燃烧生成SeO2
D.H2Se气体的水溶液不具酸性
解析:
据氧族元素化学性质的相似性和递变规律来分析,Se和S同族又相邻,对比硫化氢、亚硫酸、氢硫酸及硫和氧气的反应,即可找出答案。
答案:
D
2.下列物质不能由单质直接化合得到的物质是(
A.CuSB.FeSC.H2SD.SO3
此题考查单质硫的化学性质。
硫的化学性质同O2相似,能跟大多数金属化合表现氧化性,但其氧化性较O2弱,与Cu、Fe等变价金属反应时得到的是低价态金属硫化物。
硫可被氧气氧化,直接产物为SO2。
加热时硫可与氢气化合生成硫化氢。
AD
3.在下列物质中,既能跟硫化氢反应又能跟溴水反应的是(
①硫化钠溶液②二氧化硫饱和溶液③硫酸铜溶液④硝酸银溶液
A.②④B.①③C.①②④D.①②③④
①Na2S+H2S====2NaHSNa2S+Br2====2NaBr+S↓
②2H2S+SO2====3S↓+2H2OSO2+Br2+2H2O====H2SO4+2HBr
③CuSO4+H2S====CuS↓+H2SO4CuSO4+Br2≠
④H2S+2AgNO3====Ag2S↓+2HNO3
Br2+H2O+2AgNO3====AgBr↓+AgBrO+2HNO3
C
4.检验某未知溶液中是否含有SO
的下列操作中最合理的是(
A.加入硝酸酸化了的硝酸钡溶液
B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液
D.先加盐酸酸化,再取上层清液加入氯化钡溶液
E.加入盐酸酸化了的氯化钡溶液
检验SO
时,加酸主要是为排除SO
、CO
、Ag+的干扰。
A、B无法排除SO
的干扰。
C的未知液中若含有Ag+,加盐酸酸化时会生成AgCl沉淀。
对SO
的检验造成影响。
E无法排除Ag+的干扰。
5.将浓硫酸慢慢注入浓盐酸中,产生的现象是(
A.放出黄绿色气体B.冒白雾,混合物温度升高
C.液体四溅D.冒白烟,液体四溅
浓硫酸具强吸水性且吸水放热,浓盐酸具强挥发性,浓硫酸不能氧化盐酸。
因此,实验中会冒白雾且混合液温度升高,但由于是“慢慢注入”,所以不会造成液体四溅。
B
6.下列反应的离子方程式是否正确?
如不正确,请改正。
(1硫化亚铁和稀硫酸反应:
S2-+2H+====H2S↑
(2石灰乳和盐酸反应:
OH-+H+====H2O
(3氢氧化钡溶液和稀硫酸反应:
Ba2++OH-+H++SO
====BaSO4↓+H2O
(4足量的氢氧化钠溶液和碳酸氢钙溶液反应:
OH-+Ca2++HCO
====CaCO3↓+H2O
(5向10%的40g氢氧化钠溶液中通入标准状况下的硫化氢气体2.24L:
2OH-+H2S====S2-+2H2O
(1)不正确,硫化亚铁难溶,应用化学式表示。
(2)不正确,石灰乳应用化学式表示。
(3)不正确,因为1molBa(OH2能电离出2molOH-,1molH2SO4能电离出2molH+,所以该离子方程式中OH-、H+及H2O的计量数应为2。
(4)不正确,1molCa(HCO32可以电离出2molHCO
,可跟2mol的OH-反应,得到2molCO
,其中1molCO
又跟Ca2+结合,生成CaCO3沉淀,另有2mol的H2O生成。
(5)不正确,10%的NaOH溶液40g中含NaOH4g与标准状况下2.24L的H2S反应,应生成0.1mol的水和0.1mol的HS-离子,而不是0.1molS2-离子和0.2molH2O。
以上各离子方程式都不正确,正确的离子方程式应为:
(1FeS+2H+====Fe2++H2S↑
(2Ca(OH2+2H+====Ca2++2H2O
(3Ba2++2OH-+2H++SO
====BaSO4↓+2H2O
(42OH-+Ca2++2HCO
====CaCO3↓+CO
+2H2O
(5OH-+H2S====HS-+H2O