物质结构元素周期律和元素周期表会考复习Word格式文档下载.docx
《物质结构元素周期律和元素周期表会考复习Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《物质结构元素周期律和元素周期表会考复习Word格式文档下载.docx(20页珍藏版)》请在冰豆网上搜索。
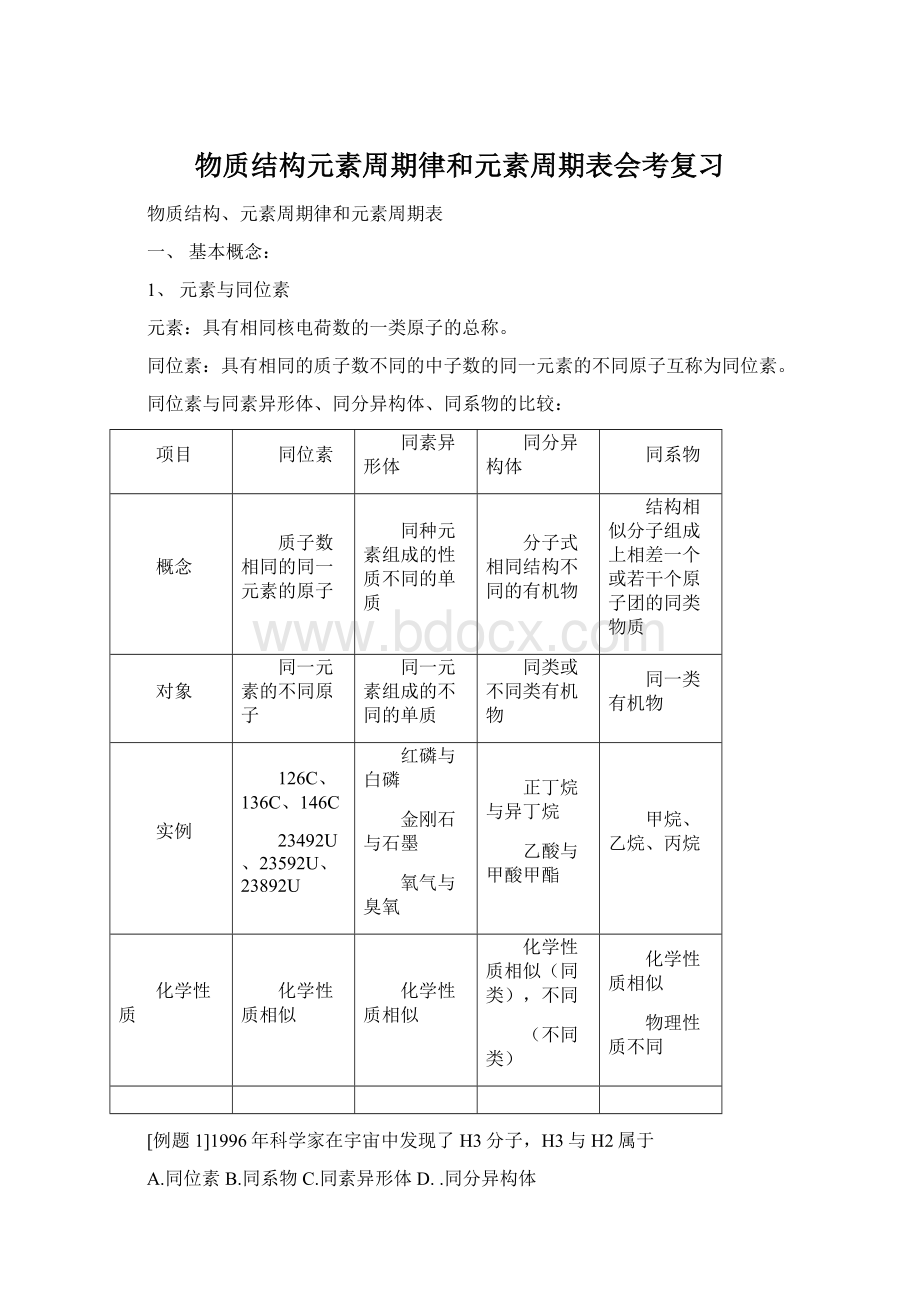
36.966
24.23%
37
平均
35.453
35.485
试回答下列问题:
(1)34.969表示;
(2)35.453表示;
(3)35表示;
(4)35.485表示;
(5)24.23%表示。
3、电子云与电子层
电子云:
电子在核外空间作高速运动,没有确定的轨迹,好像带负电荷的云雾笼罩在原子核周围。
是一种形象描述,不是真实存在。
电子云密度大的地方,电子出现的机会就多。
电子层:
人们把核外电子运动不同的区域看成不同的电子层,并用n=1,2,3,4,5,6,7(或K,L,M,N,O,P,Q)分别表示从内到外的电子层。
n值越大,说明电子离核越远。
4、化学键、离子键和共价键
化学键:
《高一课本》P143倒数第5行。
主要类型有离子键和共价键。
离子键:
《高一课本》P144倒数第3行。
共价键:
《高一课本》P147第1行。
5、极性键和非极性键(了解)
极性键:
《高一课本》P147第4—6行。
非极性键:
6、周期律、周期表、周期、族
元素周期律:
元素的性质随着原子序数的递增而呈周期性变化的规律。
元素性质呈周期性变化的实质是由于元素原子核外电子排布的周期性变化。
周期表:
是元素周期律的具体体现。
周期:
7个周期。
1、2、3为短周期,4、5、6为长周期,第7周期为不完全周期。
族:
16个族。
其中7个主族(ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA),7个副族,1个Ⅷ族(第8、9、10三个纵行),1个0族(稀有气体)。
[例题3*]下列有关推断中不符合实际的是
A.第n周期中有2n2种元素
B.第n周期第n族(n>
1)的元素一定是金属元素
C.第n周期有(8—n)种非金属元素(n>
1,包括稀有气体元素)D.第n周期第n族的元素可能是非金属元素
二、基本关系
1、构成原子的微粒间的关系:
看《高一课本》P119倒数第6行
原子序数=核电荷数=质子数=核外电子数
质量数(A)=质子数(Z)+中子数(N)
阴离子Rn-:
Z=核外电子总数—n;
阳离子Rm+:
Z=核外电子总数+m。
[例题4]最近医学界通过放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病。
下列关于14C的叙述正确的是
A.14C与14N含有相同的中子数B.14C与C60是同分异构体
C.14C与C60中碳原子的化学性质不同D.14C与12C互为同位素
2、电子层与所能容纳的电子数的关系:
见《高一课本》P127第3行—第13行
3、原子半径与原子结构的关系:
原子半径大小决定于原子的电子层数、核电荷数和电子层结构。
一般:
电子层数越多的原子半径大;
电子层数相同的原子,核电荷数越大,则原子半径越小。
若原子失去电子变为阳离子,则原子半径减小;
原子得到电子变为阴离子,则原子半径增大。
4、元素周期表与原子结构的关系:
周期序数=电子层数主族序数=最外层电子数=价电子数
[例题5]用A.质子数,B.中子数,C.核电荷数,D.最外层电子数,E.电子层数填写下列空格。
(填序号)
(1)原子种类由决定;
(2)元素种类由决定;
(3)元素有同位素由决定;
(4)同位素原子量由决定;
(5)元素的原子半径由决定;
(6)元素的化合价由决定;
(7)元素的化学性质主要由决定;
(8)价电子数通常是指;
(9)核电荷数由决定。
5、元素性质与元素周期表的关系:
同周期元素,从左到右,核电荷数依次增多,原子半径逐渐减小,元素的金属性逐渐减弱,非金属性逐渐增强。
同主族元素的原子最外层电子数相同,因而化学性质有很大的相似性。
但由上而下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱。
主族元素的最高正价=主族序数
主族元素的负化合价=8—主族序数
元素金属性越强,其最高价氧化物的水化物的碱性越强;
元素非金属性越强,其最高价氧化物的水化物的酸性越强,其气态氢化物的稳定性越强。
三、化学用语
1、结构示意图:
《高一课本》P127
(1)表示原子:
[练习1]用原子结构示意图表示钠原子、氢原子、氩原子、硫原子
、、、
(2)表示离子:
[练习2]用结构示意图表示钠离子、铝离子、硫离子、氟离子
2、电子式:
《高一课本》P144
[练习3]用电子式表示钠原子、氢原子、氩原子、硫原子、氟原子
、、、、
[练习4]用电子式表示钠离子、铝离子、硫离子、氟离子、铁离子
(3)表示物质:
[练习5]用电子式表示氯化钠、硫化钾、氟化钙、水、氨、甲烷、乙炔、乙烯、硫化氢、氮气
、、、、、
(4)表示物质的形成过程:
[练习6]用电子式表示氯化钠、硫化钾、氟化钙、氯化氢、水、硫化氢的形成过程。
、
3、结构式:
《高一课本》P149
[练习7]写出下列物质的结构式:
氯气、硫化氢、氮气、氨气、甲烷、乙炔、乙烯、乙醇、乙酸、乙醛。
、、、、、
四、基本计算
1、有关质量数、质子数、中子数、电子数的计算。
[例题6]元素的阴离子Rn-,核外有x电子,其核内的中子数为m,则R的质量数是。
2、有关元素的相对原子质量和同位素原子百分含量的计算。
[例题7]银有两种同位素,其原子数百分含量各为50%。
已知银的相对原子质量为108,质子数为47,则这两种同位素的原子核内中子数分别是
A.55和57B.57和63C.61和63D.60和62
3、有关物质组成和化合价的计算。
[例题8]X和Y是短周期元素,两者能形成化合物XY4。
已知X的原子序数为m,Y的原子序数为n,则m和n的关系不可能的是
A.m—n=5B.m—n=13C.n—m=8D.n—m=11
五、重难点辅导
1、微粒半径大小判断:
(一般)
(1)原子半径:
a.同周期,从左到右,原子半径由大到小(稀有气体除外)。
b.同主族,从上到下,原子半径由小到大。
c搭桥比较。
如比较S、N的原子半径大小。
(2)、离子半径:
a.金属阳离子半径小于其原子半径:
如rNa+<
rNa
b.非金属阴离子半径大于其原子半径:
如rCl->
rCl
c价离子离子半径小于其低价离子半径:
如rFe>
rFe2+>
rFe3+
d.电子层结构相同的微粒,核电荷数越多半径越小:
如
rO2->
rF->
rNa+>
rMg2+>
rAl3+;
rS2->
rCl->
rK+>
rCa2+
2、判断元素金属性、非金属性强弱的方法:
(1)
①单质与水或非氧化性酸反应置换氢的难易
金属性强弱②单质的还原性(或阳离子的氧化性)
③最高价氧化物的水化物碱性强弱
④互相置换反应
(2)①与氢气化合的难易及氢化物的稳定性
非金属性强弱②最高价氧化物的水化物酸性强弱
③最高价氧化物的水化物酸性强弱
3、掌握周期表的结构
数目:
“三长三短一不全”(前三周期所含元素的名称与符号。
周期
*各周期起止元素的原子序数与名称)
镧系,锕系,超铀元素
周期序数=核外电子层数
族
数目、类别、表示方法、相对位置、各族元素的价电子数
主族序数=最外层电子数
区
金属区(注意交界处的两性元素及LiBeB对角线相似
非金属区MgAlSi规则)
[例题9*]第ⅡA族中的铍在一定条件下可形成化合物Na2BeO2。
下列有关铍及其化合物的序述错误的是(2001年广州一摸)
A.单质铍可溶于氢氧化钠溶液生成氢气
.B.Na2BeO2溶液显碱性
C.氢氧化铍易溶于水
D.氧化铍能溶于氢氧化钠溶液
4、正确理解同周期或同主族元素性质的递变规律
核电荷数变化电子层数
变化的实质
或电子层结构变化最外层电子数
单质与水或酸反应置换出H2的难易
原子半径金属性
最高价氧化物的水化物碱性强弱
元素的性质核对外层电子的引力单质的还原性强弱
主要化合价离子的氧化性强弱
与H2化合难易及氢化物的稳定性
非金属性最高价氧化物的水化物酸性强弱单质的氧化性强弱
简单离子的还原性强弱
4、周期表中的递变规律:
若A、B、C、三元素位于周期表中如下图所示位置,则有关的各种性质均可排出顺序(但A、D不能)AB
原子半径:
C>
A>
B
(2)金属性C>
B
(3)非金属性B>
CD
5、理解构位性的关系
6、判断元素在周期表中的位置的方法
(1)周期序数=电子层数
主族序数=最外层电子数=元素的最高正价
(2)依据元素最高正价与最低负价代数和。
如:
代数和为零时在ⅣA族(如C、Si)。
(3)以零族为基准给元素定位:
稀有气体元素HeNeArKrXeRn
周期序数一二三四五六
原子序数21018365486
推断33号元素,因其原子序数在18<
33<
36范围内故位于第四周期ⅤA族(As)
[例题10]*有报道说,物理学家根据原子核结构的理论计算,认为最后可能出现原子序数为175(另有一说为150)的元素,若人类发现了原子序数为145的元素,依现知元素周期表,应把它排在周期表中的周期族。
7、据某些特性推断元素
(1)据周期表中的特殊位置。
在短周期元素中,用元素符号填空:
族序数等于周期数的元素有、、,族序数等于周期数2倍的元素有、,族序数等于周期数3倍的元素有;
周期数是族序数2倍的元素有,周期数是族序数3倍的元素有;
最高正价与最低负价代数和为零的元素有、;
除H外,原子半径最小的元素是;
离子半径最大的元素是;
最高正价不等于族序数的元素有、。
(2)据元素性质、存在、用途的特殊性。
a.形成化合物种类最多的元素是。
(或单质是自然界中硬度最大的元素或气态氢化物中氢的含量最大的元素)
b.空气中含量最多的元素。
(或气态氢化物的水溶液显碱性的元素)
c.地壳中含量最多的元素。
(或气态氢化物的沸点最高的元素或氢化物在通常情况下呈液态的元素)
d.地壳中含量最多的金属元素。
(或含该元素的物质进入人体会使人老化)
e.最活泼的非金属元素。
(或无含氧酸的非金属元素或气态氢化物可腐蚀玻璃的元素或气态氢化物最稳定的元素)
f.最活泼的金属元素。
(或最高价氧化物的水化物的碱性最强的元素)
g.最易着火的非金属单质,其元素是。
h.焰色反应显黄色的是。
i.焰色反应显紫色(透过蓝色钴玻璃)的是。
j.最轻单质的元素是,最轻金属元素是。
k.常温下呈液态的单质,非金属元素是,非金属单质。
l..最高价氧化物及其水化物既能与强酸反应又能与强碱反应的元素有、。
m.元素的气态氢化物能和它的氧化物起化合反应的是。
n.能形成酸性最强的含氧酸的元素是。
8、晶体类型及性质比较
晶体类型
离子晶体
原子晶体
分子晶体
组成晶体的微粒
阴、阳离子
原子
分子
微粒间的相互作用
离子键
共价键
范德化力
典型实例
NaCl
金刚石、硅、SiO2
冰(H2O)
干冰(CO2)
熔、沸点,硬度
较高,较硬
高,高硬度
低,硬度较小
比较晶体的硬度大小、熔、沸点高低等物性:
(1)原子晶体
异类晶体离子晶体分别大于或高于分子晶体
金属晶体
(2)原子晶体共价键键能键长原子半径
同类晶体分子晶体分子间作用力分子量(组成结构相似)
离子晶体离子键强弱离子半径、离子电荷
[练习]
一、选择题(可能有1—2个答案)
1、据报道,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数为272。
该元素的原子序数为
A.433B.272C.161D.111
2、电子数相等的微粒叫等电子体,下列各微粒属等电子体的是
A.N2O4和NO2B.CH4和NH3C.CO2和NO2D.NO和O2
3、两种微粒的核外电子数相同,核电荷数不同,则它们可能是
A.两种不同的原子B.两种不同的离子
C.同一元素的原子和离子D.不同元素的原子和离子
4、13153I是人工合成的,常用于医疗上放射性诊断。
下列有关说法正确的是
A.13153I核内的中子数比质子数多25个
B.13153I和12753I都是自然界中稳定存在的碘元素的同位素
C.13153I2和12753I2互为同素异形体D.13153I2可用于治疗甲状腺肿大
5、俄罗斯科学家最近合成出第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义。
该原子的中子数与电子数之差是A.61B.114C.175D.289
6、A元素原子L层比B元素原子L层少3个电子,B元素原子核外电子总数比A元素原子核外电子总数多5个,则A、B两元素形成的化合物可表示为A.A3B2B.B3A2C.BA3D.BA2
7、X、Y、Z为短周期元素,这些元素原子的最外层电子数分别是1、4、6,则由这三种元素组成的化合物的化学式不可能是
A.XYZB.X2YZC.X2YZ3D.X2YZ2
8、下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.SO2和SiO2B.CO2和H2OC.NaCl和HClD.CCl4和KCl
19、既有离子键又有共价键的化合物是
A.Na2OB.NaOHC.CaBr2D.HF
10、下列关于化学键的说法正确的是
A.构成分子晶体的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里的化学键一定是极性键
11、下列叙述错误的是
A.含有离子键的晶体一定离子晶体
B.溶于水可以导电的晶体一定是离子晶体
C.Na2O和SiO2的晶体中都不存在单个小分子
D.冰醋酸晶体与冰熔化是所克服的微粒间的作用力属相同类型
12、下列晶体,其中任何一个原子都被相邻的四个原子包围,以共价键形成正四面体结构,并向空间伸展形成网状结构的是
A.甲烷B.石墨C.晶体硅D.水晶
13、由键长推测下列四种原子晶体:
①金刚石,②晶体硅,③碳化硅,④二氧化硅,它们的熔点由高到低的顺序是
A.①④③②B.①②③④C.④①③②D.④③①②
14、136C—NMR(核磁共振)可以用于含碳化合物的结构分析。
136C表示的碳原子是
A.核内有13个电子,其中有6个能参于成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个质子
15、科学家制造出112号元素的一种原子,该原子的质量数为277。
关于该元素原子的下列叙述正确的是
A.原子核内质子数和中子数都112
B.原子核内中子数为165,核外电子数为112
C.该原子质量是126C原子质量的112倍
D.该元素的相对原子质量为277
16、下列叙述中正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同;
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布;
C.两原子,若核外电子排布相同,则一定属于同种元素;
D.不存在两种质子数和电子数均相同的阳离子和阴离子。
17、已知地球上的碳元素的原子量为12.011,其中12C和13C的原子数之比为89:
1。
测得哈雷慧星上的碳元素中12C和13C的原子数之比为65:
1,则哈雷慧星上的碳元素的原子量为
A.12.000B.12.009C.12.015D.13.000
18、我国最新报导的高温超体中,铊(Tl)是成分之一,以知铊和铝是同周期元素,关于铊的性质判断中,可能错误的是
A.是银白色金属B.Tl(OH)3是两性的
C.能生成+3价化合物D.与硝酸作用生成硝酸盐
19、下列晶体中,熔点最高、硬度最大的是
A.干冰B.氯化钠C.金刚石D.碘
20、下列递变规律正确的是
A.原子半径:
Li>
Na>
K>
RbB.酸性:
HClO4>
H2SO4>
H3PO4>
H2CO3
C.熔点:
石英>
氯化钠>
钾>
冰D.还原性:
Cl->
Br->
I->
S2-
21、(96年会考)有短周期元素A和B,它们可形成化合物A2B3。
若已知B的原子序数为m,则A的原子序数可能为
A.m+5B.m+6C.m+11D.m—3
22、(95年会考)有x、y两种元素,它们的原子序数都先小于18,它们的离子属于下列哪种情况,则x、y必属于同一周期的元素
A.x、y的离子具有相同的电子层结构B.x-和y2-具有相同的电子层结构
C.x+和y2-具有相同的电子层结构D.x-比y2-少一个电子层
23、(94年会考)有原子序数依次递增的X、Y、Z三种元素。
X、Y为相邻同周期元素,Y、Z为相邻同主族元素。
已知Y元素核电荷数是17,则下列分析有错误的是
A.X、Y原子有3个电子层,Y、Z原子最外层有7个电子
B.X元素气态氢化物还原性最强,Y元素单质氧化性最强
C.气态氢化物的分子组成是:
H2X、HY、HZ
D.D.最高价氧化物的水化物的酸性是:
H2XO4<
HYO4<
HZO4
24、(93年会考)某元素的原子序数为7,对它的认识有错误的是
A..它处于元素周期表中第二周期ⅤA族
B.它的最高正价为+5,负价为-3
C.它的最高价氧化物对应水化物是一种强酸
D.它的非金属性比磷弱比氧强
25、(98年会考)X和Y均为短周期元素,已知bYm+比aXn-少两个电子层,则下列判断正确的是
A.b<
5B.Y不可能位于第二周期
C.X只能位于第三周期D.a+n—b+m=10或16
26、下列符号所表示的微粒中,易与3919X形成化合物的是
A.199YB.2010ZC.2311ED.2814G
27、有Xn-、Yn+、Z三种微粒,其电子层结构相同,下列分析中正确的是
A.微粒半径大小关系是Xn->
Yn+B.Z一定是稀有气体元素C.原子序数关系是Z>
Y>
XD.原子半径关系是X<
Z<
Y
28、下列各指定原子序数的元素,不能形成AB2型化合物的是
A.6和8B.16和8C.12和9D.11和6
二、填空题
1、某三价金属阳离子共有28个电子,其质量数为70,它的中子数为。
2、请写出5种化学性质不同的物质的化学式,这些物质的分子都各具有10个电子:
。
3、在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期表有着密切的关系,约占人体总质量99.97%的11种宏量元素,全部位于周期表前20号元素之内,其余0.03%是由十多种人体不可缺少的微量元素组成。
在微量元素中只有F和Si位于短周期,其余均属于第一长周期。
在宏量元素中,除H、N、P外,在现用的周期表中还有的元素中:
(写出元素符号)
(1)原子最外层电子数是最内层电子数2倍的是。
(2)能显示化合价最多的元素是,跟它处于同一周期的还有一种非金属元素是。
(3)原子半径最大的是,它的相邻元素是、。
4、见《化学科毕业考试要求》P2133,P3032
5、有A、B、C、D、E五种元素,A、B、C三元素在周期表中位置如下表所示。
该三元素的原子序数之和为41。
A和D的单质在不同条件下可以反应生成D2A(白色固体)和D2A2(淡黄色固体)两种化合物。
E单质在C单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
(1)各元素的名称为:
A
ABCDEBC
(2)B元素的原子结构示意图为;
B和E组成化合物的电子式为。
(3)用化学方程式表示D2A2的生成:
(4)BA2和E2B反应的化学方程式为:
其中氧化剂是。
6、下表是元素周期表的一部分,针对表中编号①∽⑩的元素填空。
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
③
3
④
⑤
⑥
⑦
⑧
⑨
4
⑩
(1)编号①∽⑩的元素中,非金属性最强的元素名称是,该元素的原子结构示意图为。
(2)元素①的最高价氧化物的水化物对应的酸酐的化学式是。
(3)编号①∽⑩的元素中,最高价氧化物的水化物酸性最强的酸的化学式是。
(4)用电子式表示元素⑤和⑧形成化合物的过程。
(5)元素⑥的单质晶体属于晶体。
7、(98年会考)有A、B、C三种短周期元素。
已知:
①它们的原子序数按A、B、C递增;
②A、C属同一主族元素,且A元素原子核内只有1个质子;
③B元素的原子最外层电子数是次外层电子数的3倍。
则A、B、C三种元素分别为:
A、B、C。
8、(97年会考)有X、Y、Z三种短周期元素,Z原子核外有两个电子层,最外层电子数是第一层电子数的3倍;
X2+离子和Y-离子都跟氖原子具有相同电子层结构。
则X、Y、Z三种元素分别为:
X、Y、Z。
9、(96年会考)甲元素的原子序数为9;
乙元素原子核外有两个电子层,最外电子层上有5个电子;
丙是元素周期表第3周期中金属性最强的元素。
由此推断:
甲元素在周期表中位于第周期;
乙元素在周期表中位于第2周期族;
丙元素的最高价氧化物的水化物的化学式为。
10、在氢、氮、氯和钠四种元素中:
①有两种元素