初三化学复习重点知识点分类总结精文档格式.docx
《初三化学复习重点知识点分类总结精文档格式.docx》由会员分享,可在线阅读,更多相关《初三化学复习重点知识点分类总结精文档格式.docx(7页珍藏版)》请在冰豆网上搜索。
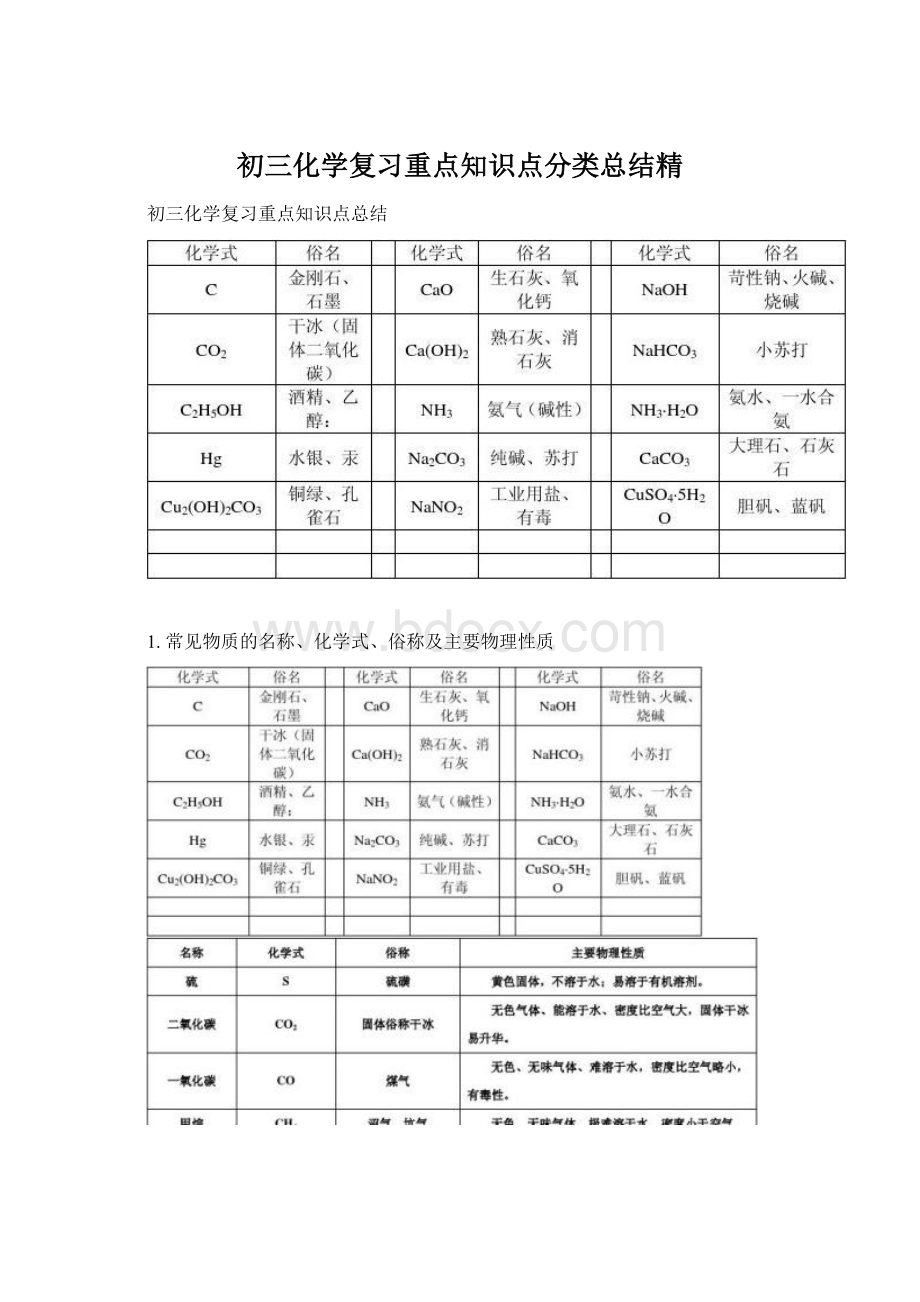
凡含Cu2+的溶液呈蓝色;
凡含Fe2+的溶液呈浅绿色;
凡含Fe3+的溶液呈棕黄色,其余溶液一般为无色。
(高锰酸钾溶液为紫红色
5.沉淀(即不溶于水的盐和碱:
①盐:
白色↓:
CaCO3、BaCO3(溶于酸AgCl、BaSO4(不溶于稀HNO3等
②碱:
蓝色↓:
Cu(OH2红褐色↓:
Fe(OH3白色↓:
Mg(OH2。
6.(1具有刺激性气体的气体:
NH3、SO2、HCl(皆为无色
(2无色无味的气体:
O2、H2、N2、CO2、CH4、CO(剧毒
▲注意:
具有刺激性气味的液体:
盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7.有毒的,气体:
CO液体:
CH3OH;
固体:
NaNO2CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液
解题技巧和说明
推断题解题技巧
看其颜色,观其状态,察其变化,初代验之,验而得之。
黑色:
MnO2、CuO、Fe3O4、C、FeS(硫化亚铁
蓝色:
CuSO4•5H2O、Cu(OH2.CuCO3.含Cu2+溶液、液态固态O2(淡蓝色
红色:
Cu(亮红色、Fe2O3(红棕色、红磷(暗红色
黄色:
硫磺(单质S、含Fe3+的溶液(棕黄色
绿色:
FeSO4•7H2O、含Fe2+的溶液(浅绿色、碱式碳酸铜[Cu2(OH2CO3]
无色气体:
N2、CO2、CO、O2、H2、CH4
有色气体:
Cl2(黄绿色、NO2(红棕色
有刺激性气味的气体:
NH3(此气体可使湿润pH试纸变蓝色、SO2
有臭鸡蛋气味:
H2S
(二解实验题
看清题目要求是什么,要做的是什么,这样做的目的是什么。
实验用到的气体要求是比较纯净,除去常见杂质具体方法:
①除水蒸气可用:
浓流酸、CaCl2固体、碱石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色、生石灰等;
②除CO2可用:
澄清石灰水(可检验出杂质中有无CO2、NaOH溶液、KOH溶液、碱石灰等;
③除HCl气体可用:
AgNO3溶液(可检验出杂质中有无HCl、石灰水、NaOH溶液、KOH溶液;
除气体杂质的原则:
用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或者生成新的杂质。
2.实验注意的地方:
①防爆炸:
点燃可燃性气体(如H2、CO、CH4前,要检验气体纯度。
②防暴沸:
稀释浓硫酸时,将浓硫酸倒入水中,不能把水倒入浓硫酸中。
③防中毒:
进行有关有毒气体(如:
CO、SO2、NO2的性质实验时,在通风厨中进行;
并要注意尾气的处理:
CO点燃烧掉;
SO2、NO2用碱液吸收。
④防倒吸:
加热法制取并用排水法收集气体,要注意熄灯顺序
实验室制取三大气体中常见的要除的杂质:
(1制O2要除的杂质:
水蒸气(H2O
(2用盐酸和锌粒制H2要除的杂质:
水蒸气(H2O、氯化氢气体(HCl,盐酸酸雾(用稀硫酸没此杂质
(3制CO2要除的杂质:
水蒸气(H2O、氯化氢气体(HCl
除水蒸气的试剂:
浓流酸、CaCl2固体、碱石灰(主要成份是NaOH和CaO、生石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色等;
除HCl气体的试剂:
AgNO3溶液(并可检验出杂质中有无HCl、澄清石灰水、NaOH溶液(或固体、KOH溶液(或固体;
[生石灰、碱石灰也可以跟HCl气体反应]
复分解反应复分解反应条件:
任意一个条件:
有水、气体、沉淀生成Ca(OH2+Na2CO3==CaCO3↓+2NaOHCa(OH2+2HCl==CaCl2+2H2ONaOH+HCl==NaCl+H2O2NaOH+H2SO4==Na2SO4+2H2OFe2O3+6HCl==2FeCl3+3H2OFe+2HCl===FeCl2+H2↑Fe+CuSO4==Cu+FeSO4Na2CO3+H2SO4==Na2SO4+H2O+CO2↑2NaHCO3△有白色沉淀生成工业制烧碱、实验室制少量烧碱无明显现象无明显现象无明显现象铁锈溶解、溶液呈黄色铁器除锈固体溶解、溶液显浅绿色银白色金属表面覆盖一层红色物质湿法炼铜、镀铜、溶液由蓝色变为浅绿色固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理产生使澄清石灰水变浑浊的气体小苏打蒸馒头Na2CO3+H2O+CO2↑CaCO3+2HCl==CaCl2+H2O+CO2↑3HCl+Al(OH3====AlCl3+3H2ONaHCO3+HCl===NaCl+H2O+CO2↑Na2CO3+2HCl===2NaCl+H2O+CO2↑CaCO3+2HCl===CaCl2+H2O+CO2↑NaHCO3+HCl===NaCl+H2O+CO2↑Ca(OH2+CO2====CaCO3固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢氢氧化铝药物治疗胃酸过多小苏打治疗胃酸过多气体放出气体放出气体放出消石灰放在空气中变质,生成白色不溶于水的固体苛性钠暴露在空气中变质,遇水潮解,遇二氧化碳变质白色沉淀生成、不溶于稀硝酸白色沉淀生成、不溶于稀硝酸黑色氧化铜溶于稀硫酸↓+H2O2NaOH+CO2====Na2CO3+H2OHCl+AgNO3==AgCl↓+HNO3Ba(OH2+H2SO4==BaSO4↓+2H2OCuO+H2SO4==CuSO4+H2OCaCl2+Na2CO3==CaCO3↓+2NaClNa2SO4+BaCl2==BaSO4↓+2NaCl初中化学敞口置于空气中质量改变的1、由于吸水而增加的:
氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
(一)质量增加的;
2、由于跟水反应而增加的:
氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜3、由于跟二氧化碳反应而增加的:
氢氧化钠,氢氧化钾,氢5
氧化钡,氢氧化钙1、由于挥发而减少的:
浓盐酸,浓硝酸,酒精,汽油,浓氨
(二)质量减少的水;
2、由于风化而减少的:
碳酸钠晶体Na2CO3•10H2O失去结晶水物质溶于水的吸热放热情况NaOH固体、CaO固体、浓H2SO4、Ca(OH2固体溶于水硝酸铵(NH4NO3溶于水(多数的分解反应)蔗糖、NaCl溶于水放出热量、使周围温度升高吸热,使周围温度下降不放热初中化学溶液的酸碱性1、显酸性的溶液:
酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)2、显碱性的溶液:
碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)3、显中性的溶液:
水和大多数的盐溶液(CaCl2、NaCl)金属和非金属单质、氧化物、酸、碱、盐之间的相互转化盐(无氧酸盐金属(1+O2(7非金属+O2(4(17盐(含氧酸盐(17(8碱性氧化物盐和金属(16(2+H2O酸性氧化物(15(5+H2O-H2O(6-H2O(3(11(12盐和氢气盐和水碱(14(9(13酸酸和盐+酸碱和盐两种新盐盐(10+碱盐现象化学反应实例物质所用试剂检验的方法、步骤6
⑴紫色石蕊试液酸(H+)⑵无色酚酞试液⑶pH试纸⑴紫色石蕊试液碱-(OH⑵无色酚酞试液⑶pH试纸盐酸及可溶性氯化物-(Cl)硫酸及可溶性硫酸盐-(SO42AgNO3试剂和稀HNO3取少量酸于试管并加入几滴石蕊试液。
取少量酸于试管并加入几滴酚酞试液。
蘸取少量酸滴在pH试纸上。
取少量碱液于试管中并加入几滴石蕊试液。
取少量碱液于试管中并加入几滴酚酞试液。
蘸取少量碱液滴在pH试纸上。
⑴取少量待测液于试管中⑵滴入几滴AgNO3试剂并滴加稀HNO3⑴取少量待测液于试管中⑵滴入几滴BaCl2试剂并滴加稀HNO3⑴取少量待测固体或溶液于试管;
⑵加入几滴稀HCl或稀HNO3;
⑶将生成的气体通入澄清石灰水。
石蕊试剂由紫色变为红色。
无色酚酞试液不变色。
pH<
7石蕊试剂由紫色变为蓝色。
无色酚酞试液由无色变为红色。
pH>
7产生不溶于稀HNO3的白色凝乳状沉淀。
生成不溶于稀HNO3的白色沉淀。
冒出气泡,气体能使澄清石灰水变浑浊。
HCl+AgNO3=AgCl↓+HNO3NaCl+AgNO3=AgCl↓+NaNO3BaCl2试剂和稀HNO3H2SO4+BaCl2=BaSO4↓+2HClNa2SO4+BaCl2=BaSO4↓+2NaCl碳酸盐-(CO32HCl或稀HNO3,澄清石灰水CaCO3+HCl=CaCl2+CO2↑+2H2ONa2CO3+2HCl=NaCl+CO2↑+H2OCa(OH2+CO2=CaCO3↓+H2O1.有关化学式的计算:
基本公式:
(1)相对分子质量=(化学式中各原子的相对原子质量×
化学式中该元素原子个数)之和
(2)化合物中某元素质量分数=该元素相对原子质量´
化学式中该元素原子个数化合物的相对分子质量´
100%(3)元素质量=物质质量×
该元素的质量分数2.有关溶液的计算溶液质量=溶质质量+溶剂质量溶液质量=溶液体积×
密度溶质的质量分数=溶质质量溶液质量´
100%溶解度溶解度+100g´
100%饱和溶液溶质的质量分数=稀释公式:
浓溶液质量×
稀释前浓度=稀溶液质量×
稀释后浓度浓溶液质量×
大浓度+稀溶液质量×
小浓度=混合溶液×
中浓度7
2.解题:
计算题的类型有a.有关质量分数(元素和溶质)的计算b.根据化学方程式进行计算c.由a和b两种类型混合在一起计算
(1)溶液中溶质质量分数的计算溶质质量分数=溶质的质量/溶液的质量×
100%
(2)化合物(纯净物)中某元素质量分数的计算某元素质量分数=某元素的原子质量和/化合物的质量×
100%(3)混合物中某化合物的质量分数计算化合物的质量分数=某化合物的质量/混合物的质量×
100%(4)混合物中某元素质量分数的计算某元素质量分数=某元素的质量和/混合物的质量×
100%或:
某元素质量分数=化合物的质量分数×
该元素在化合物中的质量分数(5)解题技巧a.审题:
看清题目的要求,已知什么,求什么,有化学方程式的先写出化学方程式。
找出解此题的有关公式。
b.根据化学方程式计算的解题步骤:
①设未知量②书写出正确的化学方程式③写出有关物质的相对分子质量、已知量、未知量④列出比例式,求解⑤答。
8