6金属的化学性质B定Word文档格式.docx
《6金属的化学性质B定Word文档格式.docx》由会员分享,可在线阅读,更多相关《6金属的化学性质B定Word文档格式.docx(13页珍藏版)》请在冰豆网上搜索。
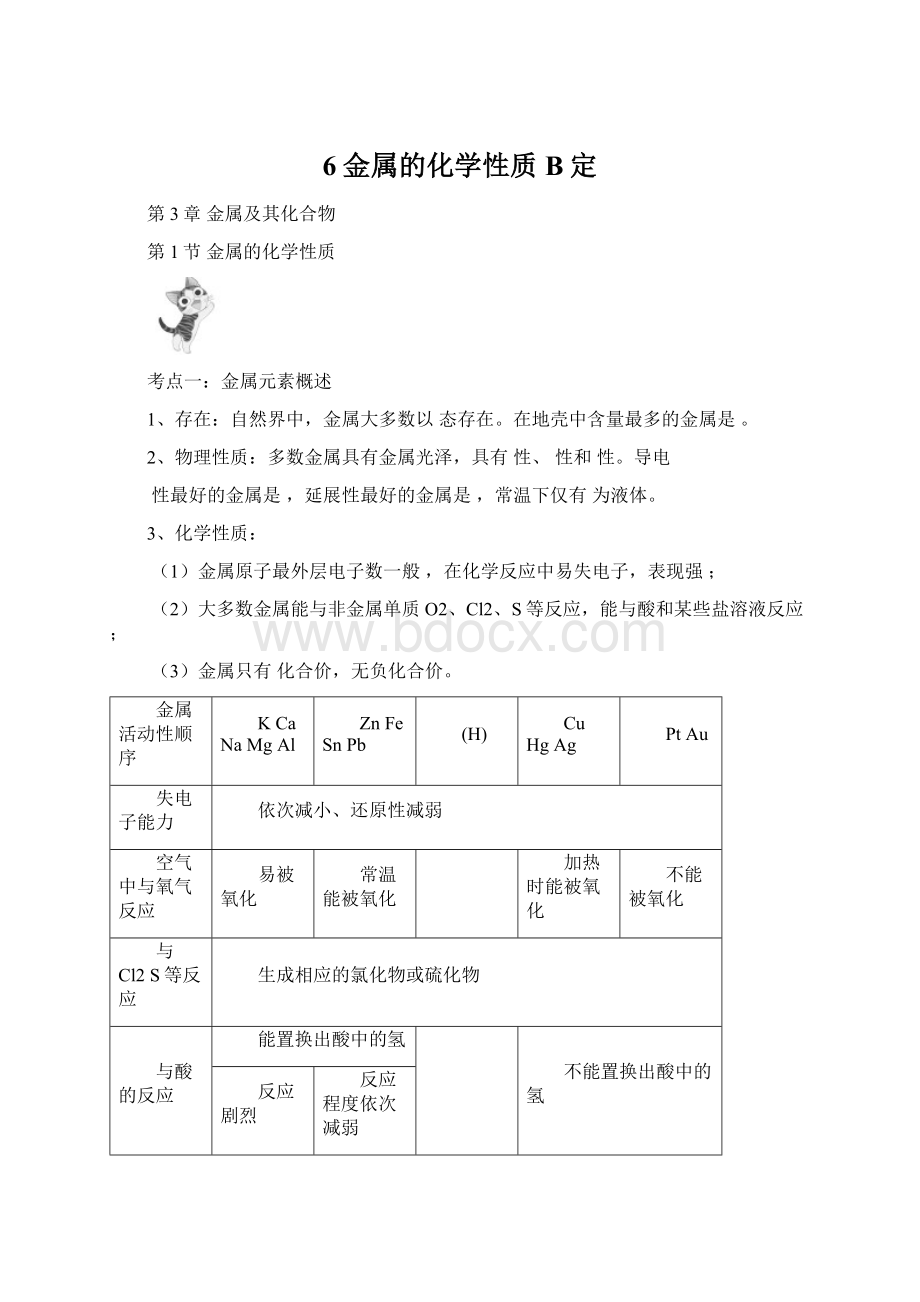
能置换出酸中的氢
不能置换出酸中的氢
反应剧烈
反应程度依次减弱
与盐反应
前置换后(钾钙钠除外)
典型例题:
例1:
金属活动性顺序是学习化学的重要工具,在工农业生产和科学研究中有重要应用。
(1)解释不能用铁制容器配制硫酸铜溶液的原因(用化学方程式表示):
______;
(2)验证镁比锌的金属活动性强,应选用的溶液是______;
(3)从金属活动性顺序中你还能获得哪些信息?
(写出一条即可):
。
例2:
把铁片投入下列溶液中,铁片质量减小,且没有气体产生,此溶液是( )
A.FeSO4 B.H2SO4 C.Fe2(SO4)3 D.AgNO3
随堂练习:
1、下列叙述与金属的物理性质无关的是( )
A.良好的导电性 B.反应中易失电子 C.延展性 D.导热性
2、下列关于金属特征的叙述正确的是( )
A.金属单质只有还原性,金属离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同的化合物中的化合价均不同
D.金属单质在常温下均是固体
3、某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序。
他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:
下列有关三种金属的说法正确的是()
A.三种金属的活泼性由强到弱是Ti、Mg、Cu
B.若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C.用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D.Cu和稀盐酸不发生化学反应
4、镁、铝、铁在日常生活中有较为广泛的用途。
(1)镁在空气中燃烧时,发出耀眼的白光,可用来制造镁闪光灯,其反应的化学方程式为 。
(2)市场上出售的补血麦片中常含有微量颗粒细小的还原性铁粉,铁粉与人体胃液中的盐酸反应转化成氯化亚铁,起到补血作用,写出反应的化学方程式:
(3)铝箔餐盒及铝箔托盘常用于航空食品包装等。
铝箔耐腐蚀的原因是(用化学方程式解释):
________________________________。
考点二:
钠单质
1、钠的物理性质
银白色固体,硬度小,熔点低,密度小
2、钠的化学性质
(1)钠与非金属反应
(2)钠与水反应化:
,离:
现象:
实质:
钠在空气中的变化:
银白色金属钠→表面变暗(Na2O)→出现白色固体(NaOH)→表面潮解的溶液(NaOH溶液)→白色块状物质(Na2CO3.10H2O)→白色粉末状物质(Na2CO3)
反应方程式:
(3)钠与酸溶液的反应(如盐酸)
【思考】试比较钠与水、酸反应的剧烈程度?
【说明】过量的钠投入酸溶液中,先与酸反应,酸反应完后再与水反应
(4)钠与盐反应
①与盐溶液反应
钠与硫酸铜溶液:
钠与氯化铵溶液:
钠与氯化铁溶液:
钠与饱和氯化钠溶液:
3、钠的制备、保存与用途
(1)制备:
(2)保存:
(3)用途:
①钠钾合金(液态)可用于原子反应堆的导热剂;
②作强还原剂,将某些稀有金属从它们的卤化物中还原出来,如4Na+TiCl4
Ti+4NaCl;
③用作电光源,制作高压钠灯。
例1:
根据你对金属钠性质的了解,回答下列问题.
(1)下列关于钠的叙述中,正确的是
.
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的
等物质反应,通常将它保存在
里,以使它与
等隔绝.
(3)将一小块Na投入到下列溶液中,既能产生气体又会出现白色沉淀的是。
A、
稀硫酸B、硫酸铜溶液C、氢氧化钠稀溶液D、氯化镁溶液
1、将一块银白色的金属钠放在空气中会发生一系列的变化,下列有关叙述正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠
B.表面“出汗”是因为生成的氢氧化钠吸收空气中的CO2在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
2、等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量大
D.两块钠的反应产物质量一样大
3、将一小块金属钠投入CuSO4溶液中,不可能观察到的现象是( )
A.溶液中有蓝色沉淀生成
B.有气体生成
C.有红色物质析出
D.钠熔成小球浮游在液面上
4、将一小块金属钠投入足量的下列溶液,既能生成气体,又能生成蓝色沉淀的是( )
A.MgCl2溶液 B.Ba(OH)2稀溶液 C.CuSO4溶液 D.CaCl2
溶液
5、一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原来温度,下列说法正确的是( )
A.溶液中溶质质量增加,溶剂量减少,溶液的溶质质量分数变大
B.溶液的pH不变,有氢气放出
C.溶液中的Na+数目减少,有氢气放出
D.溶液中的c(Na+)增大,有氢气放出
6、下列反应可能会生成Na2O2的是( )
A.金属钠高温还原CO2,制人工金刚石
B.汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠
C.隔绝空气、加热条件下金属钠与NaNO2反应制取Na2O
D.将4.6g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热
7、对于反应:
TiCl4+4Na
4NaCl+Ti,下列说法不正确的是( )
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C.该反应中钠被氧化
D.该反应是置换反应
8、用右图所示的方法研究钠与水的反应,其中A是用带孔的铝箔包裹着的小钠块。
(1)待用的小钠块要用滤纸吸一吸,这样做的目的是。
(2)包裹钠块的铝箔要预先刺上适当大小、足够多的小孔,假如在实验刚开始就将镊子松开,A将出现的现象是________________,出现这种现象的原因是
(3)据预测,钠与水反应生成氢气和氢氧化钠。
①证明生成的气体是氢气的实验方法是 。
②证明生成氢氧化钠的实验方法和相应的现象是 。
③钠跟水反应的化学方程式是 。
(4)用盐酸代替水做钠的性质探究实验有危险,主要原因是。
考点三:
单质铝
1、铝的物理性质
银白色固体,硬度小,密度2.7g·
cm—3熔点660.4℃,良好的导电性和导热性
2、铝的化学性质
(1)与非金属反应:
(2)与酸反应:
(3)与强碱反应:
3、铝的存在形式和制取
(1)铝在自然界中以的形式存在。
(2)工业上制取铝的化学方程式。
※不能电解熔融态的AlCl3制取Al,AlCl3是共价化合物。
甲、乙两烧杯中各盛有100mL3mol⋅L−1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1:
2,则加入的铝粉质量为(
)
A.5.4g
B.3.6g
C.2.7g
D.1.8g
有两种金属的合金13g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是( )
A.Mg和Zn B.Mg和Al C.Fe和Zn D.Cu和Fe
1、称取两份铝粉,第一份加入足量的氢氧化钠溶液,第二份加入足量的稀盐酸,如果放出等体积的气体(同温同压下),则两份铝粉的质量之比为(
A.1:
2
B.1:
3
C.3:
D.1:
1
2、将钠、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生气体的体积比是()
2:
3B.6:
3:
2C.3:
1:
1D.1:
3、有两种金属的合金13g,与足量稀硫酸反应后,在标准状况下产生气体11.2L,则组成该合金的金属可能是( )
A.Mg和Zn B.Mg和Al C.Fe和Zn D.Cu和Fe
4、由锌、铁、铝、镁四种金属中的两种组成的混合物10g与足量的盐酸反应,产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是( )
A.锌 B.铁 C.铝 D.镁
5、现有Na、Mg、Al、Fe四种金属中的两种组成的混合物12g,与足量的盐酸反应产生0.5gH2,则此混合物中必含( )
A.Na B.Mg C.Al D.Fe
6、对反应2Al+2NaOH+2H2O
2NaAlO2+3H2↑的说法正确的是( )
A.氧化剂是NaOH
B.生成3molH2时转移了6mol电子
C.反应中Al被还原
D.1molAl失电子时,3molH2O中的氢全部得电子
考点四:
物质的量在化学方程式的计算
写→标→列→解→答
向500mL
NaOH溶液中投入10.8g
Al,二者恰好完全反应后,计算:
(1)Al的物质的量.
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度.
(3)生成标准状况下H2的体积.
1、Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L.下列推断中不正确的是( )
A.参加反应的Mg、Al共0.2
mo1
B.参加反应的HC1为0.4mol
C.Mg、Al在反应中共失去0.4
mol电子
D.若与足量的稀硫酸反应能产生0.2molH2
2、把23g钠投入到m1
g足量的水中得到ag溶液,把24g镁投入到m2
g足量的盐酸中得到bg溶液,若m1=m2,则a、b的关系是( )
A.a>
b B.a<
b C.a=b D.无法确定
3、用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是( )
A.PbO B.Pb2O4 C.Pb3O4 D.PbO2
4、把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO2−4-的物质的量浓度之比为()
4B.2:
7C.1:
2D.3:
8
5、把1.1g铁、铝混合物溶于200mL5m0L.L-1盐酸中,反应后盐酸的浓度变为4.6moL.L-1(溶液体积变化忽略不计).
(1)反应中消耗HC|的物质的量
(2)该混合物中铝、铁的质量
6、一块表面已部分被氧化的金属钠的质量为1.08克,放入100ml水中,得到氢气224ml(标准状况下),求:
(1)金属钠表面的氧化钠的质量是多少?
(2)所得溶液的溶质的物质的量浓度是多少?
(忽略溶液体积的变化)
7、取1.43gNa2CO3·
xH2O溶于水配成5mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸10mL,并收集到112mLCO2(标况下)。
求:
(1)稀盐酸中溶质的物质的量浓度;
(2)Na2CO3·
xH2O的摩尔质量;
(3)x值。
8、填空
(1)分别取Wg钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是
(2)分别取0.1mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量比是
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝三种金属的物质的量之比是
综合练习:
1、下列说法错误的是( )
A.钠在空气中燃烧时先熔化,再燃烧,最后所得的产物是Na2O2
B.铝因在空气中形成了一薄层致密的氧化膜,保护内层金属,故铝不需特殊保护
C.铝制品在生活中非常普通,是因为铝非常不活泼
D.铁因在潮湿的空气中形成的氧化物疏松,不能保护内层金属,所以易锈蚀
2、下列反应没有氢气生成的是( )
A.单质钠投入水中
B.铝投入到氢氧化钠溶液中
C.铜块放入稀硫酸中
D.往铁粉中通入水蒸气,并高温加热
3、下列说法正确的是( )
A.等质量的铝分别投入过量的稀盐酸和NaOH溶液中,反应生成的气体在相同条件下体积相等
B.金属单质与水反应都生成对应的碱和氢气
C.活泼的金属或较活泼的金属都能与酸反应,但不能与碱反应
D.由于钠的化学性质活泼,所以它能从溶液中置换出金属活动性顺序中钠后面的金属
4、钠、铝、铁是中学化学常见的三种金属。
下列说法中正确的是( )
A.等物质的量的三种金属分别与足量的稀硫酸反应,金属钠放出H2最多
B.未经打磨的铝箔和经过打磨的铝箔,分别在酒精灯上加热至熔化,前者熔化不滴落,后者熔化后滴落
C.铁表面的氧化膜是疏松的,不能保护内层的铁
D.钠跟氯化铜溶液反应,有红色沉淀生成
5、下列说法不正确的是( )
A.自然界中没有游离的钠和铝
B.若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,一定有氢氧化铜沉淀析出,也可能有铜析出
D.mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小
6、M(NO3)2热分解的化学方程式为2M(NO3)2
2MO+4NO2↑+O2↑,加热29.6gM(NO3)2使其完全分解,在标准状况下收集到11.2L的气体,那么M的相对原子质量是( )
A.24 B.74 C.148 D.40
7、
(1)如图甲所示,在平底烧瓶底部有一块钠,剩余空间充有干燥的空气。
过一段时间后可观察到银白色的钠变暗,发生反应的化学方程式为 。
(2)如图乙先用弹簧夹夹住橡胶管,点燃钠(足量),迅速伸入瓶中并塞上瓶塞,发生反应的化学方程式为________________,产物的颜色是________,待反应完全并冷却至原温度后,打开弹簧夹,则广口瓶内水面上升的体积占瓶内原空气体积的________(假设装置的气密性良好且操作正确,反应产物与水不接触)。
(3)若图乙是铁丝在纯氧中燃烧,会观察到铁丝剧烈燃烧,火星四射,所得产物的化学式是________。
8、有两种常见的非金属元素A、B与常见的三种金属元素C、D、E。
A的一种单质是自然界中硬度最大的物质,B与C的单质在加热条件下反应生成淡黄色化合物X,D的单质既能与盐酸也能与NaOH溶液反应生成H2。
E的单质在B的单质中燃烧火星四射,生成一种黑色固体Y。
请回答下列问题:
(1)物质X的名称为____________。
(2)将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因是
____________________。
(3)写出E的单质与H2O在高温条件下反应的化学方程式,并用单线桥法分析电子转移的方向和数目:
。
(4)agC的单质投入足量CuSO4溶液中,下列实验现象正确的有________(填字母序号)。
A.C的单质沉在溶液底部
B.C的单质熔化成光亮的小球
C.小球四处游动发出“嘶嘶”的声音
D.生成红色固体物质
9、某同学利用如图所示实验装置进行铁与水蒸气反应的实验,并对反应后硬质试管中固体物质的组成进行了探究。
(1)硬质试管中湿棉花的作用是 。
(2)铁与水蒸气的反应中,氧化剂是________(填化学式,下同),还原剂是________。
(3)该同学对反应后硬质试管中固体物质的组成提出了如下假设。
假设1:
只有Fe;
假设2:
只有________;
假设3:
既有Fe也有Fe3O4。
(4)为了验证反应后硬质试管中固体物质的组成,该同学进行了定量研究:
反应前固体物质的质量为5.6g,反应后固体物质的质量为6.6g。
从上述数据分析,反应后硬质试管中固体物质的组成为。