高中化学实验改进与创新案例集4155文档格式.docx
《高中化学实验改进与创新案例集4155文档格式.docx》由会员分享,可在线阅读,更多相关《高中化学实验改进与创新案例集4155文档格式.docx(25页珍藏版)》请在冰豆网上搜索。
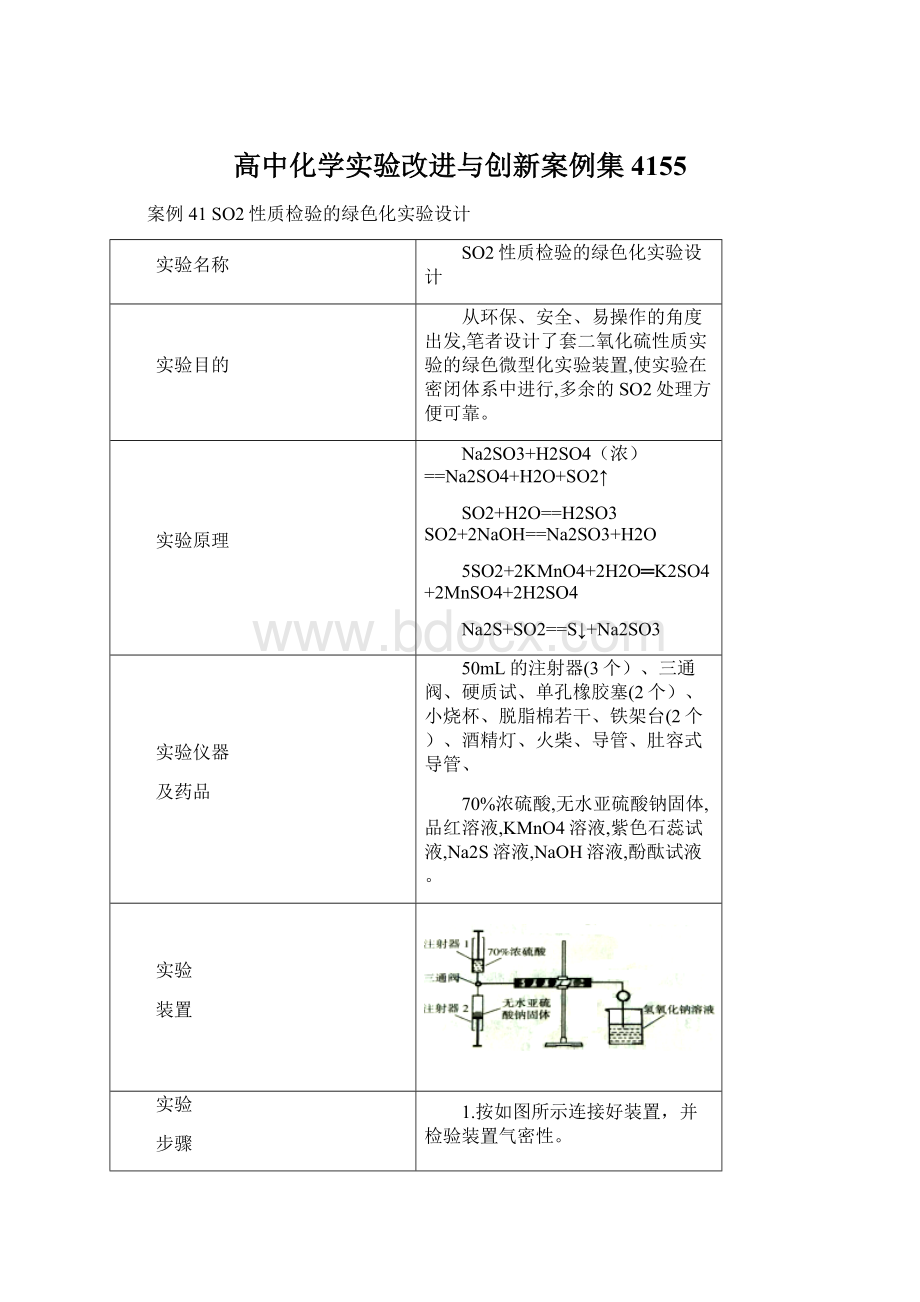
在硬质试管中依次装入蘸有品红溶液,高锰酸钾溶液,紫色石蕊试液,硫化钠溶液和滴有酚酞的氢氧化钠溶液的脱脂棉。
2.旋转三通阀,使两只注射器与硬质试管实现三通,推动注射器1,将70%浓硫酸推入注射器2与无水亚硫酸钠固体反应,产生气体后旋转三通阀使注射器2与硬质试管相通。
3.二氧化硫气体在硬质试管中依次反应,观察到品红溶液褪色,高锰酸钾溶液褪色,石蕊试液变红,硫化钠溶液中有淡黄色硫单质生成,滴有酚酞的氢氧化钠溶液褪色,最后多余的气体被氢氧化钠溶液吸收。
4.用酒精灯对褪色之后的品红加热,又恢复红色,对比石蕊试液只是变红而未褪色,得出二氧化硫不能漂白酸碱指示剂。
5.用酒精灯对褪色后的其他脱脂棉加热,没有恢复红色,说明它们的褪色原理不同。
6.实验结束后,取下注射器1,连接上注射器3,转动三通阀,使注射器3与硬质试管相通,推动注射器3,将体系中残留的气体排出,被氢氧化钠溶液吸收。
创新
设计
后的
优点
1、改进后的装置简单、便携、容易操控、实验现象明显。
2、药品用量少、实验时间短。
3、环保无污染、体现了实验的简约与绿色化的思想。
案例42蔗糖溶液水解实验的改进
蔗糖溶液水解实验的改进
人教版普通高中课程标准实验教科书必修2蔗糖的水解反应(实验3-6)不能很好地证明蔗糖发生了水解反应,生成具有还原性的葡萄糖,因为此时学生不知道蔗糖没有还原性,因此,实验可进行改进。
C12H22O11+H2OC6H12O6+C6H12O6
3支试管、酒精灯、铁架台(铁圈、铁夹)、石棉网、PH计、20%的蔗糖溶液、新制备的Cu(OH)2溶液、稀硫酸、NaOH溶液。
1.取3支试管,分别标记为①②③,各加入1mL20%的蔗糖溶液。
2.向试管①中直接加入新制备的Cu(OH)2溶液,加热3~5min,溶液变黑,这是Cu(OH)2分解为CuO所致;
说明蔗糖没有醛基,无还原性。
3.试管②水浴加热5min后,再加入新制备的Cu(OH)2溶液,加热3~5min,没有明显变化;
说明蔗糖在没有催化剂的条件下很难发生水解反应。
4.向试管③中加入3~5滴稀硫酸,水浴加热5min后把溶液分为两份:
一份直接加入少量新制备的Cu(OH)2溶液,加热3~5min,只看到悬浊液变为蓝色溶液,这是稀硫酸与Cu(OH)2溶液发生中和反应所致;
另一份先加NaOH溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2溶液,加热3~5min,产生了砖红色的沉淀。
说明蔗糖在稀硫酸催化下可发生水解反应,且水解产物葡萄糖须在碱性环境下方可与新制备的Cu(OH)2溶液共热产生砖红色沉淀。
通过改进后的对比实验,层层推进,环环相扣,不但培养了学生思维的严密性,而且有助于学生深刻理解蔗糖属于非还原性糖,水解产物的鉴定要在碱性环境下进行;
同时,也让学生体会到有机相反应大都需要催化剂这一事实。
案例43氢氧化亚铁制备实验的创新设计
氢氧化亚铁制备实验的创新设计
经查阅资料,FeSO4·
(NH4)SO4·
6H2O在空气中较稳定,但是该试剂在中学实验中并不常见。
因此,模拟该溶液环境下的溶液中Fe2+也较为稳定,可以使Fe(OH)2在较长时间内保持白色。
所以设计一种更为简便、可操作性强的实验方法,引导学生的深入思考和深度探究。
2SO32-+O2==2SO42-(据此除去溶液中的溶解氧,提供还原性环境)
Fe2++2NH3·
H2O==Fe(OH)2↓+2NH4+
以NH3·
H2O代替NaOH既可以产生Fe(OH)2白色沉淀,又可以生成NH4+。
3%FeSO4溶液、稀硫酸、还原铁粉、5%Na2SO3溶液、2%氨水、蒸馏水、胶头滴管、试管、大烧杯、小烧杯、托盘天平、药匙、滤纸、玻璃棒。
1.配制3%的FeSO4溶液。
称取2.5gFeSO4·
7H2O,加入少量稀硫酸和还原铁粉,再加入47.5ml蒸馏水,混合配制成3%的FeSO4溶液备用。
2.溶液的混合。
取1支洁净的试管,向其中依次加入2%的氨水和5%的Na2SO3溶液各1-2ml,再用较长的胶头滴管吸取3%的FeSO4溶液后小心地插入混合溶液的底部,缓缓挤出FeSO4溶液。
(注意:
不宜挤的过猛,也不要振荡试管防止带入空气,以免影响实验效果。
)可以观察到一团白色絮状沉淀生成,由于在上方Na2SO3溶液的还原性环境的液封下,生成的白色沉淀Fe(OH)2可以在较长时间内保持白色。
若要使其变为灰绿色,只需用胶头滴管鼓入空气或用力振荡试管,即可观察到沉淀迅速变灰绿色,最终变红褐色
1.本实验设计避开了驱除溶液中的溶解氧、液封等较为复杂的操作,使操作更为简便。
2.只需常规仪器和操作方法即可解决本实验操作的难点,成功率高,重现性好。
既适合教师在课堂上演示实验,也可用于学生的分组探究
3.试剂的用量较少,但现象非常明显。
4.该实验方案既可以观察到Fe(OH)2的本来颜色,又可以观察到颜色变化的过程,有利于于直观地展示Fe(OH)2生成及转化的过程,促进学生对Fe(OH)2制备及其性质的自主建构和整合。
案例44氯化铵分解实验的改进
氯化铵分解实验的改进
鲁科版高中化学《必修1)课本78面【观察·
思考】栏日中【实验1】存在以下两个不足之处:
(1)导致试管口处出现NH4Cl晶体有两种方式:
①试管底端NH4Cl晶体受热升华,在试管口处受冷,凝结而成。
②试管底端NH4Cl晶体受热分解,产生NH3和HCl,两种气体在低温情况下,反应生成NH4Cl附在试管壁上。
【实验1】无法解释试管口处NH4Cl晶体如何产生。
(2)防止学生产生以上困惑,有的教师讲解该知识点时,特意给学生“NH4C1受热不发生升华”的已知信息,引导学生分析NH4C1的不稳定性。
即使如此,【实验1】也无法让学生清晰地判断出NH4C1的分解产物。
因此,呈现给学生NH4C1分解的方程式也很牵强。
NH4C1加热NH3↑+HCl↑NH3+HClNH4C1
铁架台、酒精灯、玻璃管、Y形管、止水夹2个、橡胶管、U形管、导管、石棉绒、NH4Cl晶体、NaOH固体、P2O5、pH试纸。
1.将NH4Cl晶体放入U形管底部,在U形管的一侧放入含NaOH固体的石棉绒,另一侧放入含P2O5的石棉绒,塞紧后,固定在铁架台上。
在U形管的两端出口处分别连有由玻璃管和橡胶管组成的导气管,并在两条导气管的玻璃管中放上湿润的pH试纸,在橡胶管处夹上止水夹。
最后,两条导气管末端连在一个Y形管的两端。
因为NH3和HCl都特别易溶于水、有刺激性的气体,为保证实验的安全,在Y形管出气口处,连接防倒吸的尾气处理装置,如上图所示。
2.实验开始,打开止水夹K1,关闭K2,先对U形管底端进行预热,然后,固定酒精灯的位置,对U形管底部进行加热,发现湿润的PH试纸A变红,证明产生了HCl气体。
3.紧接着,用止水夹K1夹住导气管,并打开止水夹K2,发现湿润的pH试纸B变蓝,证明产生了NH3。
4.最后,同时打开止水夹K1、K2,一段时间后,在Y形管中央的三又口处,有白色晶体产生,证明白色晶体是NH4C1,由NH3和HCl反应产生。
通过改进,学生不但可以切身感受到NH4Cl受热不稳定,而且还能够清晰地认识到,NH4Cl受热分解生成的产物一定是NH3和HCl,NH3和HCl气体温度降低后,又反应生成NH4Cl晶体,从而解决了原实验中遇到的困惑。
案例45NO、NO2制备与性质实验创新设计
NO、NO2制备与性质实验创新设计
利用医用注射器设计了微型化、防污染的NO、NO2的制备与性质的实验。
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
2NO+02=2NO2
3NO2+H2O=2HNO3+NO
5mL注射器、胶塞、铜片、稀硝酸、氢氧化钠溶液
1.按上图组装好实验装置:
先将一小片铜片放入5mL注射器内,排净注射器内的空气,然后吸入2mL稀硝酸,迅速将注射器针头插在胶塞上,铜片表面产生大量气泡,注射器活塞被后推,有无色气体生成,溶液由无色变为蓝色。
2.NO、NO2的性质实验
(1)反应完毕后(铜片完全消失),将注射器针头向上,让气体处于针筒上部,将针头从胶塞上拔出,拉动活塞吸入空气,可以观察到注射器内无色气体迅速变成红棕色。
(2)将注射器针头插在胶塞上,将注射器针头向下,让反应后的溶液处于针筒下部,将针头从胶塞上拔出,将溶液全部压入氢氧化钠溶液中,再向盛有红棕色气体(NO2)的注射器中吸入蒸馏水,将注射器针头插在橡胶
塞|,振荡注射器,会看到注射器中的气体体积减小,活塞前推(大约至原气体体积的2/3处),气体由红棕色逐渐变为无色。
1.实验采用微型化设计,利用废旧注射器实现了废物利用;
节约药品,现象明显,使于观察和操作,适合学生分组实验。
2.实验在封闭体系中进行,减少了环境污染,有利于培养学4的环保意识。
案例46氯气的制备与性质一体化微型实验改进
氯气的制备与性质一体化微型实验改进
将氯气的制备与性质实验结合起来,实现一体化和绿色化。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
U形管、内套小试管、注射器、橡胶管、V形侧泡反应管、直角形通气管、小烧杯、蘸了淀粉碘化钾溶液的棉花团、;
KMnO4固体、浓盐酸、紫色石蕊试剂、NaOH溶液、KI溶液。
1.仪器组装:
按图所示组装实验仪器,U形管中装有浓盐酸,内套小试管里装有高锰酸钾固体,在V形侧泡反应管左侧凹槽中加入紫色石蕊试剂,且在中间加一团蘸了淀粉碘化钾溶液的棉花,小烧杯中加入NaOH溶液以吸收尾气。
2.制备实验:
缓缓按压注射器,使U形管中的浓盐酸与KM04固体反应,这时可看到有黄绿色气体(氯气)产生。
3.性质实验:
随着反应的进行,V形侧泡反应管左侧的凹槽处的紫色石蕊试剂先变红后褪色,说明氯气溶于水生成的HCl和HClO具有酸性,故石蕊试剂变红,而HClO具有漂白性,故试剂褪色。
蘸了淀粉碘化钾溶液的棉花团由无色变成蓝紫色,说明有碘生成,即Cl2置换出KI中的I2。
4.尾气吸收:
最后多余的氯气被NaOH溶液吸收,避免氯气污染空气。
1.将氯气的制备与性质实验结合起来,实现一体化,避免学生操作过程手忙脚乱,降低了实验的危险系数,便于学生操作实验。
2.根据绿色化学的发展理念,采用了微型实验仪器,节约环保。
案例47铜与稀硝酸实验的改进
铜与稀硝酸实验的改进
铜可以和稀硝酸反应放出无色NO气体,但NO很容易被空气中的O2氧化为NO2,我们无法直接观察到无色的NO,所以在实际教学中对于生成NO会给学生造成牵强附会的感觉。
为了让学生真正感知到NO的产生及NO很容易被氧化为NO2,我们对实验进行了改进。
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
2NO+O2==2NO2
长颈漏斗、球形分液漏斗、烧杯、铁架台、铜丝、稀硝酸。
1.按图1组装实验装置,检查装置气密性,将配制好的稀硝酸充满球形分
液漏斗。
2.将缠有铜丝的长颈漏斗通过橡胶塞插入球形分液漏斗中,由于铜与稀
硝酸反应放出NO,分液漏斗内压强增大,使得硝酸进入长颈漏斗中,此时可观察到无色NO气体。
3.将分液漏斗活塞打开,稀硝酸流出,空气由长颈漏斗进入分液漏斗与NO接触,可观察到无色气体变成红棕色。
4.实验完毕,向长颈漏斗中注入氢氧化钠溶液吸收NO和NO2。
1.可以观察到无色NO气体,证明了铜与稀硝酸反应生成的气体是NO
2.证明无色NO气体很容易被氧化变成红棕色NO2。
3.将两种污染性气休封闭在分液漏斗中既便于观察又避免对环境污染,也有利于用氢氧化钠溶液吸收NO和NO2。
例48钠与水反应的微型改进
钠与水反应的微型改进
教材中的实验反应太剧烈,安全系数低且实验设计中未涉及产生气体的检验。
采用微型实验仪器进行实验改进,装置简单安全,适合做演示实验,也适合学生自己动于实验,符合新课标的要求,可以逐步培养学生的实验操作能力,增加课堂的乐趣。
2Na+2H20=2NaOH+H2↑
铁架台、小烧杯、针筒、橡胶塞、具支试管、镊子、钠、酚酞试液、水等。
1.在小烧杯中加水至中部,滴加1滴酚酞试液,用针筒抽取备用。
2.将具支试管横放,用镊子将米粒大的钠投入具支试管的侧泡中。
3.用肥皂液抹在具支试管的支管口处(抹肥皂液时,应在管口稍停留一会,有利于形成肥皂泡)。
4.将针头穿透橡胶塞,塞住具支试管的管口,推动针筒,溶液进入试管,与钠反应。
5.当支管口形成肥皂泡时,将点燃的火柴移近肥皂泡,能听见氢气清晰的爆鸣声。
1.装置简单安全,适合做演示实验,也适合学生自己动手实验,增加课堂乐趣。
2.生成的氢气容易检验,检验时点燃气泡即可,可以听到“噗”的一声,给学生留下深刻的印象。
案例49钠与水反应的实验改进
钠与水反应的实验改进
利用医用塑料注射器对钠和水的实验装置进行改进,弥补传统实验的不足,且实验安全、操作简单、现象明显、反应易控制、产物易检验,呈现出钠投入到煤油和水的混合物中的现象,使学生对钠和水反应的认识更为深刻。
钠与水反应:
2Na+2H2O===2NaOH+H2↑
50mL注射器2个、输液管2段、单孔橡胶塞1只、表面皿1个、钠粒、酚酞、水、煤油、肥皂液。
实验
1.在注射器1中吸入40mL含有酚酞的水,用输液管将2个注射器连接起来。
2.向注射器2中注入约20ml煤油,取1粒钠投入煤油中,沉入底部,塞上插有输液管的单孔橡皮塞,最后将输液管导人装有肥皂液的表面皿中。
3.慢慢推动注射器1的活塞,水通过输液管进入注射器2中,钠粒在煤油与水的交界处与水立即反应。
注射器2中的溶液分层,下层溶液为红色,上层为无色。
钠粒在煤油中上下浮动,没有熔成光亮的小球,触摸注射器2的外壁,有放热的感觉。
4.一段时间后,用燃着的火柴戳肥皂泡,听到噗”的声音,证明H2的生成。
5.实验完成后,轻轻反拉注射器1的活塞,将水抽回,剩余的钠依旧沉在煤油下方,多余的钠粒可取出放回原瓶。
1.改进后的装置简单易操作,而且注射器的使用更能激发学生的兴趣,开阔学生的视野,鼓励学生大胆创新。
2.整套装置是全塑料材质,安全放心。
3.将煤油与水混合与钠反应,不仅减缓了化学反应速率,现象明显,还可以解决练习与实践过程中遇到的问题。
4.可以控制反应的发生和停止,而且氢气的检验安全方便,现象明显。
案例50氯化氢制备与性质实验一体化改
(一)
氯化氢制备与性质实验一体化
设计一种制备氯化氢和其性质实验的一体化和绿色化实验。
NaC1+H2SO4(浓)=NaHSO4+HCl↑(常温或微热)
2NaCl+H2SO4(浓)=Na2SO4+2HCl↑(在500-600℃)
铁架台、石棉网、脚架、圆底烧瓶、三11烧瓶、分液漏斗、酒精灯、Ⅴ形管、橡胶管、橡胶塞、玻璃导管、烧杯、小漏斗、表面皿、胶头滴管、止水夹。
氯化钠固体、98%浓硫酸、紫色石蕊试剂、燕馏水、硝酸银、棉花团、氢氧化钠溶液。
1.按图组装实验装置,制备氯化氢气体:
反应开始前,止水夹a、b、c均处于关闭状念。
首先检查装置的气密性,打开止水夹b,三口烧瓶处于密闭状态,用热毛巾捂住三口烧瓶瓶身,若在A处长导管下有均匀的气泡冒出,说明装置的气密性良好。
向三口烧瓶中加入15gNaCl固体,在分液漏斗中加入15mL浓硫酸。
关闭止水夹b,打开止水夹c,点燃酒精灯加热,慢慢旋开分液漏斗的玻璃塞,缓缓加入浓硫酸。
2.盐酸的通性(C1-)和酸的通性(H+)
随着反应的进行,可观察到V形管中AgNO3溶液处产生白色沉淀,蘸有紫色石蕊试液的棉花团变红。
因为反应产生的HCl气体与V形管中的AgNO3溶液发生反应产生了AgCl白色沉淀。
湿润的HCl气体能够使紫色的石蕊试液变红,因此HCl呈酸性。
3.喷泉实验
关闭止水夹c,先打开止水夹b,经过一段时间,再打开止水夹a,同时挤压装蒸馏水的胶头滴管,烧瓶内产生喷泉现象。
因为烧瓶中的HCl气体极易溶于水,使得烧瓶内的气压比大气压小,于是烧杯中的蒸馏水进入烧瓶,使得喷泉现象能够持续进行一段时间。
1.不必重新组装装置进行喷泉实验,实现了氯化氢制备与性质实验的一体化,实验只需一个人就可以完成,有利于教师在课堂上演示实验,保证实验有序进行。
2.整个过程无需更换导管或橡胶管,避免了氯化氢气体泄露造成环境污染,保证了学生的健康。
案例51氯化氢制备与性质实验一体化
(二)
2NaCl+H2SO4(浓)=Na2SO4+2HCl↑(在500-600℃)
酒精灯、分液漏斗、集气瓶、导管、小漏斗、烧杯、橡胶塞、铁架台、胶头滴管、铁圈、台秤、量筒、石棉网、pH试纸、带支管的圆底烧瓶。
氯化钠、98%浓硫酸、紫色石蕊试液、然馏水、硝酸银溶液。
图1图2
1.称取氯化钠15g,放入烧瓶中,用量筒量取15mL98%的浓硫酸,将浓硫酸倒入分液漏斗中。
按图1组装仪器,完成后,用止水夹夹住②橡胶管,点燃酒精灯加热,慢慢滴加浓硫酸,收集纯净的氯化氢气体,在①的橡胶管口处放一张pH试纸来验满,然后用蘸有浓氨水的玻璃棒靠近①橡胶管口观察现象。
2.打开②止水夹,①橡胶管用一个止水夹夹住,并在橡胶管口处接上图2装置,待烧杯中的溶液变红后,关闭分液漏斗的活寒并移除酒精灯,打开①中的的蒸馏水止水夹,关闭②中的止水夹,然后观察图2烧杯中的现象。
3.将图1右侧的烧杯移走,换成另一只滴有紫色石蕊试液的蒸馏水的烧杯。
挤压装有水的滴定管的胶头,观察喷泉实验的现象。
1.可以实现氯化氢的制备与性质一体化实验,步骤简单,有利于学生的动手操作。
2.中间的集气瓶起到缓冲的作用,使整个实验得到的是比较纯净的氯化氢气体。
3.实验的现象比较明显,有利于教师在课堂上演示,保证实验有序地进行。
案例52氯化氢制备与性质实验改进
氯化氢制备与性质实验改进
传统的实验中氯化氢制取和性质检验是分开的,转移氯化氢的过程中一定程度上造成了气体的消耗,会影响后面喷泉实验的发生,对氯化氢的制备和性质检验进行一体化的实验改进,可以培养学生实验一体化的思想。
酒精灯、分液漏斗、具支烧瓶、圆底烧瓶、集气瓶、烧杯、V形侧泡管、多用滴管;
氯化钠固体、98%浓硫酸、紫色石蕊试剂、蒸馏水、硝酸银溶液、氨水。
1.组装实验仪器并检查气密性。
2.在具支烧瓶中加入NaCl固体,分液漏斗中加入浓硫酸,第一个集气瓶中加入浓硫酸,连接一个直角管将装置分为两条实验路径,第一条路径做喷泉实验,第二条路径做收集和检验氯化氢气体的性质实验。
在第二个集气瓶瓶塞处安装针筒,并在针筒里中加入浓氨水;
在V形侧泡管中的V形管处塞入一团滴有紫色石蕊试液的棉花;
V形侧泡管的凹槽中加入硝酸银溶液,最后通过导管连接一个倒扣的漏斗置于装有水的烧杯中。
3.喷泉实验中,在倒置蒸馏烧瓶瓶塞处安装一个已在滴管头部装有氨水的多用滴管,并将倒置的烧瓶置于装有水的烧杯上方,并在水中加入紫色石蕊试液。
4.实验现象
(1).实验开始,点燃酒精灯并打开分液漏斗,进行氯化氢气体制备实验,切断止水夹2,打开止水夹1,当氯化氢气体收集满时,氯化氢通过V形侧泡管,可以观察到蘸有紫色石蕊试剂的棉花团变为红色,凹槽中产生了白色沉淀,按压针筒,使氨水与氯化氧反应,看到集气瓶中有大量的白烟,多余的HCl用水吸收。
(2).在进行喷泉实验时,切断止水夹1,打开止水2,氯化氢气体直接充入蒸馏烧瓶中,当蒸馏烧瓶内收集满纯净的氯化氢时,多余的氯化氢通过导管进入烧杯中并溶解使水溶液呈酸性,于是紫色石蕊试液逐渐变红。
这时切断止水夹2,打开止水夹1,让多余的氯化氢从收集装置排出并被吸收。
当切断止水夹2后,由于蒸馏瓶中气压恒定,挤压多用滴管,由干氯化氢气体与氨水反应,于是烧杯中的水通过导管被挤压进蒸馏烧瓶,形成漂亮的喷泉。
1.实验一体化,操作方便快捷,节省时间。
2.实验在封闭的状态下进行,避免有刺激性气味的氯化氢气体泄漏造成空气污染。
3.检验氯化氢气体在集气瓶中进行,它与浓氨水反应产生白烟,比起教材中用蘸有浓氨水的玻璃棒靠近氯化氢气体,现象更加明显,便于教学。
4.用氨水代替多用滴管中的水,使氯化氢气体更快溶于其中,更快形成喷泉实验。
5.喷泉实验装置部分同样适用于其他易溶于某种试剂的气体。
案例53氯化氢的制备和性质一体化实验改进(四)
氯化氢的制备和性质