高一化学必修一节总结Word文档下载推荐.docx
《高一化学必修一节总结Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《高一化学必修一节总结Word文档下载推荐.docx(18页珍藏版)》请在冰豆网上搜索。
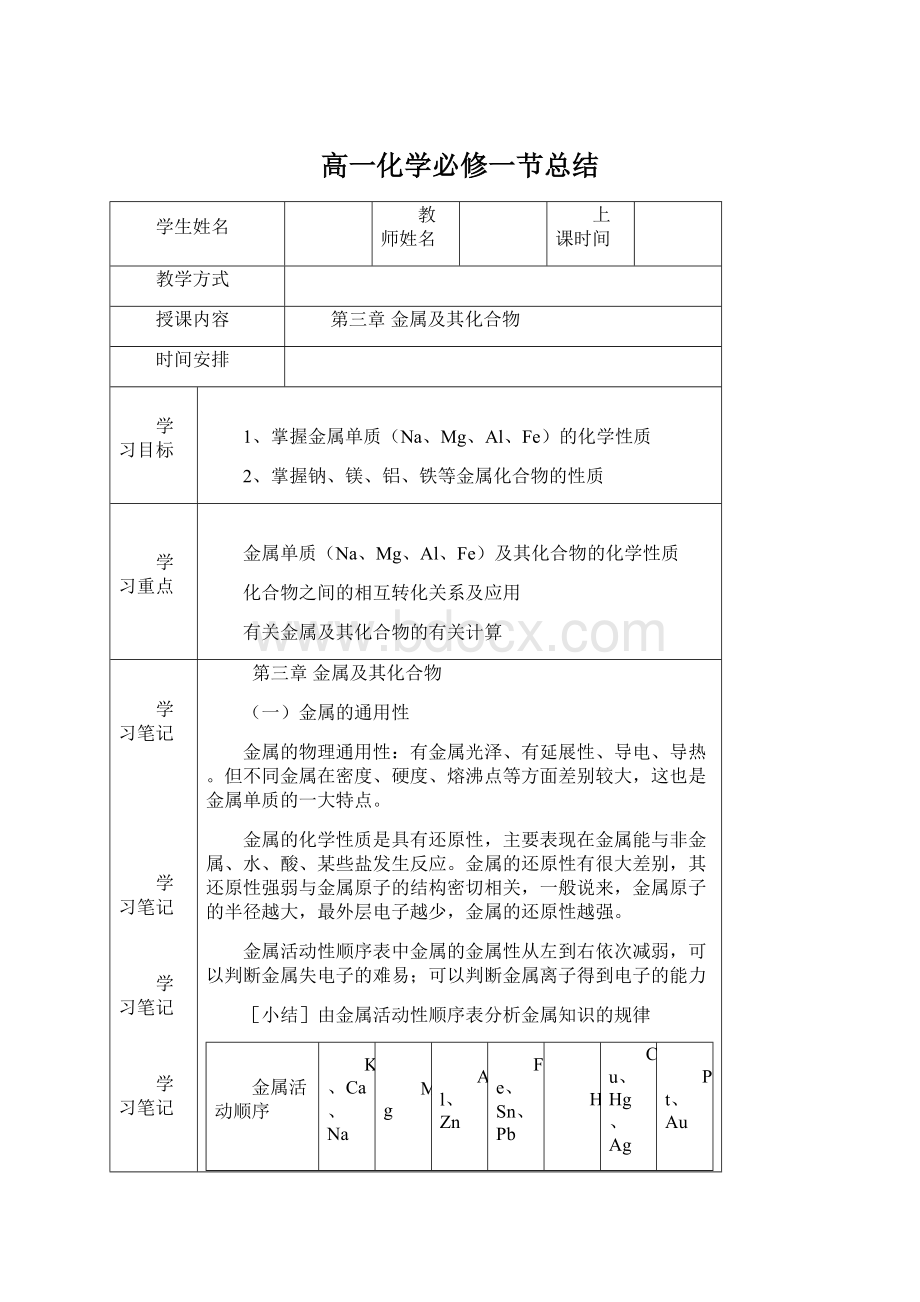
与H2O反应
常温下生成碱和氢气
与热水
反应
有碱存在下与水反应
与高温水蒸气反应
与
生成盐的氢气
与盐溶液的反应
与水反应,不与盐反应,碱与盐反应
排在前面的金属能把排在后面的金属从其盐溶液中置换出来
(二)钠及钠的化合物
1、钠的性质
(1)钠的物理性质:
银白色、质软、比水轻、熔点低
(2)钠的化学性质:
与非金属反应:
2Na+Cl2
2NaCl(白烟)
2Na+S==Na2S
与O2反应:
缓慢氧化:
4Na+O2==2Na2O(白色固体)
剧烈燃烧:
2Na+O2==Na2O2(淡黄色固体)
与H2O反应:
2Na+2H2O==2NaOH+H2↑
(2Na+2H2O==2Na++2OH―+H2↑)
与酸反应:
2Na+2H+==2Na++H2↑
与盐溶液反应:
(先与水作用生成NaOH,NaOH再与盐发生复分解反应)
2Na+2H2O+CuSO4==Cu(OH)2↓+Na2SO4+H2↑
6Na+6H2O+2FeCl3==2Fe(OH)3↓+6NaCl+3H2↑
2Na+2NH4Cl===2NaCl+2NH3↑+H2↑
2、钠的氧化物
氧化钠
过氧化钠
化学式
Na2O
Na2O2
化合价
O(-2)
O(-1)
颜色、状态
白色固体
淡黄色粉末
化学性质
2Na2O+O2==Na2O2
---
CO2
Na2O+CO2==Na2CO3
2Na2O2+2CO2==2Na2CO3+O2↑
H2O
Na2O+H2O==2NaOH
2Na2O2+2H2O==4NaOH+O2↑
HCl
Na2O+2HCl==2NaCl+H2O
2Na2O2+4HCl==4NaCl+2H2O+O2↑
SO2
Na2O+SO2==Na2SO3
Na2O2+SO2==Na2SO4
类别
碱性氧化物
过氧化物
3、碱------氢氧化钠
NaOH,白色固体,易潮解,俗名苛性钠,烧碱,火碱。
一元强碱,具有碱的通性,即:
能与酸反应生成盐和水,例:
NaOH+HCl==NaCl+H2O
能与酸性氧化物反应生成盐和水,例:
2NaOH+CO2==Na2CO3+H2O
能与某些盐发生复分解反应,例:
2NaOH+CuCl2==Cu(OH)2↓+2NaCl
4、盐------碳酸钠和碳酸氢钠
物质
Na2CO3
NaHCO3
俗名
苏打、纯碱
小苏打
白色粉末
水溶性
易溶于水
能溶于水
溶解度大小比较:
Na2CO3>
NaHCO3
溶液与酚酞
变红
颜色深浅比较:
NaHCO3
与盐酸反应
Na2CO3+2HCl==2NaCl+CO2↑+H2O
NaHCO3+HCl==NaCl+H2O
+CO2↑
反应速率:
NaHCO3>
Na2CO3
与氯化钙溶液
Na2CO3+CaCl2==CaCO3↓+2NaCl
(CO32―+Ca2+==CaCO3↓)
-------
与澄清石灰水
Na2CO3+Ca(OH)2==
CaCO3↓+2NaOH
NaHCO3+Ca(OH)2==NaOH+CaCO3↓+H2O
(HCO3―+OH―+Ca2+==CaCO3↓+H2O)
或2NaHCO3+Ca(OH)2==
Na2CO3+CaCO3↓+2H2O
(2HCO3―+2OH―+Ca2+=CaCO3↓+2H2O+CO32―)
与氢氧化钠溶液
-----
NaOH+NaHCO3==Na2CO3+H2O
(OH―+HCO3―==CO32―+H2O)
热稳定性
稳定
2NaHCO
Na2CO3+H2O+CO2↑
相互
转化
Na2CO3NaHCO3:
Na2CO3+CO2+H2O==2NaHCO3
NaHCO3Na2CO3:
NaOH+NaHCO3==Na2CO3+H2O(OH―+HCO3―==CO32―+H2O)
(三)铝的化合物------氧化物与氢氧化物
氧化铝
氢氧化铝
Al2O3
Al(OH)3
物理性质
白色粉末,不溶于水,熔点高,自然界中为无色晶体。
白色固体,不深于水
化
学
性
质
与酸
Al2O3+6HCl==AlCl3+3H2O
(Al2O3+6H+==Al3++3H2O)
Al(OH)3+3HCl==AlCl3+3H2O
(Al(OH)3+3H+==Al3++3H2O)
与碱
Al2O3+2NaOH==2NaAlO2+H2O
(Al2O3+2OH―=2AlO2―+H2O)
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+OH―=AlO2―+2H2O
相互转化
----
2Al(OH)3
Al2O3+3H2O
(四)铁的化合物
1、铁的氧化物
FeO
Fe2O3
Fe3O4
黑色粉末
红棕色粉末
黑色晶体
铁红
磁性氧化铁
不溶
不溶
稳定性
不稳定,在空气里加热迅速被氧化,
氧化物类别
复杂氧化物
与非氧化性酸反应
FeO+2HCl==FeCl2+H2O
(FeO+2H+==Fe2++H2O)
Fe2O3+6HCl==2FeCl3+3H2O(Fe2O3+6H+==2Fe3++3H2O)
Fe3O4+8HCl==2FeCl3+FeCl2+4H2O
Fe3O4+8H+==2Fe3++Fe2++4H2O
2、铁的氢氧化物及Fe2+与Fe3+的转化
二价铁
三价铁
化学式
FeCl2
FeCl3
名称
氯化亚铁
氯化铁
溶液颜色
浅绿色
黄色
与氢氧化钠
现象:
产生白色沉淀,迅速变成灰绿色,最后变成红褐色。
FeCl2+2NaOH==Fe(OH)2↓+2NaCl
4Fe(OH)2+O2+2H2O==4Fe(OH)3
产生红褐色沉淀
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
与KSCN溶液
无现象
产生血红色
Fe3++3SCN-==Fe(SCN)3
氧化(还原性)
主要表现:
还原性,举例:
2FeCl2+Cl2==2FeCl3
表现:
氧化性,举例:
2FeCl3+Fe==3FeCl2
FeCl2FeCl3:
FeCl3FeCl2:
氢氧化亚铁
氢氧化铁
Fe(OH)2
Fe(OH)3
白色固体
红褐色固体
难溶于水
与酸反应
Fe(OH)2+2HCl==FeCl2+2H2O
Fe(OH)2+2H+==Fe2++2H2O
Fe(OH)3+3HCl==FeCl3+3H2O
Fe(OH)3+3H+==Fe3++3H2O
氢氧化亚铁露置空气中
3、铁三角
二、本章典型题剖析
1、滴加顺序不同,实验现象不同
(1)稀Na2CO3溶液与稀盐酸间的反应
向Na2CO3溶液中逐滴加入稀盐酸,开始时无气体产生,达到一定量后才有气泡冒出,由少到多的过程中依次发生下列反应:
Na2CO3+HCl==NaCl+NaHCO3
NaHCO3+HCl==NaCl+CO2↑+H2O
向稀盐酸中逐滴加入稀Na2CO3溶液立即有气泡冒出,由少到多只发生下列反应:
2HCl+Na2CO3==2NaCl+CO2↑+H2O
(2)稀AlCl3溶液与稀NaOH溶液间的反应
向AlCl3溶液中滴加NaOH溶液直至过量时发生的反应依次为:
Al3++3OH―==Al(OH)3↓Al(OH)3+OH―==AlO2―+2H2O
白色沉淀逐渐增多,继续加NaOH溶液沉淀逐渐溶解,直至完全消失。
向NaOH溶液中滴加AlCl3溶液至过量时发生的反应依次为:
Al3++4OH―==AlO2―+2H2OAl3++3AlO2―+6H2O==4Al(OH)3↓
开始时无沉淀,接着产生沉淀,继续滴加AlCl3溶液,沉淀量不变。
(3)稀NaAlO2溶液与稀盐酸间的反应:
向盐酸溶液中滴加NaAlO2溶液,直至过量时发生的反应依次为:
4H++AlO2―==Al3++2H2OAl3++3AlO2―+6H2O==4Al(OH)3↓
开始无沉淀,接着产生白色沉淀,逐渐增多至达到最大值,继续加入NaAlO2溶液,沉淀量不变。
向NaAlO2溶液中滴加盐酸直至过量时发生的反应依次为:
AlO2―+H++H2O==Al(OH)3↓Al(OH)3+3H+==Al3++3H2O
白色沉淀逐渐增多至最大值,继续加盐酸,沉淀逐渐减少,最后完全消失。
三、本章专题讲座――-有关金属及其化合物的有关计算(守恒最为重要)
1、基本计算方法
(1)代数方程组法------解决混合物问题的基本方法
例1将70克由Na2O2和Na2O组成的混合物跟98克H2O充分反应后,所得NaOH溶液中溶质的质量分数为50%,试分别写出Na2O2和Na2O跟H2O反应的化学方程式,并计算原混合物中Na2O2和Na2O的质量。
解:
设混合物中有Na2O2的物质的量为xmol,Na2O的物质的量为ymol
241
x2x0.5x
Na2O+H2O===2NaOH
yy2y
由题意可得,78x+62y=70
解得,x=0.5moly=0.5mol
则混合物中Na2O2的质量为39克,Na2O的质量为31克。
1、今有Na2CO3与NaHCO3混合物1.37克,加热到不再产生气体为止,残余物与足量盐酸反应后,得到CO2气体0.44克,求原混合物中Na2CO3的质量分数为多少?
2、差量法
差量法是依据化学变化前后物质的量的变化,找出所谓“理论差量”,再根据题目提供的“实际差量”列出比例式,求出答案。
数学原理:
例2将一定量H2和CuO10克共热,CuO部分被还原,得到固体粉末质量为8.4克,有多少克Cu生成?
参加反应的H2有多少克?
CuO+H2
Cu+H2O△m
8026480-64==16
yx10-8.4=1.6g
解得x=6.4gy=0.2g
例3加热10克Na2CO3和NaHCO3混合物至质量不再变化,剩余的固体质量为8.4克,求混合物中Na2CO3的质量分数是多少。
2NaHCO3
Na2CO3+H2O↑+CO2↑△m
84*210684*2-106=62
x10-8.4=1.6g
x==4.34g
w(Na2CO3)%==56.6%
1、将CO2气体通过78克Na2O2固体,一段时间后测得固体质量增至92克,求生成O2的质量
2、200℃,11.6克CO2和H2O(g)与足量Na2O2充分反应后,固体质量增加了3.6克,求原混合物气体中CO2、H2O质量各是多少克?
(3)假设法------快速击破选择型计算题
I平均值法
当x<
y<
z时,利用x和z的取值范围,就可判断出y的大小;
或只要求出y的大小,就可判断出x和z的取值范围。
它是解答化学计算题常用的思维方法,也是快速解决选择题的决招。
例4有两种金属组成的混合物粉末10g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成不可能是(A)
A.Fe、ZnB.Al、CuC.Al、MgD.Al、Fe
设金属为二价金属R,其平均分子量为M
R+2HCl==RCl2+H2↑
n(R)==n(H2)==11.2/22.4==0.5mol
M=10/0.5==20g/mol
A(56,65)B(18,∞)C(18,24)D(18,56)故选A
1、两种金属粉末的混合物15克,投入足量的稀盐酸中,得到5.6升氢气(标准状态),这种混合物可能是:
()
A.镁和铁B.镁和铝C.铁和锌 D.镁和铜
2、有碳酸盐组成的混合物9克,加足量稀盐酸,产生4.4克CO2气体,问下列哪种情况合理()
A、CaCO3、Na2CO3B、Na2CO3、K2CO3
C、NaHCO3、Na2CO3D、K2CO3、KHCO3
(4)分类讨论法------研究过量问题
例6NaOH、NaHCO3固体混合物16.6克,在密闭容器中加热到250℃,经充分反应排出气体,冷却,称得剩余固体质量为13.25克。
求原混合物中NaOH的质量分数
假设二者恰好完全进行时,质量减少W克。
NaOH+NaHCO3
Na2CO3+H2O↑△m(-)
40+8418
16.6W
W==2.4g
实际减轻了16.6-13.5==3.35>
2.4
故NaHCO3过量
设NaOH为xmol,NaHCO3为ymol
40x+84y==16.6
NaOH+NaHCO3
Na2CO3+H2O↑
111
xxx
2NaHCO3
Na2CO3+H2O↑+CO2↑
211
y-x0.5(y-x)
18*(0.5y-0.5x+x)+44(y-x)==3.35
解得x=0.1mol,y=0.15mol
w(NaOH)%==24.1%
1、今有120mL1mol/L的Na2CO3溶液和80mL2.5mol/L的盐酸。
(1)若将Na2CO3溶液逐滴加至盐酸中则可收集到标况下的CO2气体体积为______
n(Na2CO3)==0.12*1=0.12moln(HCl)=0.08*2.5=0.2mol
若将Na2CO3加到盐酸中,则立即生成CO2直至盐酸完全反应,即:
Na2CO3+2HCl==2NaCl+CO2↑+H2O
121
0.2X
X=0.1mol
则在标况下收集到CO2气体体积为2.24L
(2)若将上述盐酸逐滴加至碳酸钠溶液中,则反应的离子方程式是______,当反应完全时,测得CO2在水中的浓度为0.04mol/L,假设溶液体积不变,则收集到的CO2在标况下的体积为______
若将HCl滴加到Na2CO3溶液中,直至所有的Na2CO3全部转化为NaHCO3再继续加盐酸才有CO2生成,即:
Na2CO3+HCl==NaHCO3+NaCl
0.120.120.12
则剩余盐酸为0.2-0.12=0.08mol
NaHCO3+HCl==NaCl+H2O+CO2↑
0.080.08
溶液体积V=120+80=200mL
溶液中的CO2为0.04*0.2=0.008mol
则逸出的CO2体积为:
22.4*(0.8-0.08)=16.128L
(5)守恒法
例7有一空气暴露过的NaOH固体,经分析知其含H2O7.65%,含Na2CO34.32%,其余是NaOH。
若将1克该样品放入含有HCl3.65克的盐酸中使其完全反应后,残酸再用50克2%的NaOH溶液恰好中和反应,蒸干溶液,所得固体的质量是多少克?
所得固体是NaCl,是5.85克
[小结]本题数据众多,反应物不纯,过程复杂。
若按常规方法,一步步分析计算,不但费时还易出错,若认真分析就会发现,最后所得固体物质NaCl中全部的Cl全来自于HCl中的Cl
1、有5.1gMg–Al合金,投入500mL2mol/LHCl中,金属完全溶解后,又加4mol/LNaOH溶液VmL,得最多沉淀8.6g,则V等于
A.425mLB.560mLC.250mLD.500mL
2、铝三角转化及铝的图像问题
(1)向Al3+的溶液中加入强碱(OH―)
先出现白色溶液后消失
方程式:
Al3++3OH―==Al(OH)3↓Al(OH)3+OH―==AlO2―+H2O
图像:
(2)向强碱溶液中加入Al3+
先没有沉淀后出现并不消失
Al3++4OH―==AlO2―+2H2O
3AlO2―+Al3++6H2O==4Al(OH)3↓
(3)向AlO2―溶液中加入H+
先生成白色沉淀,然后白色沉淀逐渐溶解。
AlO2―+H++H2O==Al(OH)3↓
Al(OH)3+3H+==Al3++3H2O
(4)向H+溶液中加入AlO2―
开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解
AlO2―+4H+==Al3++2H2O
例1、有一定质量的Mg、Al合金投入100mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5mol/LNaOH溶液到过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示,求
(1)原合金中Mg、Al的质量各是多少?
(2)HCl的浓度是多少?
(1)设原合金中Mg的质量为X,Al的质量为y
Mg-----Mg(OH)2Al-----Al(OH)3
24582778
x11.6y19.4-11.6==7.8
x=4.8gy==2.7g
(2)当沉淀达到最大值时,则n(HCl)==n(NaOH)
则c(HCl)==5*160/100=8mol/L
1、0.1molAl2(SO4)3跟2mol/LNaOH溶液350mL混合,所得沉淀的质量为()
A.78gB.15.6gC.7.8gD.3.9g
3、铁的转化关系
(1)铁三角应用
例1、在FeCl3、CuCl2和HCl的混合液中加入Fe粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是()
A、Cu2+B、Fe3+C、Fe2+D、H+
(2)铁与稀HNO3反应规律
当稀HNO3过量时,Fe+4HNO3==Fe(NO3)3+NO↑+H2O
若铁过量,则在上述反应基础上,继续反应,
Fe+2Fe(NO3)3==3Fe(NO3)2
当铁粉过量时,3Fe+8HNO3==3Fe(NO3)2+2NO↑+4H2O
根据Fe与HNO3的物质的量的变化,可分为以下三种情况:
≦1/4时,产物为Fe(NO3)3
≧3/8时,产物为Fe(NO3)2
若1/4≦
≦3/8时,产物为Fe(NO3)3与Fe(NO3)2的混合物
但需要注意的是,无论Fe过量与否,被还原的HNO3占总消耗的HNO3的1/4
1、已知有关物质及离子的氧化性顺序为:
浓硫酸>Fe3+>H+。
现将30g铁粉(过量)与44.0mL浓硫酸在加热条件下充分反应,共收集到11.2L(标准状况)气体,其质量为19.6g。
试计算:
1)浓硫酸的物质的量浓度;
(2)反应后剩余铁粉的质量。
设参加反应的铁粉的物质的量为x,由题意知,混合气体的成分应为SO2、H2的混合气,物质的量总和为11.2L/22.4L·
mol-1=0.5mol,则混合气体的平均摩尔质量为:
19.6g÷
0.5mol=39.2g·
mol-1
所以,混合气体中的SO2、H2体积比(即物质的量之比)为:
37.2∶24.8=3∶2,即生成的SO2、H2的物质的量分别为0.3mol和0.2mol。
Fe-2e-——→Fe2+
H2SO4+2e-——→SO2
2H++2e-——→H2
根据电子守恒原理可得:
2x=0.3mol×
2+0.2mol×
2=1.0mol
解得:
x=0.5mol
实际参加反应的铁粉质量为0.5mol×
56g·
mol-1=28g,由质量守恒原理知剩余铁粉质量为30g-28g=2g。
[总结]涉及铁元素及其化合物的计算题很多,解这类题时,建议解题者首先考虑“守恒”原理的应用,具备“守恒意识”是快速准确解答此类题的关键,因为大部分情况下,发生在溶液中的反应均具备上述诸种守恒关系。