学年高中化学 第四章 非金属及其化合物 第4节 氨 硝酸 硫酸作业 新人教版必修1文档格式.docx
《学年高中化学 第四章 非金属及其化合物 第4节 氨 硝酸 硫酸作业 新人教版必修1文档格式.docx》由会员分享,可在线阅读,更多相关《学年高中化学 第四章 非金属及其化合物 第4节 氨 硝酸 硫酸作业 新人教版必修1文档格式.docx(10页珍藏版)》请在冰豆网上搜索。
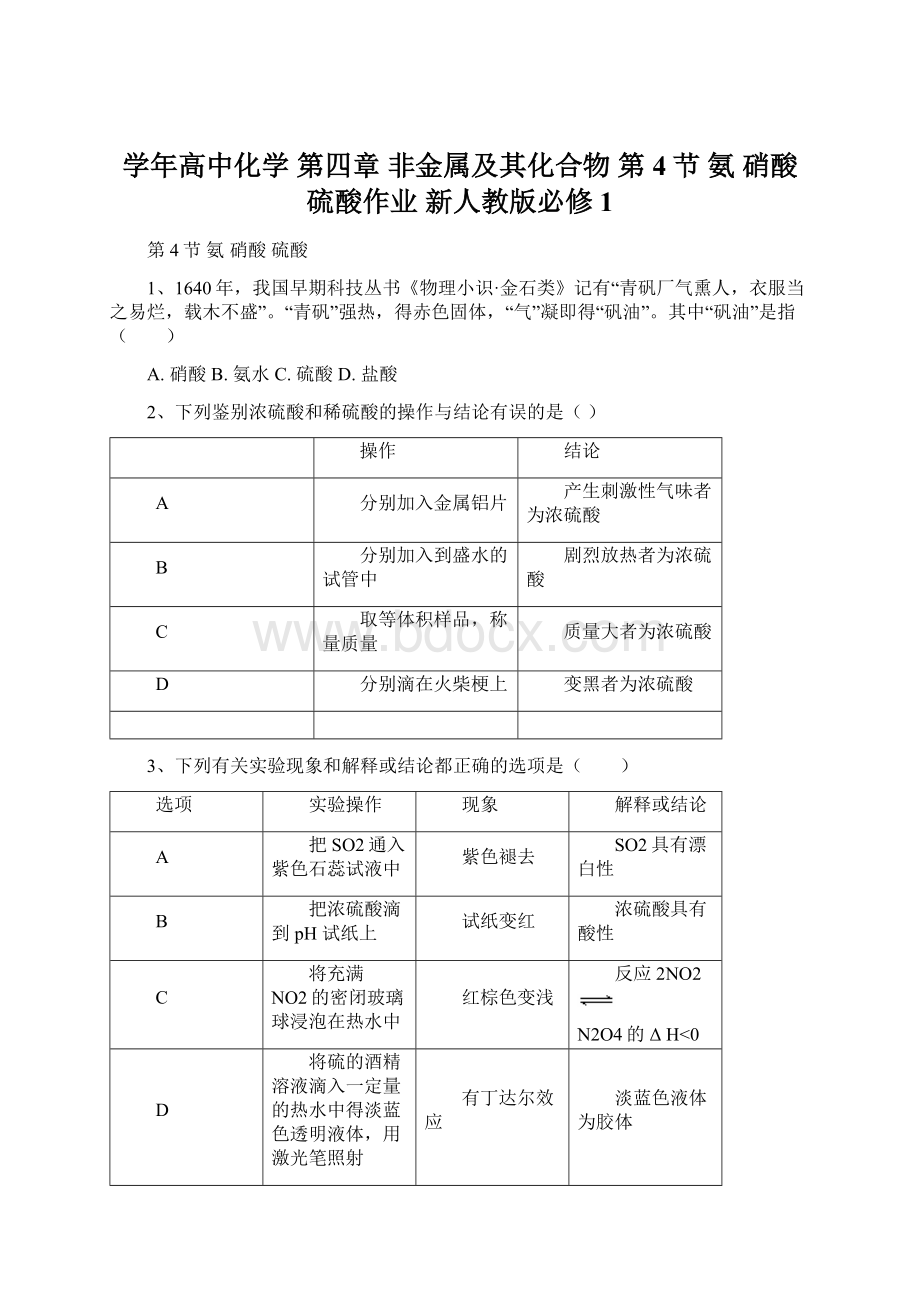
解释或结论
把SO2通入紫色石蕊试液中
紫色褪去
SO2具有漂白性
把浓硫酸滴到pH试纸上
试纸变红
浓硫酸具有酸性
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变浅
反应2NO2
N2O4的ΔH<
将硫的酒精溶液滴入一定量的热水中得淡蓝色透明液体,用激光笔照射
有丁达尔效应
淡蓝色液体为胶体
4、工业制硫酸的适宜条件不包括()
A.矿石粉碎成粉末可加快反应速率B.原料气进入接触室之前需净化处理
C.SO2转化为SO3时用铁触媒作催化剂D.用98.3%的浓硫酸吸收SO3
5、分子式为C5H11O2N的同异构体中,属于а—氨基酸的有
A.2种B。
3种C.4种D.5种
6、将碳酸氢铵在试管中加热,放出的气体依次通过足量的过氧化钠试管、足量浓硫酸的洗气瓶,最后得到的气体是()
A、氨气B、氧气C、水蒸气D、二氧化碳
7、向25mL12.0mol·
L-1浓硝酸中加入足量的铜,充分反应后共收集到标准状况下2.24L.NO和NO2的混合气体(不考虑NO2与N2O4的相互转化),则参加反应的铜的质量为( )
A.3.2gB.6.4gC.12.8gD.19.2g
8、下列有关“钝化”现象的描述错误的是()
A.钝化现象属于化学现象中的氧化还原反应
B.中学化学中,只有Fe和浓硫酸之间才能发生钝化
C.钝化现象是在常温下发生的,加热后可能反应更剧烈
D.钝化的本质是反应生成致密的氧化膜阻止了进一步反应
9、下列有关物质的性质与用途具有对应关系的是( )
A.SiO2可溶于烧碱,烧碱可以用于玻璃雕花
B.CaO2能缓慢与水反应产生02,可用作水产养殖中的供氧剂
C.铝具有良好导热性,可用铝罐贮运浓硝酸
D.FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂
10、宋应星所著《天工开物》被外国学者誉称为“17世纪中国工艺百科全书”。
下列说法不正确的是( )
A.“凡白土日垩土,为陶家精美启用”中“陶”是一种传统硅酸盐材料
B.“每红钢六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜”中的“黄铜”是合金
C.“烧铁器淬于胆矾水中,即成铜色也”,该过程中反应的类型为置换反应
D.“凡火药,硫为纯阳,硝为纯阴”中“硫”指的是硫黄,“硝“指的是硝酸
11、下列有关物质的性质与用途具有对应关系的是( )
A.浓硫酸具有脱水性,可用于干燥气体
B.FeCl3溶液水解呈酸性,可用作铜制线路板的蚀刻剂
C.铜比铝活动性弱,可用铜罐代替铝罐贮运浓硝酸
D.ClO2具有强氧化性,可用于消毒杀菌
12、一定量的CuS和Cu2S的混合物投入足量的HNO3溶液中,收集到气体V(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH溶液,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1:
1,则V可能为( )
A.9.0LB.13.5LC.15.7LD.16.8L
13、下列说法中不正确的是()
A.浓硫酸能与铜反应释放出氢气
B.浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫
C.浓硫酸具有吸水性,在实验中常用做干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
14、下列关于浓硫酸和浓硝酸的叙述中错误的是()
A.加热时两者都能与铜发生反应
B.两者都具有较强的氧化性
C.浓硫酸能使蔗糖等有机物炭化,浓硝酸不能
D.浓硝酸与浓盐酸按质量比为1:
3混合可得王水
15、下列贮存试剂的方法错误的是()
A.FeCl3溶液加入少量铁粉保存
B.常温下,浓硝酸保存在铁器皿中
C.烧碱溶液保存在带橡胶塞的试剂瓶中
D.小块钠保存在煤油中
16、一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧、得到CuO24.0g,若上述气体为NO和NO2的混合物,且体积比为1:
2。
则V可能为( )
A.9.0LB.18.5LC.25.7LD.36.8L
17、化学反应中,物质的用量不同或浓度不同或反应条件不同会对生成物产生影响。
下列反应的生成物不受反应物的用量或浓度或反应条件影响的是( )
A.二氧化硫与氢氧化钠溶液反应
B.钠与氧气的反应
C.铁在硫蒸气中燃烧
D.铁粉加入硝酸中
18、化学与生产、生活、社会密切相关,下列有关说法中正确的是()
A.氯气和明矾都能用于自来水的杀菌消毒
B.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
C.洗涤剂除油污的原理与热碱液除油污的原理相同
D.浓硫酸和浓硝酸在常温下都能用铝制容器运输
19、成语是中国文化的魂宝。
下列成语涉及的金属在常温下不溶于浓硝酸的是()
A.铜壳滴漏B.化铁为金C.火树银花D.书香铜臭
20、一定体积的18mol/L的硫酸中加入过量铜片,加热,被还原的硫酸为0.9mol,则浓硫酸的实际体积为( )
A.等于50mLB.大于50mLC.等于100mLD.大于100mL
21、一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.9.0LB.13.5L
C.15.7LD.16.8L
22、2001年1月,某地发生了导致四人死亡、一百多人中毒的食用熟牛肉中毒事件,经过对该牛肉的检测,发现某盐的含量比国家允许标准高800多倍,该盐可能是( )
A.NaClB.NaNO3
C.NaNO2D.BaSO4
23、某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等。
有人设计了如图所示的工艺流程,利用常用的酸、碱和工业生产中的废铁屑从废水中回收金,并生成一定量的铁红和氧化铜。
请回答下列问题:
(1)图中标号处需加入的相应物质:
①_________、②_________、③_________、④_________、
⑤_________。
(2)写出①处发生反应的所有离子方程式:
______________________________________________________________________;
______________________________________________________________________。
写出③处发生反应的化学方程式:
______________________________________
(3)铁红的化学式为________。
24、缬氨酸是一种中性的a-氨基酸,相对分子质量是117,经分析测得含氧为27.35%,每个缬氨酸分子中,碳原子数是氧原子数的2倍多1,氢原子数是碳原子数的2倍再多1,则缬氨酸的分子式为_______,若缬氨酸分子中非碳原子上连有一个支链,则它的结构简式为_______,用系统命名法加以命名为_______。
25、已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系.
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为,若反应放出1.12L气体(标准状况下),则被还原的B物质的量为mol.
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式;
实验室检验C的方法为.
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为.若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为.
参考答案
1、【答案】C
【解析】解:
本题考查氧化还原反应及物质的性质。
2、【答案】A
3、【答案】D
把SO2通入紫色石蕊中,石蕊溶液变为红色,故A错误;
把浓硫酸滴到pH试纸上,PH试纸最终变为黑色,体现浓硫酸脱水性,故B错误;
2NO2
N2O4ΔH<
0,将充满NO2的密闭玻璃球浸泡在热水中,平衡逆向移动,红棕色加深,故C错误;
胶体能产生丁达尔效应,故D正确。
4、【答案】C
【解析】A、矿石粉碎成粉末,接触面积增大,可以加快化学反应速率,选项A正确;
B、原料气进入接触室之前需净化处理,减少杂质,选项B正确;
C、SO2转化为SO3时用钒触媒作催化剂,选项C错误;
D、工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,选项D正确。
答案选C。
5、【答案】B
6、【答案】B
7、【答案】B
25mL、12.0mol·
L-1浓硝酸中含硝酸0.3mol,与足量的铜充分反应后共收集到标准状况下2.24L.NO和NO2的混合气体(不考虑NO2与N2O4的相互转化),则被还原的硝酸为0.1mol、未被还原的硝酸为0.2mol,所以生成物硝酸铜的物质的量为0.1mol,则参加反应的铜的物质的量为0.1mol,其质量为6.4g,B正确,本题选B。
8、【答案】B
A.浓硫酸和浓硝酸均具有强氧化性,所以钝化现象属于化学现象中的氧化还原反应,A正确;
B.中学化学中,Al、Fe和浓硫酸以及浓硝酸在常温下可以发生钝化,B错误;
C.钝化现象是在常温下发生的,加热后可能反应更剧烈,例如加热时浓硝酸与铁可以反应,C正确;
D.钝化的本质是反应生成致密的氧化膜阻止了进一步反应,D正确,答案选B。
9、【答案】B
本题考查物质的性质及用途。
A、玻璃雕花用HF,故A错误;
B、CaO2能缓慢与水反应产生O2,发生CaO2+2H2O=Ca(OH)2+O2↑,可用作水产养殖中的供氧剂,故B正确;
C、铝在常温下能被浓硫酸、浓硝酸钝化,可用铝罐贮运浓硝酸,故C错误;
D、FeCl3溶液具有氧化性,可用作铜制线路板的蚀刻剂,故D错误;
故选B。
10、【答案】D
【解析】解:
A、陶瓷是传统硅酸盐材料,属于无机非金属材料,选项A正确;
B、黄铜是铜锌合金,选项B正确;
C、该过程中反应为铁与硫酸铜反应生成硫酸亚铁和铜,反应类型为置换反应,选项C正确;
D、“凡火药,硫为纯阳,硝为纯阴”中“硫”指的是硫黄,“硝”指的是硝酸钾,选项D不正确。
答案选D。
11、【答案】D
浓硫酸具有吸水性,可用于干燥气体,故A错误;
FeCl3用作铜制线路板的蚀刻剂是FeCl3具有氧化性,故B错误;
铜与浓硝酸能反应,所以不能用铜罐代替铝罐贮运浓硝酸,故C错误;
ClO2具有强氧化性,可用于自来水的消毒杀菌,故D正确。
12、【答案】A
若混合物全是CuS,其物质的量为12/80=0.15mol,电子转移数0.15mol×
(6+2)=1.2mol。
两者体积相等,设NOxmol,NO2xmol,3x+x=1.2,计算的x=0.3。
气体体积V=0.6mol×
22.4L·
mol-1=13.44L;
若混合物全是Cu2S,其物质的量为0.075mol,转移电子数0.075mol×
10=0.75mol,设NOxmol,NO2xmol,3x+x=0.75,计算得x=0.1875,气体体积V=0.375mol×
mol-1=8.4L,因此8.4L<V<13.44L。
13、【答案】A
A.浓硫酸具有强的氧化性与金属反应不产生氢气,反应方程式为:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故A错误;
B.浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫,方程式为:
C+2H2SO4(浓)
CO2↑+SO2↑+2H2O,故B正确;
C.浓硫酸具有吸水性,所以实验中常用作干燥剂,故C正确;
D.冷的浓硫酸遇铁铝发生钝化,生成一层致密的氧化膜,阻止反应的进行,故D正确;
故选A。
14、【答案】D
A.加热时浓硫酸与铜反应生成硫酸铜、二氧化硫和水,浓硝酸与铜反应生成硝酸铜、二氧化氮和水,选项A正确;
B.两者都具有较强的氧化性,都属于氧化性酸,选项B正确;
C.浓硫酸具有脱水性,能使蔗糖等有机物炭化,浓硝酸不能,选项C正确;
D.浓硝酸与浓盐酸按体积比为1:
3混合可得王水,选项D错误。
15、【答案】A
A、FeCl3能与铁反应生成FeCl2,选项A错误;
B、常温下,浓硝酸能使铁钝化而阻止反应进一步进行,故能保存在铁器皿中,选项B正确;
C、玻璃中含有二氧化硅,易与NaOH溶液反应生成具有黏性的硅酸钠,盛NaOH溶液的试剂瓶应用橡皮塞,选项C正确;
D、钠的密度比煤油大,小块钠保存在煤油中,防止与空气中的水或氧气反应,选项D正确。
答案选A。
16、【答案】C
24gCuO的物质的量是0.3mol;
若固体全是CuS,根据铜元素守恒,CuS的物质的量是0.3mol;
CuS失电子的物质的量是0.3mol×
8=2.4mol;
设NO的物质的量是xmol,NO2的物质的量是2xmol,根据电子守恒x×
3+2x×
1=2.4,x=0.5mol,V=(0.5+1)×
22.4=33.6L;
若固体全是Cu2S,根据铜元素守恒,Cu2S的物质的量是0.15mol;
Cu2S失电子的物质的量是0.15mol×
10=1.5mol;
1=1.5,x=0.3mol,V=(0.3+0.6)×
22.4=20.16L;
所以V可能为25.7L,故C正确。
17、【答案】C
A、二氧化硫与氢氧化钠溶液反应,产物与二氧化硫有关,二氧化硫少量反应生成亚硫酸钠,二氧化硫过量反应生成亚硫酸氢钠,故A不选;
B、钠在氧气中燃烧生成过氧化钠,在空气中放置生成氧化钠,产物与反应条件有关,故B不选;
C、铁与硫反应生成硫化亚铁,产物不受反应物的用量或浓度或反应条件影响,故C选;
D、铁粉与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,产物与硝酸浓度有关,故D不选;
故选C。
18、【答案】D
本题考查物质的性质及应用。
19、【答案】B
本题考查金属及硝酸的性质。
20、【答案】D
【解析】试题分析:
铜浓硫酸反应的化学方程式是Cu+2H2SO4(浓)
CuSO4+2H2O+SO2↑,由于随着反应的进行,硫酸的浓度降低,而稀硫酸不能和铜反应。
所以如果被还原的硫酸为0.9mol,则根据方程式可知参加反应的硫酸应该大于1.8mol,即浓硫酸的体积大于100ml,答案选D。
考点:
考查浓硫酸和铜反应的有关计算
点评:
该题是中等难度的试题,试题注重基础,侧重能力的考查和解题方法的培养。
该题的关键是明确随着反应的进行,硫酸的浓度降低,而稀硫酸不能和铜反应,有利于培养学生的发散思维能力。
21、【答案】A
mol-1=8.4L,因此8.4L<V<13.44L。
22、【答案】C
亚硝酸钠常用于鱼类、肉类等食品的发色剂和防腐剂,但它可使血液中的低价铁血红蛋白氧化成高价铁血红蛋白,失去运输氧的功能,人若食用亚硝酸钠(NaNO2)严重超标的牛肉后,轻者嘴唇、手指甲发紫,重者中毒,直至窒息死亡,某地发生了导致四人死亡、一百多人中毒的食用熟牛肉中毒事件,应该为NaNO2超标,答案选C。
23、【答案】
(1)①废铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠(其他合理答案均可)
(2)Fe+2H+===Fe2++H2↑ 2Fe3++Fe===3Fe2+ Cu2++Fe===Cu+Fe2+ 2Au3++3Fe===2Au+3Fe2+ 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3
24、【答案】C5H11O2N,
a-氨基-β-甲基丁酸;
25、【答案】
(1)2NO3﹣+3Cu+8H+=2NO↑+4H2O+3Cu2+;
0.05;
(2)2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气);
(3)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
试纸变为蓝色.
本题考查无机物的推断.A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,则E为H2O,
(1)A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,则A为Cu,B为稀硝酸,C为NO,D为硝酸铜,反应的离子反应为2NO3﹣+3Cu+8H+=2NO↑+4H2O+3Cu2+,反应中若有2个硝酸被还原,则生成2个NO,所以若反应放出1.12L气体(标准状况下),则被还原的B物质的量为
=0.05mol,故答案为:
2NO3﹣+3Cu+8H+=2NO↑+4H2O+3Cu2+;
0.05;
(2)C是一种无色、刺激性气味、密度比空气小的气体,则C为NH3,实验室利用铵盐与熟石灰反应制备氨气,该反应为2NH4Cl+Ca(OH)2
检验方法为把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气),
故答案为:
2NH4Cl+Ca(OH)2
(3)B是黄绿色有毒气体,则B为Cl2,实验室利用氢氧化钠溶液吸收氯气尾气,所以反应的离子方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
因为氯气具有氧化性,则用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为试纸变为蓝色,故答案为:
Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;