化验规程Word格式文档下载.docx
《化验规程Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《化验规程Word格式文档下载.docx(59页珍藏版)》请在冰豆网上搜索。
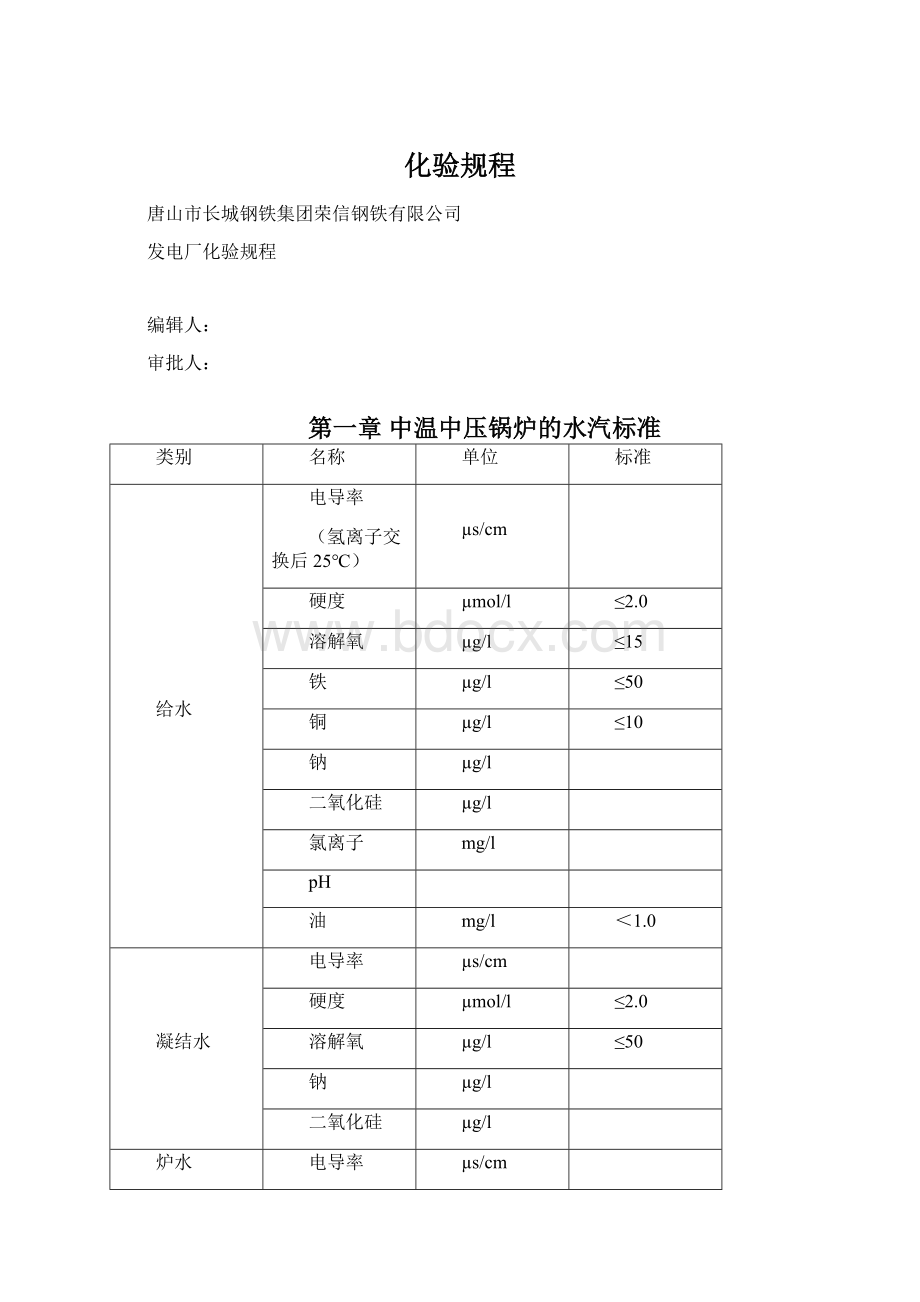
饱和蒸汽
g/kg
≤20
≤5
过热蒸汽
疏水
≤5.0
生产回水
≤100
≤1
补给水
≤0.30
≈0
第二章标准溶液的配制与标定
一、实验室用水规格及检验
1.实验室符合表一的规定:
GB6682—92
表一:
指标名称
一级
二级
三级
PH值范围(25℃)
——
5.0~7.5
电导率(25℃)ms/m≤
0.01
0.1
0.50
可氧化物质(以O计),mg/l<
—
0.08
0.4
吸光度(254mm,1cm光柱≤
0.001
蒸发残渣(105℃±
2)mg/l≤
1.0
2.0
可溶性硅(以SiO2计)mg/l<
0.02
实验室用三级水PH,电导率测定参照酸度和电导率仪使用说明测定。
1)可氧化物质限量试验:
试剂:
硫酸溶液:
20%;
高锰酸钾标准溶液:
C(1/5KMnO4)=0.01mol/l
操作步骤:
量取200ml三级水,注入烧杯中,加入1.0ml硫酸溶液(20%),混匀,加入1.00ml高锰酸钾标准溶液C(1/5KMnO4)=0.01mol/l,混匀,盖上表面皿,加热至沸保持5分钟,溶液的粉红色不得完全消失,若此时溶液呈粉红色,则可氧化物质小于0.4mg/l。
2)蒸发残渣的测定:
量取三级水500ml,将水样分几次加入到蒸馏瓶中,于水浴上减压蒸发(避免蒸干)。
待水样最后蒸至约50ml,停止加热,将水样转移至一个已于105±
2℃恒重的烧杯中,并用5~10ml水样分2次冲洗蒸馏瓶,将洗液与水样合并,于水浴上蒸干,并在105±
2℃的烘箱中干燥至恒重,残渣质量不得大于1.0mg/l。
2.蒸馏水制纯水须进行下列检验:
a)阳离子的检验:
取水样10ml于试管中,加2—3滴氨缓冲溶液(PH=10),2—3滴铬黑T指示剂,如水样呈蓝色,表明无金属阳离子,含有阳离子的水样呈现紫红色。
b)氯离子的检验:
取水样10ml于试管中,加入数滴AgNO3水溶液,摇匀,在黑色背景下看溶液是否变白色混浊,如无氯离子,则应为白色透明。
c)PH检验:
酸度计法。
d)试剂与溶液:
i.PH=10氨缓冲溶液:
称取54.0g氯化铵溶于200ml水中,加入350ml浓氨水,用水稀释至1L.
ii.AgNO3溶液:
称取1.7gAgNO3溶于水,加浓HNO34ml,用水稀释至100ml。
iii.铬黑T指示剂:
(5g/l)称取0.50g铬黑T和2.0g盐酸羟胺,溶于95%乙醇稀释到100ml。
二、滴定分析用标准溶液的制备:
(一)制备标准溶液的一般规定:
1.本标准中所用的水,在没有注明其他要求时,应符合GB6682中三级水的规格。
2.本标准中所用试剂的纯度在分析纯以上。
3.工作中所用分析天平的砝码、滴定管、容量瓶及移液管均需定期校正。
4.本标准中标定时所用的基准试剂为容量分析工作基准试剂;
制备标准溶液时所用的试剂为分析纯以上试剂。
5.本标准中所制备的标准溶液的浓度均指20℃时的浓度,在标定和使用时,如温度有差异,应按附录(补充值)补正。
6.“标定”或“比较”标准溶液浓度,平等试验不得少于8次,两人各做四次平行,每人四平等测定的极差与平均值之比不得大于0.1%,两人测定结果平均值之差不得大于0.1%,结果取平均值,浓度值取四位有效数字。
7.本标准中凡规定用“标定”和“比较”两种方法测定浓度时,不得略去其中任何一种,且两种方法测得的浓度之差不得大于0.2%,以标定结果为准。
8.制备标准溶液与规定浓度相对误差不得大于5%。
9.配制浓度等于或低于0.02mol/l标准溶液时,应于临用前将浓度高的标准溶液用煮沸并冷却的水稀释,必要时重新标定。
10.滴定分析(容量分析)用标准溶液在常温(15—25℃)下,保存时间一般不得超过两个月。
(二)标定标准溶液所用工作基准及其干燥条件:
1.工作基准条件:
纯度高;
摩尔质量大;
化学稳定性好;
化学式和化学组成相同。
2.工作基准的种类及干燥条件:
见下表:
标准溶液
基准试剂
基准试剂干燥条件
终点判断
盐酸、硫酸
无水碳酸钠
270~300℃
甲基红—溴甲酚绿
氢氧化钠
邻苯二甲酸氢钾
105~110℃
酚酞
DETA
氧化锌
800℃
铬黑T
硝酸银
氯化钠
500~600℃
二氯荧光黄
硫代硫酸钠
重铬酸钾
120℃
淀粉
碘
三氧化二砷
硫酸干燥器
高锰酸钾
草酸钠
自身指示剂
(三)标准溶液的配制与标定方法:
1.标准溶液的配制方法:
a.直接配制法
b.间接配制法
1)直接配制法:
准确称取(称准至0.0001g)一定量基准物,溶解并稀释至准确体积,根据计算求出该标准溶液的准确浓度。
通常:
C(1/6K2Cr2O7)=0.1000mol/l
C(AgNO3)=1/35.5mol/l
C(AgNO3)=5/35.5mol/l
C(AgNO3)=0.0192mol/l
以上几种规格标准浓度溶液采用直接法配制。
2)间接配制法
首先配制一近似所需浓度的溶液,然后用基准物或已知浓度的标准溶液来确定其准确浓度。
1.标准溶液的标定方法:
1)用基准物标定。
2)用准确浓度的标准溶液来标定。
2.标准溶液标定时浓度的调整公式:
标准溶液在配制时:
由于体积估计不准,试剂不纯,配制的溶液标定后,其浓度与要求配制的溶液浓度,有配浓或配稀的现象,因此,须对所配制溶液进行浓度调整。
a.浓加水
若配制的标准溶液浓度大于所要求的浓度时地,需将原溶液进行加水稀释,加水量按下式计算:
V水(ml)=(C1-C0)×
V/C
式中:
C1—所配制标液的浓度,mol/l;
C0—要求配制标液的浓度,mol/l;
V—所配制标准溶液的总体积,ml;
V水—浓加水的体积,ml。
b.稀加浓
若所配制的标准溶液浓度小于所要求的标准溶液浓度时,要将原溶液进行加浓调整,加浓方法有两种:
1)用浓溶液调整,需加浓溶液体积按下式计算:
V浓ml=(C0-C实际)×
V
C浓-C0
C0—要求配制标液的浓度mol/l
C实际—所配制标液的实际浓度mol/l
C浓—所加贮备液或浓溶液的浓度mol/l
V—所配标液的总体积ml
2)加固体试剂调整,需加固体试剂质量按下式计算:
m=(C0-C实际)×
V×
MB
m—加固体试剂的质量g
C实际—所配标液的浓度mol/l
V—要求配制标液总体积ml
MB固体试剂B的摩尔质量g/mol
三、标准溶液的配制与标定
依据国标(GB601-88)
(一)酸标准溶液的配制与标定
1.盐酸标准溶液
C(HCL)=1mol/lC(HCL)=0.5mol/l
C(HCL)=0.2mol/lC(HCL)=0.1mol/l
1)配制:
量取下述规定体积的盐酸,注入1000ml水中,摇匀.
C(HCL)mol/l盐酸ml
190
0.545
0.218
0.19
2)标定:
a)原理:
用基准无水碳酸钠与盐酸进行中和反应(以溴甲酚绿-甲基红(3+1)混合指示剂)根据碳酸钠质量和消耗酸的体积计算酸的浓度
Na2CO3+2HCL=2Nacl+H2co3
H2o+Co2
b)测定方法:
称取下述规定量的270~300℃灼烧至恒重的基准无水碳酸钠;
称准至0.0001g,溶于50ml水中,加入10滴溴甲酚绿—甲基红混合指示剂,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2分钟,冷却后继续滴定溶液再呈暗红色,同时作空白试验。
C(HCl)mol/l基准无水碳酸钠g
11.6
0.50.8
0.20.3
0.10.2
c)溴甲酚绿—甲基红(3+1)混合指示剂配制:
溴甲酚绿指示剂:
1g/l。
称取0.10g溴甲酚绿溶于95%乙醇,用95%乙醇稀释至100ml。
甲基红指示剂:
2g/l。
称取甲基红0.20g,溶于95%乙醇,用95%乙醇稀释至100ml。
溴甲酚绿—甲基红混合指示剂(3+1):
将溴甲酚绿乙醇溶液与甲基红乙醇溶液按(3+1)体积比混合,摇匀。
d)计算:
盐酸标准溶液按下式计算:
C(HCl)=m/(V1-V2)×
0.05299
C(HCl)—盐酸标准溶液的物质的量浓度,mol/l;
M—无水碳酸钠的质量,g;
V1—盐酸溶液的用量,ml;
V2—空白试验盐酸溶液的用量,ml;
0.05299—与1.00ml盐酸相当的以克表示的无水碳酸钠的质量。
3)比较:
a)测定方法:
另取30.00~35.00ml下述配制好的盐酸溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用下述规定浓度的氢氧化钠标准溶液,滴定近终点时加热至80℃,继续滴定至溶液呈粉红色。
C(HCl)mol/lC(NaOH)mol/l
11
0.50.5
0.20.2
0.10.1
b)计算:
盐酸标准溶液浓度按下式计算:
C(HCl)=C1·
V1/V
C(HCl)——盐酸标准溶液的物质的量浓度,mol/l;
V1——氢氧化钠标准溶液用量,ml;
C1——氢氧化钠标准溶液的物质的量浓度,mol/l.
V——盐酸溶液的用量,ml。
2.硫酸标准溶液:
C(1/2H2SO4)=1mol/lC(1/2H2SO4)=0.5mol/lC(1/2H2SO4)=0.1mol/l
1)配制:
量取下述规定体积的硫酸缓缓注入1000ml水中,冷却,摇匀。
C(1/2H2SO4)mol/l硫酸ml
130
0.515
0.13
C(1/2H2SO4)mol/l基准无水碳酸钠g
11.6
0.50.8
0.10.2
硫酸标准溶液浓度按下式计算:
C(1/2H2SO4)=m/(V1-V2)×
C(1/2H2SO4)—硫酸标准溶液的物质的量浓度,mol/l;
V1—硫酸溶液的用量,ml;
V2—空白试验硫酸溶液的用量,ml;
另取30.00~35.00ml下述配制好的硫酸溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用下述规定浓度的氢氧化钠标准溶液,滴定近终点时加热至80℃,继续滴定至溶液呈粉红色。
C(1/2H2SO4)mol/lC(NaOH)mol/l
C(1/2H2SO4)=C1·
C(1/2H2SO4)——盐酸标准溶液的物质的量浓度,mol/l;
V——硫酸溶液的用量,ml。
注:
硫酸的基本单元为1/2H2SO4。
(二)碱标准溶液的配制与标定:
氢氧化钠标准溶液:
C(NaOH)=0.1mol/lC(NaOH)=0.2mol/l
C(NaOH)=0.5mol/lC(NaOH)=1mol/l
1.氢氧化钠贮备液的配制与标定:
20mol/l10LNaOH贮备液m=20×
10×
40=8000g,称取8000g分析纯NaOH于耐热器皿(塑料桶中)加水搅拌,溶解,冷却后稀释至10L,并过滤于聚乙烯容器中摇匀(瓶口装有吸收CO2的碱石棉干燥球)密闭放置至溶液清亮,标定出浓度值。
a)标定原理:
以酚酞为指示剂,NaOH与基准试剂邻苯二甲酸氢钾进行中和反应,根据基准物质质量和消耗NaOH体积,计算出NaOH溶液浓度。
称取下述规定量的105~110℃烘至恒重的基准邻苯二甲酸氢钾,称准至0.0001g,溶于下述规定体积的无二氧化碳的水中,加2滴酚酞指示剂(10g/l),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,同时作空白试验。
C(NaOH)mol/l基准邻苯二甲酸氢钾g无二氧化碳水ml
1.06.080
0.53.080
0.21.280
0.10.650
c)计算:
氢氧化钠标准溶液浓度按下式计算:
C(NaOH)=m/(V1-V2)×
0.2042
C(NaOH)—氢氧化风传标准溶液的物质的量浓度mol/l;
M—邻苯二甲酸氢钾的质量g;
V1—氢氧化钠的用量,ml;
V2—空白试验氢氧化钠溶液的用量,ml;
0.2042—与1.00ml氢氧化钠标准溶液[C(NaOH)=1.000mol/l]相当的以克表示的邻苯二甲酸氢钾的质量。
3)比较:
量取30.00~35.00ml下述规定浓度的盐酸标准溶液,加50ml无二氧化碳的水及2滴酚酞指示剂(10g/l),用配制好的氢氧化钠溶液滴定,近终点时加热至80℃,继续滴定至溶液呈粉红色。
C(NaOH)mol/lC(HCl)mol/l
C(NaOH)=V1·
C1/V
C(NaOH)—氢氧化钠标准溶液的物质的量浓度mol/l;
V1—盐酸标准溶液的用量,ml;
V—氢氧化钠溶液的用量,ml;
C1—盐硬驱标准溶液的物质的量浓度,mol/l。
4)注释:
a)分析纯氢氧化钠杂质含量较高,配出溶液较混浊,故配制时一般采用优级纯NaOH溶解后,用辅有少量脱脂盐棉的漏斗过滤后,标定使用。
b)NaOH试剂中含有少量CO32-,必要时可除去,采用每升氢氧化钠溶液加5mlBa(OH)2溶液除CO32-。
c)装NaOH标准溶液的瓶口,需装有吸收CO2的碱石棉干燥球。
(三)氧化还原标准溶液的配制与标定:
1.硫代硫酸钠标准溶液的配制与标定:
C(Na2S2O3)=0.1mol/l
a)C(Na2S2O3)=1mol/l贮备液的配制(2L)。
称取Na2S2O3·
5H2O496.34g溶于2000ml水中,缓缓煮沸10分钟放置两周后,过滤,按标定方法标出准确浓度备用。
b)C(Na2S2O3)=0.1mol/l标准溶液的配制(10L)。
根据贮备液的实际计算配制0.1mol/l硫代硫酸钠标准溶液,需取贮备液的体积V贮=V1·
C1/C贮=0.1×
1000/1=1000ml,量取1000mlNa2S2O3贮备液于2000ml无二氧化碳的水中,用无二氧化碳蒸馏水稀释至10L,摇匀。
上式:
C1—欲配制的物质的量浓度,mol/l;
V1—需配制的标准溶液的总体积,ml;
C贮—贮备液的物质的量浓度,mol/l;
2)试剂与溶液:
碘化钾:
分析纯;
硫酸:
20%或(1+7)溶液。
量取100ml浓硫酸,在不断搅拌下,缓缓倒入700ml水中混匀,冷却。
淀粉指示剂:
5g/l。
称取0.50g淀粉,加5ml水调成糊状,在搅拌下将糊状物加到90ml沸水中,煮沸1~2分钟冷却,稀释至100ml,使用期为两周。
3)标定:
a)标定原理:
在酸性介质中,K2Cr2O7氧化KI,生成游离碘,用待定的Na2S2O3将碘还原,以淀粉为指示剂,根据基准物K2Cr2O7的质量和Na2S2O3消耗体积,计算Na2S2O3标准溶液的浓度。
反应式:
K2Cr2O7+6KI+7H2SO4=3I2+Cr2(SO4)3+4K2SO4+7H2O
I2+2NaS4O6=Na2S4O6+2NaI
b)测定方法:
称取0.15g于120℃烘至恒重的基准重铬酸钾,称准至0.0001g,置于碘量瓶中,溶于25ml水,加2g碘化钾及20ml硫酸溶液(20%)摇匀,于暗处放置10分钟,加150ml水,用配制好的硫代硫酸钠溶液[C(Na2S2O3)=0.1mol/l]滴定,近终点时加3ml淀粉指示剂(5g/l)继续滴定至溶液由蓝色变为亮绿色,同时作空白试验。
c)计算:
硫代硫酸钠标准溶液浓度按下式计算:
C(Na2S2O3)=m/(V1—V2)×
0.04903
C(Na2S2O3)—硫代硫酸钠标准溶液的物质的量浓度,mol/l;
m—重铬酸钾的质量,g
V1—硫代硫酸钠溶液的用量,ml;
V2—空白试验硫代硫酸钠的用量,ml;
0.04903—与1.00ml硫代硫酸钠标准溶液[C(Na2S2O3)=1.000mol/l]
相当的以克表示的重铬酸钾的质量。
4)比较:
准确量取30.00-35.00ml碘标准溶液[C(1/2I2)=0.1mol/l]置于碘量瓶中,加150ml水,用配制好的硫代硫酸钠溶液[C(Na2S2O3)=0.1mol/l]滴定,近终点时加3ml淀粉指示液(5g/l),继续滴定至溶液蓝色消失。
同时作水所消耗碘的空白试验:
取250ml水,加0.05ml碘标液[C(1/2I2)=0.1mol/l]及3ml淀粉指示液(5g/l),用配制好的硫代硫酸钠溶液[C(Na2S2O3)=0.1mol/l]滴定至溶液蓝色消失。
C(Na2S2O3)=(V1-0.05)×
C1/V1-V2
V1—碘标准溶液的用量,ml;
C1—碘标准溶液的物质的量浓度,mol/l;
V—硫代硫酸钠溶液的用量,ml;
V2—空白试验硫代硫酸钠溶液的用量,ml;
0.05—空白试验中加入碘标准溶液的用量,ml。
5)注意事项:
a.Na2S2O3标准溶液必须贮存在棕色瓶中,配制时,煮沸的目的是为了赶走溶液中的CO2和破坏微生物,Na2S2O3易与空气中的O2,水中的CO2微生物作用,生成单质硫沉淀,一般放置两周后副反应基本完成后,过滤,使用。
b.硫代硫酸钠贮备液应按标定中测定方法标出其准确浓度,便于配制标准溶液时用量准确,贮备液浓度较大,一般取25ml贮备液稀释至250ml容量瓶中再进行标定。
2.高锰酸钾标准溶液的配制与标定
C(1/5KMnO4)=0.1mol/l
a)C(1/5KMnO4)=1.000mol/l贮备液的配制(1L)
称取分析纯KMnO4约33g,溶于1050ml水中,缓缓煮沸15min冷却后,置于暗处,保存两周,以4号玻璃滤埚过滤于干燥的棕色瓶中。
b)C(1/5KMnO4)=0.1mol/l标准溶液的配制(9L)
量取1000ml高锰酸钾贮备液:
用无二氧化碳的水稀释至9L,摇匀。
硫酸(8+92):
量取80ml浓硫酸,在不断搅拌下,沿杯壁缓缓倒入920ml水中,混匀冷却。
3)标定原理:
在酸性介质中,基准Na2C2O4被KMnO4氧化,利用KMnO4自身指示剂,根据基准物质量和KMnO4消耗的体积,计算出KMnO4溶液的浓度。
反应方程式如下:
5Na2C2O4+2KMnO4+8H2SO4=2MnSO4+K2SO4+5NaSO4+8H2O+10CO2↑
a)测定原理:
称取0.2g于105—110℃烘至恒重的基准草酸钠,称准至0.0001g,溶于100ml硫酸溶液(8+92)中,用配制好的高锰酸钾溶液(C(1/5KMnO4)=0.1mol/l)滴定,近终点时加热至65℃,继续滴定至溶液呈粉红色,保持30s,同时作空白试验。
高锰酸钾标准溶液浓度按下式计算:
C(1/5KMnO4)=M/(V1-V2)×
0.06700
C(1/5KMnO4)—高锰酸钾标准溶液的物质的量浓度,mol/l
M—草酸钠的质量,g
V1—高锰酸钾溶液的用量,ml
V2—空白试验高锰酸钾溶液的用量,ml
0.06700—与1.00ml高锰酸钾标准溶液C(1/5KMnO4)=1.000mol/l相当的以克表示的草酸钠的质量
4)比较:
量取30.00—35.00ml配制好的高锰酸钾溶液C(1/5KMnO4)=0.1mol/l,置于碘量瓶中,加2g碘化钾及20ml硫酸溶液(20%)摇匀,于暗处放置5min,加150ml水,用硫代硫酸钠标准溶液(C(Na2S2O3)=0.1mol/l)滴定,近终点时加3ml淀粉指示剂(5g/L),继续滴定至溶液蓝色消失,同时作空白试验。
C(1/5KMnO4)=(V1-V2)×
V1—硫代硫酸钠标准溶液的用量,ml
V2—空白试验硫代硫酸钠标准溶液的用量,ml
C1—硫代硫酸钠标准溶液的物质的量浓度,mol/l
V—高锰酸钾溶液的用量,ml
5)注意事项:
a)标定KMnO4时,必须在H2SO4介质中,而不能在HNO3和HCl介质中,因HNO3具有氧化性,HCl具有还原性。
b)KMnO4溶液见光易分解,所以必须贮存于棕色瓶中。
c)配制KMnO4时,煮沸和放置两周日的目的是使还原性物质完全被氧化,(试