鲁教版九年级化学下册第七单元检测卷Word格式.docx
《鲁教版九年级化学下册第七单元检测卷Word格式.docx》由会员分享,可在线阅读,更多相关《鲁教版九年级化学下册第七单元检测卷Word格式.docx(15页珍藏版)》请在冰豆网上搜索。
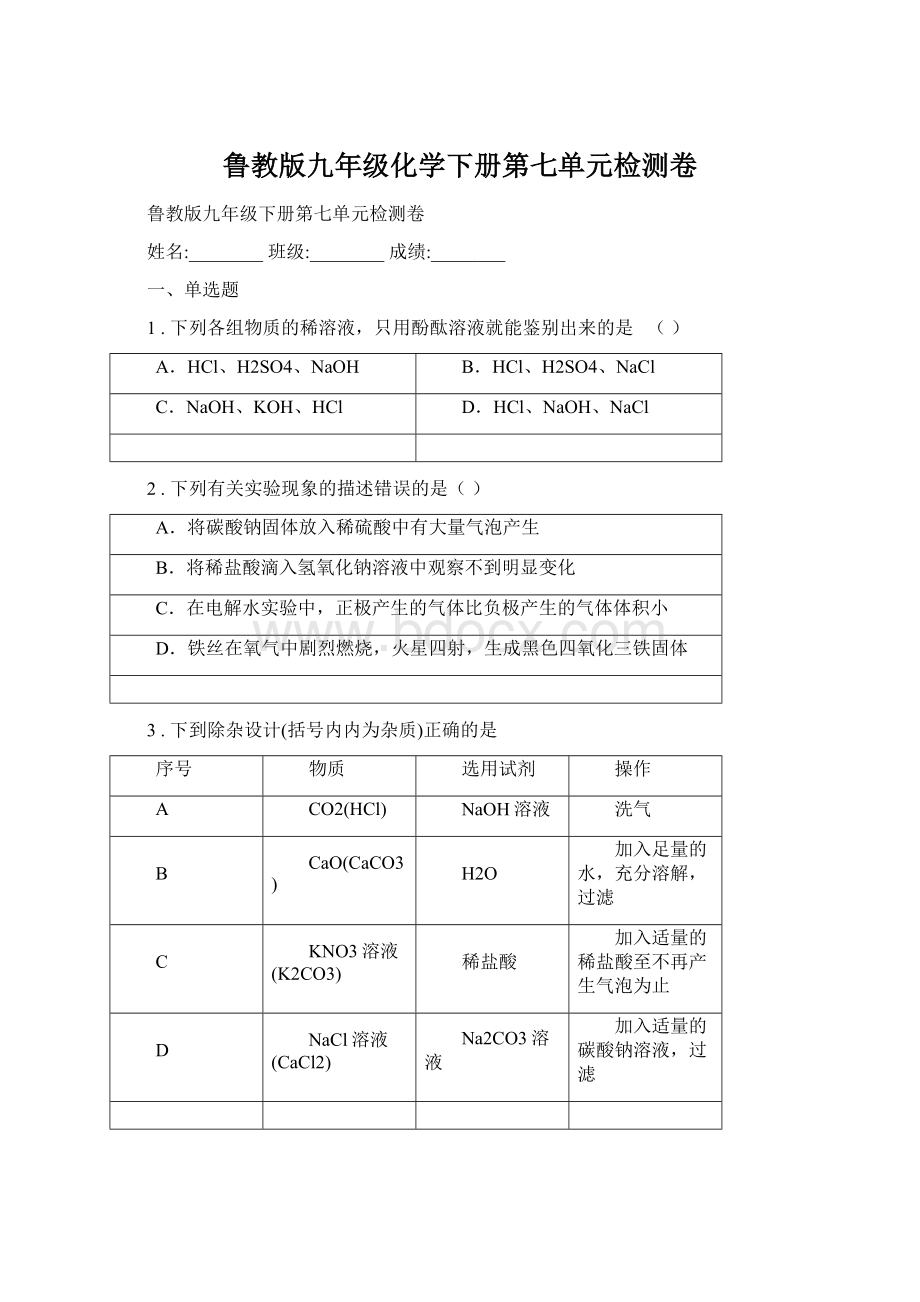
KNO3溶液(K2CO3)
稀盐酸
加入适量的稀盐酸至不再产生气泡为止
D
NaCl溶液(CaCl2)
Na2CO3溶液
加入适量的碳酸钠溶液,过滤
A.A
B.B
C.C
D.D
4.下列关于氢氧化钠的说法中错误的是()
A.易溶于水,溶解时放出热量
B.它的俗称叫火碱、烧碱或苛性钠
C.它的水溶液能使石蕊试液变红色
D.它能与酸发生中和反应
5.利用中和反应原理的是
①熟石灰除去土壤中的硫酸
②用稀硫酸除去铁锈
③氢氧化镁治疗胃酸过多
④实验室制取二氧化碳
A.①③
B.③④
C.①②④
D.①③④
6.小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如右图所示。
从图中所获信息不正确的是
A.反应过程中有热量放出
B.50s时,溶液中溶质为AlCl3
C.0~50s,发生Al2O3+6HCl===2AlCl3+3H2O反应
D.100—140s,压强减小是因为温度降低
7.下列物质露置于空气中,一段时间后,质量减小的是()
A.浓盐酸
B.浓硫酸
C.氢氧化钠
D.碳酸钙
8.根据已学知识,下列做法或说法正确的是
A.所有农作物适宜在接近中性的土壤中生长
B.某些花瓣的汁液也可以制成酸碱指示剂
C.用广泛PH试纸测得某溶液的pH为10.3
D.用食醋长时间浸泡铝壶除净铝壶内的水垢
9.下列物质的名称、化学式、俗称均一致的是()
A.碳酸钙,CaCO3、石灰石
B.碳酸氢钠,NaHCO3、小苏打
C.氢氧化钠、NaOH、纯碱
D.氢氧化钙、CaO、熟石灰
10.溶液是一种重要的混合物。
下列有关溶液的说法正确的是
A.无色透明均一、稳定的液体一定是溶液
B.饱和溶液是一定温度下不能再溶解任何物质的溶液
C.饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液
D.植物油、水、洗洁精混合振荡后形成稳定的液体,该液体是溶液,利用了洗洁精的乳化功能
11.下列常见的化学反应中,属于复分解反应的是
A.Zn与稀H2SO4反应
B.甲烷燃烧
C.煅烧石灰石
D.NaOH溶液与稀盐酸反应
12.既能与锌发生置换反应,又能与烧碱溶液发生复分解反应的溶液是()
A.
溶液
B.
C.
D.
13.有一包白色固体,可能含有CuCl2、CaCO3、NaOH、Ba(OH)2、BaCl2、Na2SO4中的几种。
为确定其组成,取适量试样进行下列实验。
请根据实验现象判断:
①取试样溶于水,搅拌、过滤,得到无色澄清溶液A和白色沉淀B;
②取上述无色澄清溶液A,通入适量的CO2,生成白色沉淀C;
③取上述白色沉淀B,加入过量的稀硝酸,沉淀全部消失。
综合上述实验现象,下列判断正确的是:
A.由①得原白色固体中一定不含CuCl2,一定含量有CaCO3
B.由②③得原白色固体中一定含有Ba(OH)2,一定不含量有Na2SO4
C.由实验现象判断,白色固体中至少有3种固体
D.由实验现象判断,白色固体的组成可有5种情况
14.下列图象能正确反映相应实验的是
①向氢氧化钠溶液中逐滴加入稀盐酸
②向一定量的碳酸钙固体中逐滴加入稀盐酸至过量
③一定温度时,将饱和的氯化钠溶液恒温蒸发至有晶体析出
④将足量的金属镁片和锌片分别与等质量的相同质量分数的稀硫酸混合
A.②①
C.②④
D.①③
15.分类是科学研究的重要方法,下列物质对应的类别不正确的是
选项
H2O2
O3
CH3COOH
Cu(OH)2
类别
氧化物
化合物
酸
碱
16.推理是化学学习中常用的思维方式,下列推理中正确的是
A.碱性溶液能使紫色石蕊试液变蓝,所以能使紫色石蕊试液变蓝的溶液一定显碱性
B.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
C.酸中都含有氢元素,含有氢元素的化合物一定是酸
D.溶液中有晶体析出时,其溶质质量减小,所以溶质的质量分数一定减小
17.用石灰水、铜片、盐酸、碳酸钠、石灰石五种物质进行下列实验,其中无法完成的是()
A.制氢氧化钠
B.制氯化铜
C.制二氧化碳
D.制生石灰
18.某同学为研究氢氧化钠溶液与稀盐酸是否恰好中和时,取少量反应后的溶液于试管中,分别用不同试剂进行实验。
下列实验方法及结论不正确的是
实验序号
所用试剂
现象及结论
铁粉
有气泡产生,则稀盐酸过量
pH试纸
测得pH﹥7,则氢氧化钠溶液过量
酚酞溶液
溶液为无色,一定恰好中和
少量硫酸铜溶液
没有蓝色沉淀,不一定恰好中和
19.下列有关营养与健康的叙述正确的是()
A.铁、锌、碘、镁、氟等微量元素要造量摄入,以保证人体健康
B.奶、虾皮、豆类等食物中含有丰富的钙元素
C.健康人体内血浆的pH范围是6.6~7.1
D.蛋白质、油脂、糖类中都只含有碳、氢、氧元素,代谢产物都是水和二氧化碳
20.化学实验操作的正确性、规范性是实验成功的关键,同时也反映了实验者的化学素养。
下列实验操作中明显不正确的是()
A.加热液体
B.稀释浓硫酸
C.蒸发食盐水
D.检查装置气密性
二、多选题
21.下列图象对应关系正确的是()
A.向氢氧化钠溶液中加水
B.将过量的镁和铝分别放入质量和溶质质量分数相等的稀盐酸中
C.向带锈的铁钉中加入足量的稀盐酸
D.向稀盐酸和氯化钙的溶液中,加入过量的碳酸钠溶液
22.为了除去物质中的杂质(括号内物质为杂质),所选用试剂和操作方法都正确的是
选用试剂(过量)
操作方法
CO2(CO)
O2
点燃
Cu(Fe)
加入稀盐酸充分反应后过滤、洗涤
CuSO4溶液(H2SO4)
氧化铜
加入氧化铜粉末充分反应后过滤
氢气(氯化氢)
碳酸钠溶液
通过装有碳酸钠溶液洗气瓶后收集
三、填空题
23.
(1)澄清石灰水若敞口久置,观察到现象是_________________________。
该反应的化学方程式为__________________________________________。
氢氧化钠露置在空气中不但能吸收________发生潮解,而且还能与空气中的_________
反应而变质,因此氢氧化钠必须密封保存。
写出氢氧化钠露置空气中变质的化学方程式为:
________________________________________。
(2)为除去铁钉上的锈迹,某学生将带锈迹的铁钉放入过量的盐酸中,他首先看到锈迹溶解,溶液呈___________色,这是因为(用化学方程式表示)___________________________;
不一会儿,又看到溶液中有气泡产生,这是因为(用化学方程式表示)_________________。
(3)1:
1的硫酸溶液是用1体积98%的浓硫酸与1体积水混合而成,配制该硫酸溶液时,一定要把___________________慢慢注入_______________,并不断搅拌。
24.
(1)目前,我国一些城市推广使用“乙醇汽油”作汽车燃料:
①乙醇属于
化合物(填“有机”或“无机”)。
②写出乙醇完全燃烧的化学方程式:
。
(2)将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如右图所示:
①由图知,稀盐酸与氢氧化钠溶液发生的反应是
(填“放热”或“吸热”)反应。
②从A到B过程中,烧杯中溶液的pH逐渐
B点表示的含义是
(3)小明家菜地里的蔬菜叶子发黄了,妈妈叫他去买化肥碳酸氢铵(NH4HCO3)来施用,当他到化肥商店时,碳酸氢铵刚好缺货,你建议他买
(填“尿素”或“氯化钾”),也能起到与碳酸氢铵相同的作用。
25.如表是KNO3和NaNO3在不同温度时的溶解度(单位:
g).
温度/℃
10
20
30
40
50
60
70
80
90
100
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169
202
246
NaNO3
87
95
103
114
125
136
150
163
170
(1)从表中数据看出,KNO3与NaNO3溶解度受温度影响更大的是_____.
(2)10℃时,100g水中最多溶解NaNO3_____g.
(3)60℃时,向盛100g水的烧杯中加入100gKNO3,配成溶液,然后降温至20℃,烧杯中析出的晶体为_____g.(精确到0.1)
(4)KNO3和NaNO3在t℃时的溶解度均为Wg,分析上表数据可推知,W的数值所在的最精确范围是_____.
四、实验题
26.在研究酸和碱的化学性质时,某小组同学想证明:
稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。
请与他们一起完成实验方案的设计、实施和评价。
(1)方案一:
测定稀H2SO4与NaOH溶液混合前后的pH(20℃)。
测定某NaOH溶液的pH,pH_____7(选填“大于”、“等于”或“小于”)。
将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH小于7。
结论:
稀H2SO4与NaOH溶液发生了化学反应,并且_____过量。
(2)方案二:
观察_____。
(根据图示实验步骤,概括方案要点)
稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为_____。
(3)上述两个方案在设计思想上的相同点是_____。
(4)为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是_____(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度_____次。
27.依据下列实验操作回答问题。
(1)配制一定质量分数的氯化钠溶液,需进行操作①-⑤,实验步骤为计算、称量和_______。
(2)除去粗盐中难溶性杂质,需要进行操作⑥,该操作的名称是________。
28.某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。
(1)A试管中的反应现象是
(2)C试管中反应的化学方程式是
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到先有气泡产生,后有白色沉淀生成。
同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
(提出猜想)
甲同学猜想:
有NaCl
乙同学猜想:
有NaCl、CaCl2
丙同学猜想:
有NaCl、CaCl2、HCl
你的猜想:
有
(交流讨论)
你认为
同学的猜想一定不正确,理由是
(设计实验)请设计实验证明你的猜想正确。
实验步骤
实验现象
实验结论
取少量滤液于试管中,向其中滴加
_________________。
我的猜想成立
(反思与总结)判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑
五、流程题
29.硅酸钠(Na2SiO3)是我国优先发展的精细化学产品。
用某种石英砂矿石(主要成分是SiO2,还含有少量的CuO、Na2SO4、Na2CO3)。
工业上制备硅酸钠晶体的流程如下:
查阅资料:
SiO2既不溶于水,也不与盐酸反应;
Na2SO4、Na2CO3均易溶于水。
请回答:
(1)“研磨”的目的是__________________________________;
(2)实验室的过滤操作中必须用到的玻璃仪器有:
烧杯、漏斗、________,过滤时发现过滤速率缓慢,可能原因是______________________________;
(3)“酸浸”过程中发生反应的化学方程式为_________________________;
(4)“碱浸”时加入的碱液应选用_________________(填化学式)溶液。
六、科学探究题
30.在化学上有很多反应是没有现象的,为了让无现象的实验变得有现象,某化学兴趣小组的同学设计了下列实验装置,先验证氢氧化钠能与二氧化碳反应,再探究石灰水能否和稀盐酸反应(实验前,弹簧夹K1、K2处于关闭状态)。
(资料提示)
碳酸钠和稀盐酸反应的化学方程式为:
Na2CO3+2HCl=2NaCl+H2O+CO2↑。
(实验步骤)
Ⅰ.打开分液漏斗活塞,将足量的氢氧化钠溶液注入锥形瓶中,立即关闭活塞;
Ⅱ、打开K1,观察到B中部分液体倒吸入A中,且A中有气泡产生,______(选填“能“或“不能”)说明氢氧化钠能与二氧化碳反应;
Ⅲ.打开K2,C中溶液分别倒吸入A、B中,观察到B中溶液呈无色,______(选填“能”或”不能”)说明氢氧化钙能和稀盐酸反应,该反应的化学方程式是______。
此时,B中溶质可能有两种物质,分别是______、______(写化学式)。
(实验思考)
实验前B中号管不能插到瓶底,这将使B瓶中留有部分溶液,其目的是______。
七、综合题
31.利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或碱)溶液中逐滴加入已知质量分数的碱(或酸)溶液(标准溶液),直到酸、碱正好完全反应,根据消耗标准碱(或酸)溶液的多少即可求算出待测酸(或碱)溶液的质量分数.
下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图.
(1)根据下图曲线可以判断实验中是向________(填“酸”或“碱”,下同)溶液(待测液)中滴加________溶液(标准液).
(2)在这次测定中,为了指示中和反应刚好完全,用酚酞作指示剂,即在待测溶液中先滴入几滴酚酞试液,若看到________,则证明中和反应正好完成.
(3)如果实验中使用的酸是硫酸,碱是氢氧化钠,且待测液和标准液的密度均以1.0g/mL计.若测定中取用待测液25mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数.
参考答案
1、
2、
3、
4、
5、
6、
7、
8、
9、
10、
11、
12、
13、
14、
15、
16、
17、
18、
19、
20、