上海市17个区县高考二模化学试题分类汇编Word文档格式.docx
《上海市17个区县高考二模化学试题分类汇编Word文档格式.docx》由会员分享,可在线阅读,更多相关《上海市17个区县高考二模化学试题分类汇编Word文档格式.docx(33页珍藏版)》请在冰豆网上搜索。
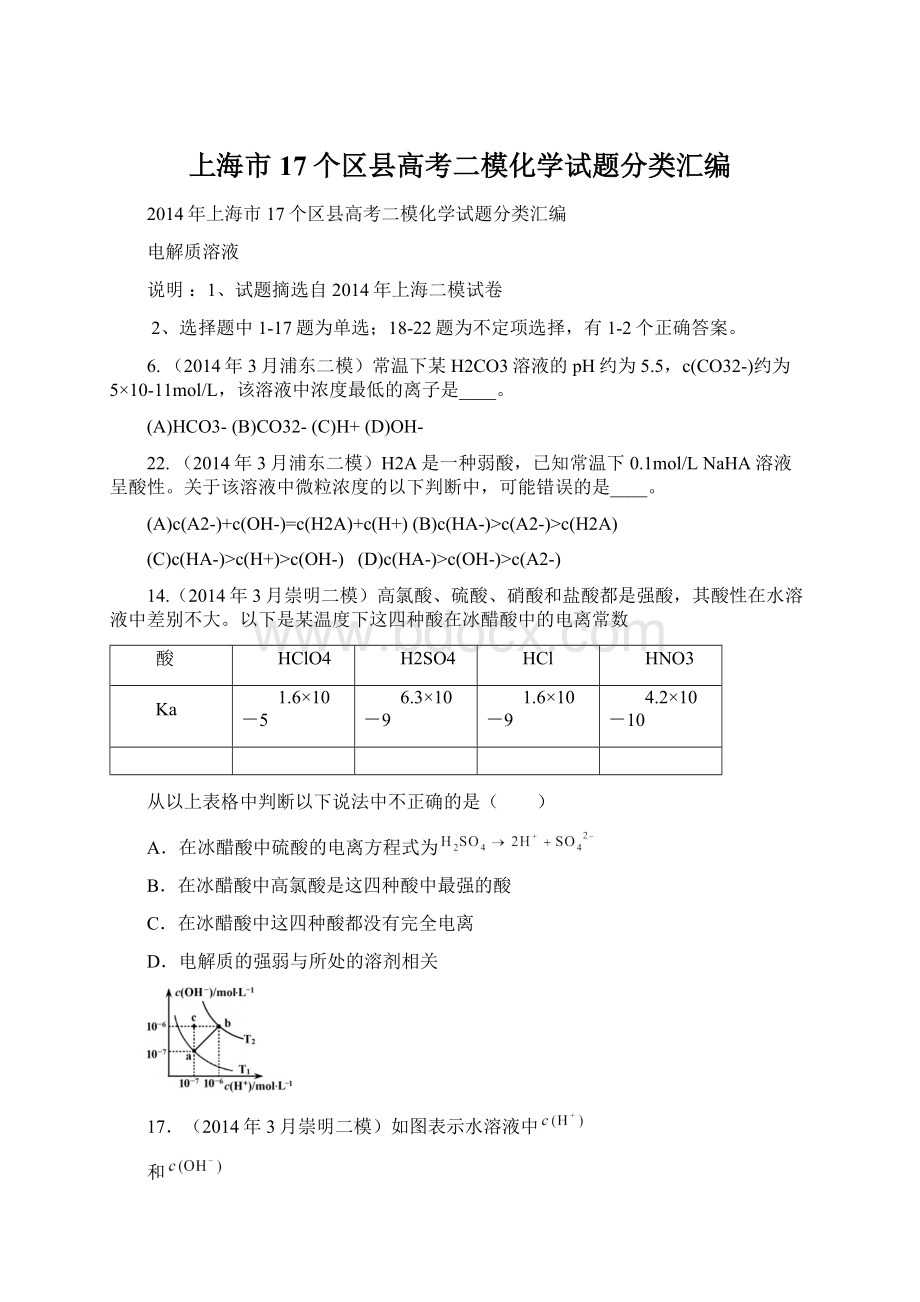
A.ab直线上任意点溶液均显中性
B.b点时,溶液的
,显酸性
C.图中温度T1>T2
D.在水中通入适量HCl气体可从a点变到c点
16、(2014年3月奉贤二模)在25℃时两种酸的电离常数如下:
H2CO3:
Ki1=4.2×
10-7,Ki2=5.6×
10-11;
H2S:
Ki1=5.7×
10-8,Ki2=1.2×
10-15,则下列反应可能发生的是
A.NaHCO3+NaHS→Na2CO3+H2S↑B.H2S+Na2CO3→NaHS+NaHCO3
C.Na2S+H2O+CO2→Na2CO3+H2S↑D.H2S+NaHCO3→NaHS+H2CO3
19、(2014年3月奉贤二模)常温下,取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是
A.C(Na+)-C(X-)=9.9×
10-7mol/L
B.C(Na+)=C(X-)+C(HX)=0.1mol/L
C.C(OH-)-C(HX)=C(H+)=1×
10-6mol/L
D.混合溶液中由水电离出的C(OH-)小于0.2mol/LHX溶液中由水电离出的C(H+)
12.(2014年3月黄埔二模)已知NaCN溶液呈碱性,(CN)2与卤素单质的性质相似,CN-的还原性介于Br-、I-之间。
下列变化不能发生的是
A.HCNH++CN-
B.(CN)2+CH2==CH2→NC—CH2—CH2—CN
C.(CN)2+2Br-→2CN-+Br2
D.(CN)2+2OH-→CN-+CNO-+H2O
22.(2014年3月黄埔二模)常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液,有关微粒的物质的
量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。
根据图示判断,下列说法正确的是
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:
c(Na+)>
c(HA-)>
c(A2-)>
c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合,其溶液中水的电离程度比纯水的大
C.向Na2A溶液加入水的过程中,pH可能增大也可能减小
D.NaHA溶液中:
c(OH-)+c(A2-)=c(H+)+c(H2A)
21、(2014年3月普陀二模)一定温度下,难溶强电解质的饱和溶液中存在着沉淀-溶解平衡,其平衡常数称为溶度积(Ksp,化学平衡常数中的一种)。
例如:
Ag2CrO4(s)
2Ag+(aq)+CrO42-(aq) Ksp=[c(Ag+)]2•c(CrO42-)。
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp(25℃)
8.0×
10-16
2.2×
10-20
4.0×
10-38
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说法错误的是
A.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C.该溶液中c(SO42-):
[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:
4
D.将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
7.(2014年3月长宁二模)室温下,对于0.10mol·
L-1的氨水,下列判断正确的是
A.用相同浓度的HNO3溶液中和,硝酸体积小于氨水时,溶液可能呈中性
B.温度不变,加水稀释后溶液中c(NH4+)·
c(OH—)不变
C.加水稀释后,溶液中导电粒子的数目减少
D.其溶液的pH=13
18.(2014年3月长宁二模)下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol·
L-1]:
c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
B.在0.1mol·
L-1Na2CO3溶液中:
c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
C.向0.2mol·
L-1NaHCO3溶液中加入等体积0.1mol·
L-1NaOH溶液:
c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.在0.1mol·
L-1NaHCO3溶液中:
c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
21.(2014年3月长宁二模)部分弱酸的电离平衡常数如下表,下列表述肯定正确的是
弱酸
H2CO3
H2SO3
HClO
电离平衡常数
(25℃)
K1=4.30×
l0-7
K1=1.54×
l0-2
K=2.95×
l0-8
K2=5.61×
l0-11
K2=1.02×
A.相同温度时三种溶液的pH关系:
Na2CO3>
NaClO>
Na2SO3
B.ClO-+H2O+CO2→HClO+HCO3-
C.2ClO-+SO2+H2O→2HClO+SO32-
D.等体积、等物质的量浓度的HClO和Na2CO3混合后溶液呈碱性
12.(2014年3月闸北二模)已知碳酸、亚硫酸常温时的电离平衡常数如下表:
电离常数
碳酸
Ki1=4×
10-7Ki2=5.6×
10-11
亚硫酸
Ki1=1.54×
10-2Ki2=1.02×
10-7
据此判断,下列关于SO2与Na2CO3(aq)反应的离子方程式错误的是
A.SO2+H2O+2CO32-→2HCO3-+SO32-B.SO2+H2O+CO32-→H2CO3+SO32-
C.2SO2+2H2O+CO32-→H2CO3+2HSO3-D.SO2+H2O+CO32-→HCO3-+HSO3-
21.(2014年3月闸北二模)某天然碱的化学式可表示为2Na2CO3·
NaHCO3·
2H2O,取少量该物质溶于水得稀溶液,下列有关溶液P中微粒的物质的量浓度关系错误的是
A.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
B.c(CO32-)>
c(HCO3-)>
c(H+)
C.3c(Na+)>
5c(CO32-)+5c(HCO3-)
D.将该溶液与少量NaOH溶液混合后:
c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
5.(14静安二模)人的血液中存在H2CO3~HCO3-这样“一对”物质,前者的电离和后者的水解两个平衡使正常人血液的pH保持在7.35~7.45之间。
血液中注射碱性物质时,上述电离和水解受到的影响分别是
A.促进、促进B.促进、抑制C.抑制、促进D.抑制、抑制
21.(2014年3月静安二模)25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。
下列说法正确的是
A.曲线Ⅰ:
滴加溶液到10mL时
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线Ⅰ:
滴加溶液到20mL时
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.曲线Ⅱ:
滴加溶液在10mL~20mL之间
存在:
c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线Ⅱ:
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
13.(2014年3月闵行二模)下列变化能够实现的是:
①复分解反应中既没有生成水,也没有生成沉淀和气体;
②两种氧化物发生反应有气体生成;
③两种酸的溶液充分反应后溶液呈中性;
④弱酸与盐溶液反应生成强酸。
A.只有①③B.只有②④C.只有①②④D.①②③④
14.(2014年3月闵行二模)常温下Ca(OH)2溶于水达到饱和时存在如下平衡:
Ca(OH)2(s)
Ca2++2OH-,饱和石灰水的密度为dg/cm3,溶液pH=12。
下列有关叙述中,不正确的是
A.加热至50℃,溶液的Ca2+的浓度增大
B.该温度下Ca(OH)2的溶解度为
(g/100gH2O)
C.该饱和石灰水中,水电离出的OH-的浓度为10-12mol/L
D.加入生石灰并恢复至常温后,
值不变
21.(2014年3月闵行二模)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
C6H5ONa
pH
8.8
9.7
11.6
10.3
11.1
11.3
下列说法或表达中,正确的是
A.少量二氧化碳通入NaClO溶液中:
2NaClO+CO2+H2O
Na2CO3+2HClO
B.过量的HCN滴入碳酸钠溶液中HCN+Na2CO3
NaCN+NaHCO3
C.结合质子能力由强到弱的顺序为:
CO32—>CN—>HCO3—>CH3COO—
D.常温下电离常数:
Ki2(H2CO3)>Ki(C6H5OH)>Ki(HCN)
离子反应与离子共存
21.(2014年3月崇明二模)有一固体混合物,可能含有FeCl2、NaNO2、Ba(OH)2、A1C13、Na2SO3中的若干种。
取适量该混合物加适量水充分搅拌,得到白色沉淀A与无色溶液B。
①取少量A加入稀硝酸至过量,白色沉淀部分溶解
②取少量B逐滴加入稀硫酸至过量,不断生成白色沉淀后沉淀部分溶解
③取少量B滴加少量酸性高锰酸钾,振荡,最终得无色溶液
根据上述实验现象,以下推测正确的是( )
A.③中使KMnO4褪色的是
B.无法判断固体中FeCl2是否存在
C.B的pH>7D.固体由Ba(OH)2、A1C13、Na2SO3组成
15、(2014年3月奉贤二模)某溶液中含有大量的Cl一、Br一、I一,若向lL该混合溶液中通入一定量的Cl2,溶液中Cl-、Br一、I一的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl一、Br一、I一的物质的量浓度之比为
A、5:
15:
4B、5:
12:
4C、15:
30:
8D、条件不足,无法计算
20、(2014年3月奉贤二模)对于难溶盐MX,其饱和溶液Mn+和Xn-的离子的物质的量浓度之间的关系近似于水的离子积Kw(Kw=[H+][OH-]),存在着[Mn+][Xn-]=Ksp的关系(Ksp为常数).现将足量的AgCl固体分别放入下列物质中,AgCl的溶解度由大到小排列的顺序是
①20ml0.1mol/L(NH4)2CO3溶液②40mL0.03mol/LHCl
③50ml0.05mol/LAgNO3溶液④30ml0.02mol/CaCl2溶液
⑤10mL蒸馏水⑥30ml0.02mol/NH4NO3溶液
A.⑤>②>④>③>⑥>①B.①>⑥>⑤>②>④>③
C.①>②>③>④>⑤>⑥D.③>②>④>⑥>①>⑤
17.(2014年3月黄埔二模)某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。
若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。
下列说法不正确的是
A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.该溶液中所含的离子是:
Fe2+、Na+、SO42-、NO3-
D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
8、(2014年3月普陀二模)将足量NO2通入下列各溶液中,所含离子还能大量共存的是
A.Fe2+、Clˉ、SO42ˉ、Na+ B.NH4+、Al3+、NO3ˉ、Clˉ
C.Ca2+、K+、Clˉ、HCO3ˉD.K+、Na+、SO32ˉ、SO42-
19、(2014年3月普陀二模)向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2
溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示。
下列离子方程式书写正确的是
A.O→A:
H++SO42ˉ+Ba2++OHˉ→BaSO4↓+H2O
B.A→B:
2Al3++3SO42ˉ+3Ba2++6OHˉ→3BaSO4↓+2Al(OH)3↓
C.B→C:
2NH4++SO42ˉ+Ba2++2OHˉ→BaSO4↓+2NH3·
H2O
D.D→E:
NH4++OHˉ→NH3·
15.(2014年3月长宁二模)某无色溶液中可能含有仅由①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种组成的溶质,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤
操作
现象
1
用pH试纸检验
溶液的pH大于7
2
向溶液中滴加氯水,再加入CCl4振荡,静置
CCl4层呈橙色
3
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3
有白色沉淀产生
过滤,向滤液中加入AgNO3溶液
下列结论正确的是
A.肯定含有的离子是①④⑤B.肯定没有的离子是②⑥
C.不能确定的离子是①D.不能确定的离子是③⑤
9.(2014年3月闸北二模)甲、乙两溶液分别含有大量的下列离子中的3种:
Cu2+、K+、H+、Cl-、CO32-、OH-。
已知甲溶液呈蓝色,则乙溶液中能大量存在的离子是
A.Cu2+、H+、Cl-B.CO32-、OH-、Cl-
C.K+、H+、Cl-D.K+、OH-、CO32-
17.(2014年3月闸北二模)Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.2︰4︰1B.3︰2︰1C.2︰3︰1D.4︰2︰1
16.(2014年3月静安二模)某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。
分别取样:
①用pH计测试,溶液显弱酸性;
②加氯水和淀粉无明显现象。
为确定该溶液的组成,还需检验的离子是
A.Na+B.SO42-C.Ba2+D.NH4+
6.(2014年3月闵行二模)下列反应所得溶液中,一定只含一种溶质的是
A.向铁粉中加入稀硝酸
B.向烧碱溶液中通入CO2气体
C.向稀盐酸中滴入少量的NaAlO2溶液
D.向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液
17.(2014年3月闵行二模)向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。
则下列离子组在对应的溶液中,一定能大量共存的是
A.a点对应的溶液中:
Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:
Al3+、Fe3+,MnO4-、Cl-
C.c点对应的溶液中:
Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:
F-、NO3-、Fe2+、Ag+
10.(2014年3月徐汇二模)某溶液中含有NO3-、S2-、AlO2-、SO32-四种阴离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的NaOH溶液,则溶液中物质的量基本不变的阴离子是
A.NO3-
B.S2-
C.AlO2-
D.SO32-
离子方程式
19.(2014年3月崇明二模)下列离子方程式书写正确的是( )
A.澄清石灰水与过量的小苏打溶液反应:
↓
B.向NaAlO2溶液中通入过量CO2:
C.向NaHSO4溶液中滴加
至刚好沉淀完全:
D.向含有0.1mol溶质的FeI2溶液中通入0.1mol的Cl2:
20.(2014年3月黄埔二模)下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
选项
微粒组
所加试剂
A
NH
、Fe2+、SO
少量Ba(OH)2溶液
2NH
+2NH
+SO
+Ba2++2OH-
→BaSO4↓+2NH3·
B
Mg2+、HCO
、Cl-
过量NaOH溶液
Mg2++2HCO
+4OH-
→Mg(OH)2↓+2CO
+2H2O
C
Fe2+、NO
、HSO
NaHSO4溶液
HSO
+H+→SO2↑+H2O
D
K+、NH3·
H2O、CO
通入少量CO2
2NH3·
H2O+CO2→2NH
+CO
20.(2014年3月闵行二模)向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.NH4++SO42—+Ba2++OH—
BaSO4↓+NH3·
B.2Al3++3SO42—+3Ba2++6OH—
3BaSO4↓+2Al(OH)3↓
C.Al3++2SO42—+2Ba2++4OH—
2BaSO4↓+AlO2—+2H2O
D.NH4++Al3++2SO42—+2Ba2++4OH—
2BaSO4↓+Al(OH)3↓+NH3·
20.(2014年3月徐汇二模)在0.1mol/L的NaHSO3溶液中有如下关系:
c(HSO3-)>
c(SO32-)>
c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O
HSO3-十OH-B.HSO3-十H2O
H2SO3十OH-
C.HSO3-十OH-
SO32-十H2OD.H2SO3+OH-
HSO3-十H2O
21.(2014年3月徐汇二模)在含有nmolFeI2的溶液中通入Cl2,有xmolCl2发生反应。
A.当x≤
时,反应的离子方程式为:
2Fe2++Cl2→2Fe3++2Cl-
B.当x≥n时,反应的离子方程式为:
2Fe2++2I-+2Cl2→2Fe3++I2+4Cl-
C.当Fe2+和I-都被氧化时,x与n的关系为x>n
D.当x=n时,反应后氧化产物的物质的量为nmol
实验基础知识-选择中的实验题
1.(2014年3月浦东二模)烧碱的古老制法可表示为Na2CO3+Ca(OH)2→CaCO3↓+2NaOH,那时还没有合成氨工业。
其中的Na2CO3来自____。
(A)盐碱湖(B)海水(C)侯德榜联合制碱法(D)氯碱工业
7.(2014年3月浦东二模)工业上由重晶石制取可溶性钡盐,对已经粉碎后的矿石首先进行的处理方法应是____。
(A)水溶法(B)酸溶法(C)碱溶法(D)还原法
11.(2014年3月浦东二模)实验室用硫酸和硫化亚铁反应制取少量硫化氢气体,装置中可能涉及下列组件。
关于这些组件的说明正确的是____。
(A)①能控制气体发生速度(B)若气体不纯而万一发生爆炸,②具有保护装置的作用
(C)③用于硫化氢的干燥和收集(D)④用于硫化氢的尾气处理
19.(2014年3月浦东二模)不考虑现代物理手段,溶液中离子的定性检验有三种基本方法,①沉淀法(观察反应中沉淀的发生或消失)、②气体法(观察反应中气体的产生及其验证)、③显色法(观察颜色变化)。
溶液中下列离子的检验或鉴别有以上两种基本方法可供选择的是____。
(A)Al3+(B)Na+(C)I-(D)CO32-
10.(2014年3月崇明二模)玻璃棒是化学实验中常用的仪器,通常用于搅拌、引流等。
下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是………………………………………………………………( )
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2
D.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
20.(2014年3月崇明二模)测定
的结晶水含量,下列方案中肯定不可行的是…………………( )
A.称量样品→加热→冷却→称量CuO
B.称量样品→加热→冷却→称量
C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
D.称量样品→加NaOH→过滤→加热→冷却→称量CuO
1、(2014年3月奉贤二模)2013年6月11日,神舟十号由长征二号F改进型运载火箭成功发射,其后完成了与天宫一号的对接任务,实现了中国航天史上首次太空授课。
下列操作在太空舱可以实现的是
A.过滤B.分液C.氧化铁粉和铝粉混合D