高考化学大二轮复习第3部分训练非选择题专项练2Word文档格式.docx
《高考化学大二轮复习第3部分训练非选择题专项练2Word文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学大二轮复习第3部分训练非选择题专项练2Word文档格式.docx(13页珍藏版)》请在冰豆网上搜索。
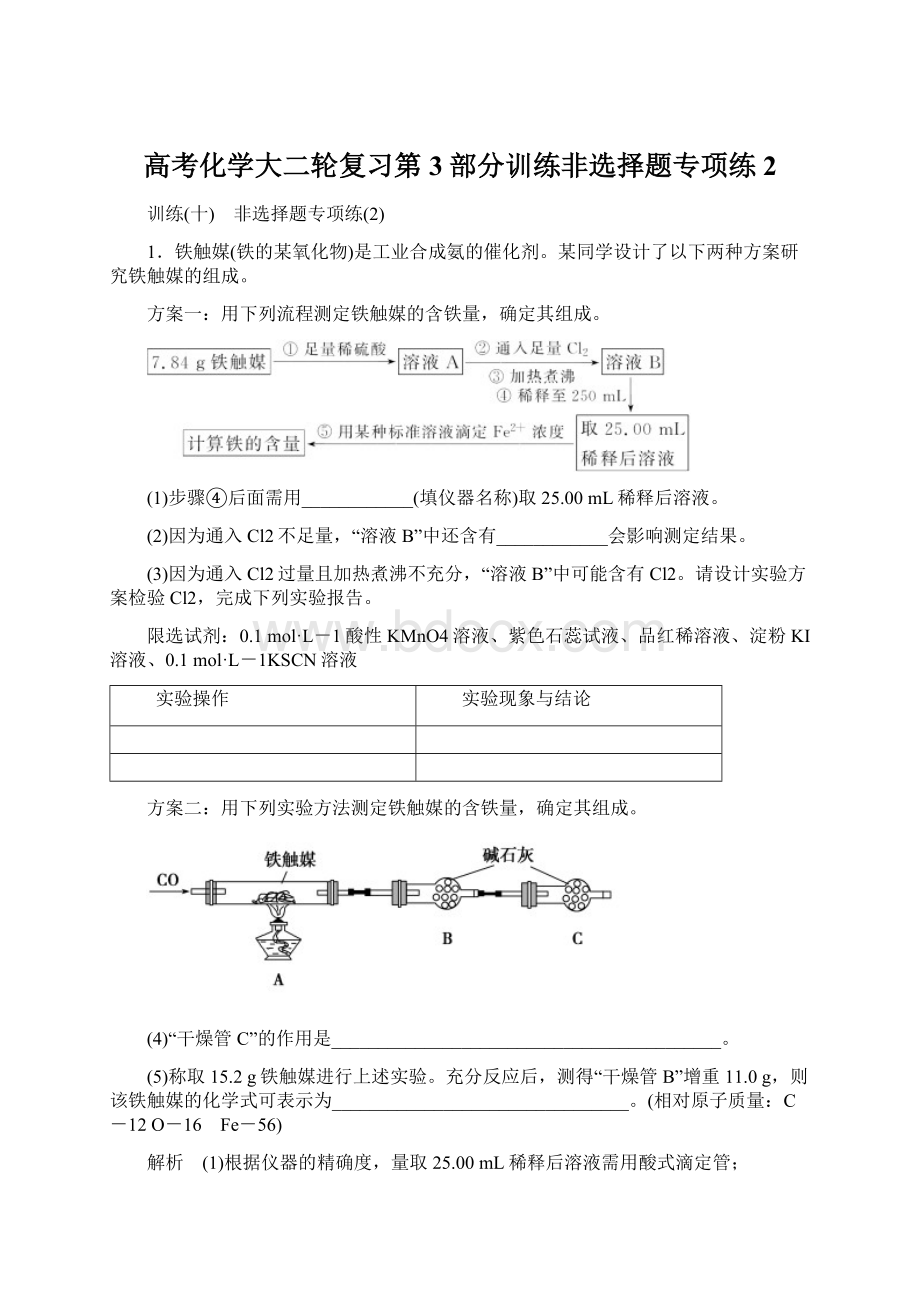
能使石蕊试液先变红后褪色,向溶液B中加入石蕊试液,如果石蕊试液显红色,后红色褪去,这是氯水的性质,证明含有氯气,若溶液变红后不褪色,溶液B不含有Cl2;
(4)一氧化碳可以和铁的氧化物之间发生反应,得到气体产物二氧化碳,干燥管B可以吸收生成的二氧化碳,测定二氧化碳的量可以获得铁触媒的量,但是要排除空气成份的干扰,所以C的作用是:
防止空气中的CO2和水蒸气进入B中;
(5)根据实验方案一的原理,15.2g铁触媒充分反应生成二氧化碳的质量是11.0g,设发生的反应为:
yCO+FexOy
xFe+yCO2,
1y
即
=
,解得x∶y=4∶5,所以氧化物的化学式为:
Fe4O5或2FeO·
Fe2O3。
答案
(1)酸式滴定管
(2)FeCl2或者FeSO4或者Fe2+
(3)
预期现象和结论
取适量溶液B于试管中,滴加2~3滴紫色石蕊试液,振荡,观察现象
若溶液显红色,后红色褪去,则溶液B中含Cl2;
若溶液变红后不褪色,则溶液B不含有Cl2
(加入品红稀溶液也可)
(4)防止空气中的CO2和水蒸气进入B中
(5)Fe4O5或2FeO·
Fe2O3
2.某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。
其生产工艺流程如下:
已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO
;
②TiOSO4水解的反应为:
TiOSO4+(x+1)H2O→TiO2·
xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为________________,分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是__________________;
步骤②中得到硫酸亚铁晶体的操作为蒸发浓缩、____________________________________________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________。
(3)步骤④的离子方程式是__________________________________________。
(4)已知:
FeCO3(s)Fe2+(aq)+CO
(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________________________________________________。
(5)实验室中常用KMnO4滴定法测定晶体中FeSO4·
7H2O的质量分数,取步骤②中所得FeSO4·
7H2O晶体样品ag,配成500.00mL溶液,取出25.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。
若消耗0.1000mol·
L-1KMnO4溶液25.00mL,则所得晶体中FeSO4·
7H2O的质量分数为__________(用a表示)。
解析 废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2·
xH2O,过滤,滤渣为TiO2·
xH2O、Fe,滤液为FeSO4,FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;
FeSO4溶液中加碳酸氢铵反应生成碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体;
(1)由流程分析可知,步骤①所得滤渣的主要成分为TiO2·
xH2O、Fe;
实现固体和液体的分离用过滤的方法,过滤操作使用的仪器有玻璃棒、烧杯、漏斗;
步骤②是从溶液中得到硫酸亚铁晶体,操作为蒸发浓缩、冷却结晶、过滤洗涤等操作;
(2)硫酸亚铁在空气中煅烧生成铁红和三氧化硫的方程式为:
4FeSO4+O2
2Fe2O3+4SO3,氧化剂是氧气,还原剂是硫酸亚铁,所以氧化剂和还原剂的物质的量之比为1∶4;
(3)由流程图可知,硫酸亚铁与碳酸氢铵反应是碳酸亚铁,还生成气体为二氧化碳,溶液B为硫酸铵溶液,反应离子方程式为:
Fe2++2HCO
===FeCO3↓+H2O+CO2↑;
(4)碳酸亚铁的沉淀存在溶解平衡:
(aq),加入乳酸,这样CO
与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
(6)令FeSO4·
7H2O的质量分数为x,亚铁离子会被高锰酸钾氧化为三价铁离子,本身被还原为+2价的锰离子,根据电子守恒,则
5FeSO4·
7H2O~KMnO4,
5×
278g1mol
ag×
x×
0.1000mol·
L-1×
0.025L
所以
解得x=
。
答案
(1)TiO2·
xH2O、Fe 玻璃棒、烧杯、漏斗 冷却结晶、过滤洗涤
(2)1∶4 (3)Fe2++2HCO
===FeCO3↓+H2O+CO2↑
(4)FeCO3(s)Fe2+(aq)+CO
(aq),CO
与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液 (6)
3.研究发现,含PM2.5的雾霾主要成分有SO2、NOx、CxHy及可吸入颗粒等。
(1)雾霾中能形成酸雨的物质是______________________________________。
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905.48kJ·
mol-1
N2(g)+O2(g)2NO(g) ΔH=+180.50kJ·
①下列表示NH3(g)与NO(g)在一定条件下反应,生成无污染气体的能量转化关系示意图1正确的是:
__________(填字母)。
图1
②图2是反应4NH3(g)+6NO(g)5N2(g)+6H2O(g)过程中NH3的体积分数随X变化的示意图2,X代表的物理量可能是______________,原因是__________________。
图3
图4
(3)图3电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,①阴极的电极反应式是_______________________________________________________________。
②物质A是____________(填化学式),理由是__________________________。
(4)为减少雾霾、降低大气中有害气体含量,研究机动车尾气中CO、NOx及CxHy的排放量意义重大。
机动车尾气污染物的含量与空/燃比(空气与燃油气的体积比)的变化关系示意图如图4:
请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是____________________。
②当空/燃比达到15后,NOx减少的原因可能是______________________。
解析
(1)二氧化硫和氮氧化物是形成酸雨的主要气体;
(2)①已知①N2(g)+O2(g)===2NO(g) ΔH=180.50kJ·
mol-l
②4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=-905.48kJ·
氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:
①×
5+②得到:
4NH3(g)+6NO(g)===5N2(g)+6H2O(g) ΔH=-1807.98kJ·
mol-1;
②该反应是放热及体积增大的可逆反应,升高温度或增大压强,平衡均逆向移动,使NH3的体积分数增大;
(3)①NO得电子生成铵根离子方程式:
NO+5e-+6H+===NH
+H2O;
②SO2失电子形成硫酸,反应方程式:
5SO2+2NO+8H2O
(NH4)2SO4+4H2SO4;
(4)①空/燃比增大,燃油气燃烧更充分;
②反应N2(g)+O2(g)2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低。
答案
(1)SO2和NOx
(2)①a ②温度或压强 因为该反应是放热及体积增大的可逆反应,升高温度或增大压强,平衡均逆向移动,使NH3的体积分数增大
(3)①NO+5e-+6H+===NH
+H2O
②H2SO4
根据反应:
(NH4)2SO4+4H2SO4,产物中除有(NH4)2SO4外还有H2SO4
(4)①空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少
②因为反应N2(g)+O2(g)2NO(g)是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低
4.硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO·
B2O3·
H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。
Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入稀硫酸。
该反应的化学方程式为__________________________。
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO
,还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。
“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是____________。
H2O2的作用是__________________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。
为了从“母液”中充分回收MgSO4·
H2O,应采取的措施是将“母液”蒸发浓缩,____________________。
答案
(1)CaCO3(粉末)+H2SO4===CaSO4+H2O+CO2↑
(2)Fe3+、Fe2+、Al3+
H2O2+2H++2Fe2+===2Fe3++2H2O
(3)防止温度下降时H3BO3从溶液中析出
(4)加压升温结晶
5.钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为______________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是________________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为__________,中心原子的杂化方式为__________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×
10-2nm和7.8×
10-2nm。
则熔点:
NiO________(填“>
”、“<
”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。
该合金的晶胞结构如图所示。
①该晶体的化学式为______________________________________________。
②已知该晶胞的摩尔质量为Mg·
mol-1,密度为dg·
cm-3。
设NA为阿伏加德罗常数的值,则该晶胞的体积是__________cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。
a=511pm,c=397pm;
标准状况下氢气的密度为8.98×
10-5g·
cm-3;
储氢能力=
若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
解析 (4)①从图中可以看出,La位于平行六面体的顶点,晶胞中La的原子数为
×
8=1。
平行六面体的上、下两个面各有2个Ni原子,四个侧面各有1个Ni原子,体心还有1个Ni原子。
故晶胞中Ni的原子数为
8+1×
1=5。
故该晶体的化学式为LaNi5。
②晶胞的体积为
cm3。
③LaNi5合金储氢后的密度ρ=
≈0.111
g·
cm-3,由定义式:
,故储氢能力=
≈1236。
答案
(1)①3d24s2 ②7
(2)①O>
Cl>
C ②3∶1 sp2 (3)>
(4)①LaNi5 ②
③1236
6.化合物F是一种重要的有机合成中间体,它的合成路线如下:
请认真分析和推理回答下列问题:
(1)由B生成C的化学反应类型是____________________;
化合物F中含氧官能团的名称是______________。
(2)写出化合物C与乙酸反应生成酯的化学方程式:
_____________________。
(3)写出化合物B的结构简式:
______________。
同时满足下列条件的B的同分异构体(不包括B)共有________种:
①苯环上只有两个取代基;
②能与FeCl3溶液显紫色。
(4)工业上以苯酚(
)和烃W为主要原料制备有机物3�乙基1,6�己二酸的合成路线流程图如下:
提示:
3�乙基1,6�己二酸的结构简式如下图:
①写出X、Z的结构简式:
X:
________________,Z:
________________;
②写出苯酚与W反应的化学方程式:
_________________________________。
解析 根据题中各物质的转化关系可知,由A苯酚到C
的变化分别是:
在苯酚的对位引入一个烷烃基(丁基),然后苯环上发生与氢气的加成,变为环己烷,据此可以推断出B的结构简式为
,然后C中醇羟基被氧化生成羰基,即得到D。
(1)由上面的分析可知,B生成C的化学反应类型为加成反应。
根据F的结构简式可知,化合物F中含氧官能团的名称为醛基和羰基。
(2)化合物C与乙酸发生酯化反应,反应的方程式为:
CH3COOH+
+H2O。
(3)根据上面分析可知,化合物B的结构简式为
同时满足下列条件①苯环上只有两个取代基,②能与氯化铁溶液显色,即有酚羟基的B的同分异构体为苯环上连有酚羟基和—C4H9,有邻间对三种位置关系,其中—C4H9有四种结构,所以共有12种结构,其中除去B的结构还有11种。
(4)①依据上面的分析可知X为
,Z为
或
②W为乙烯,苯酚与之反应的化学方程式为CH2==CH2+
答案
(1)加成反应 醛基、羰基
(2)CH3COOH+
11
(4)①
②CH2==CH2+