高一化学分章节知识点整理及默写Word文档格式.docx
《高一化学分章节知识点整理及默写Word文档格式.docx》由会员分享,可在线阅读,更多相关《高一化学分章节知识点整理及默写Word文档格式.docx(26页珍藏版)》请在冰豆网上搜索。
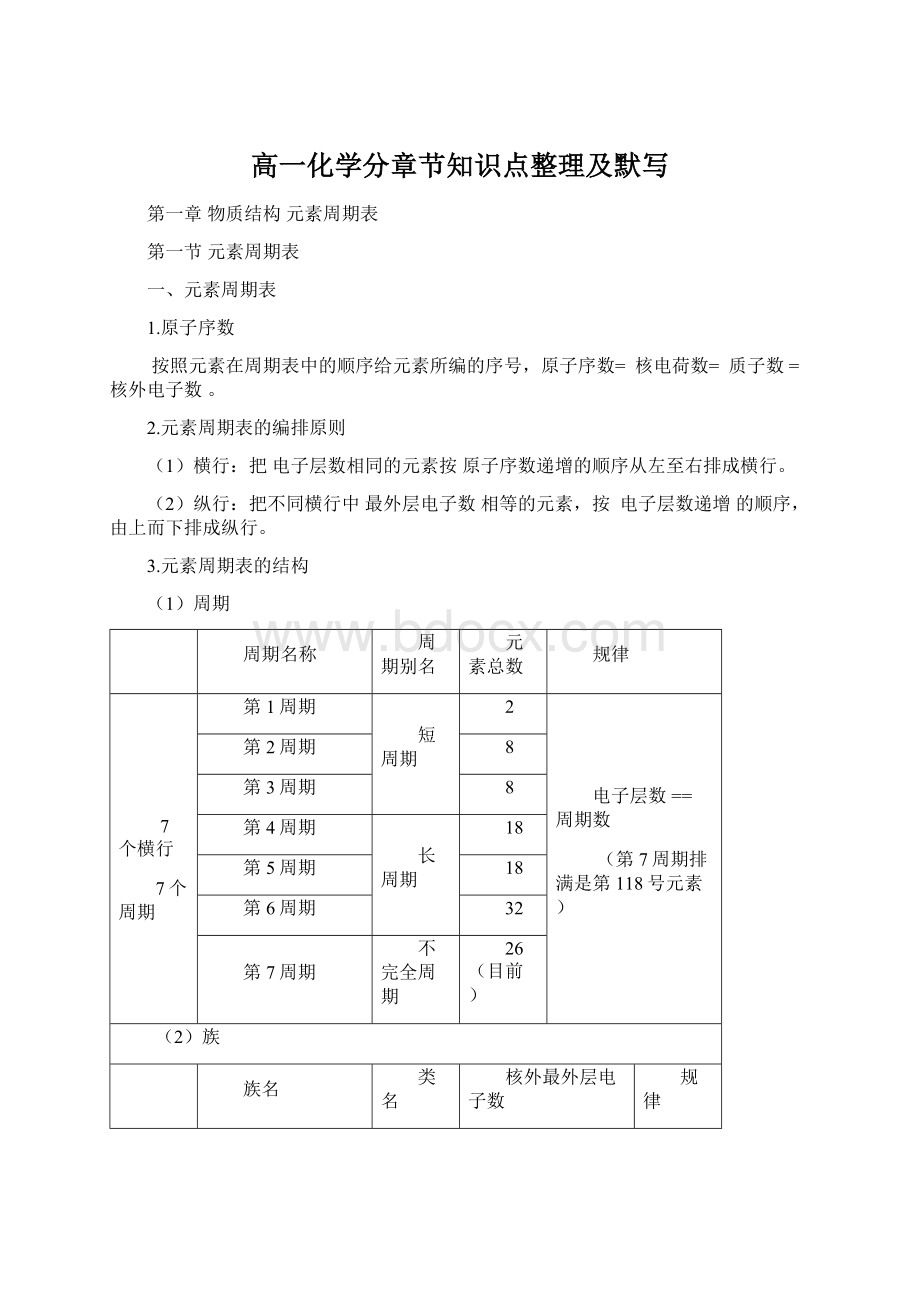
6
第ⅦA族
卤族元素
7
0族
稀有气体
2或8
副族
第ⅠB族、第ⅡB族、第ⅢB族、第ⅣB族、
第ⅤB族、第ⅥB族、第ⅦB族、第Ⅷ族
二、元素的性质与原子结构
1.碱金属(ⅠA族)
单质与水
反应情况
单质与氧气
最高价氧化物对应
水化物的碱性
最高化合价
Li
从上到下越来越剧烈
Li2O
碱性:
LiOH
NaOH
KOH
RbOH
CsOH
+1
Na
Na2ONa2O2
K
K2OK2O2KO2
Rb
更复杂
Cs
结论
金属性:
Cs>
Rb>
K>
Na>
同主族元素,从上到下,单质与水或酸反应越来越剧烈,最高价氧化物对应水化物的碱性越来越强,金属性越来越强。
2.卤素(ⅦA族)
化合价
最高价氧化物对应水化物的酸性
单质与氢气反应情况
气态氢化物的稳定性
最高
最低
F
无
-1
暗处剧烈反应并爆炸
稳定性:
HF
HCl
HBr
HI
Cl
+7
酸性:
HClO4
HBrO4
HIO4
光照或者点燃发生反应
Br
加热后反应
I
不断加热才能缓慢反应
非金属性:
F>
Cl>
Br>
同主族元素,从上到下,最高价氧化物对应水化物的酸性越来越强,单质与氢气反应越来越弱,气态氢化物的稳定性越来越弱,非金属性越来越弱。
总结:
同主族元素原子从上到下电子层数依次增多,原子半径逐渐增大,原子核对外层电子的吸引能力逐渐减弱,原子的失电子能力逐渐增强,得电子能力逐渐减弱;
元素单质的还原性逐渐增强,氧化性逐渐减弱;
最高价氧化物对应水化物的碱性增强,酸性增强;
气态氢化物的稳定性减弱。
同主族元素,从上到下,金属性越来越强,非金属性越来越弱。
三、核素
1.原子的构成
(1)原子的组成
质子(Z个)——决定元素的种类
原子
中子[(A-Z)个]——在质子数确定后同位素
决定原子种类
原子
()
核外电子(Z个)——最外层电子数决定元
素的化学性质
(2)符号中各数字的含义
(3)组成原子的各种微粒及相互关系
①质子数(Z)=核电荷数=核外电子数
②质量数(A)=质子数+中子数
③阳离子的核外电子数=质子数--所带电荷数
④阴离子的核外电子数=质子数+所带电荷数
2.元素、核素、同位素、同素异形体
元素
具有相同核电荷数即质子数的同一类原子的总称
核素
具有一定数目的质子和中子的一一种原子。
即:
原子=核素
同位素
具有相同质子数不同中子数的同一种元素的不同种原子(核素),互称为同位素。
例:
12C、13C和14C
同素异形体
同一种元素形成的性质不同的单质互为同素异形体。
金刚石和石墨,红磷和白磷,氧气和臭氧等
3.元素的相对原子质量
(1)目前已发现的110多种元素中,大多数都有同位素。
(2)一种天然存在的元素的各种核素分占的比例不一定相同,但所占的百分比组成不变。
(3)元素的相对原子质量是按各种天然同位素原子所占的一定百分比算出来的平均值。
元素周期表和相对原子质量表中的数值就是元素的相对原子质量,而非核素(或原子)的相对原子质量。
【总结归纳】
一、判断元素金属性、非金属性强弱的方法
1.根据金属活动性顺序表
金属的位置越靠前,其金属性越强。
2.根据实验
(1)元素金属性强弱的比较
①根据金属单质与水(或酸)反应的难易程度:
越易反应,则对应金属元素的金属性越强。
②根据金属单质与盐溶液的置换反应:
A置换出B,则A对应的金属元素比B对应的金属元素金属性强。
③根据金属单质的还原性或对应阳离子的氧化性强弱:
单质的还原性越强,对应阳离子的氧化性越弱,元素的金属性越强(Fe对应的是Fe2+,而不是Fe3+)。
④根据最高价氧化物对应水化物的碱性强弱:
碱性越强,则对应金属元素的金属性越强。
⑤根据电化学原理:
不同金属形成原电池时,作负极的金属活泼;
在电解池中的惰性电极上,先析出的金属其对应的元素不活泼。
(2)元素非金属性强弱的比较
①根据非金属单质与H2化合的难易程度:
越易化合则其对应元素的非金属性越强。
②根据形成的氢化物的稳定性或还原性:
越稳定或还原性越弱,则其对应元素的非金属性越强。
③根据非金属之间的相互置换:
A能置换出B,则A对应的非金属元素的非金属性强于B对应元素的非金属性。
④根据最高价氧化物对应水化物的酸性强弱:
酸性越强,则元素的非金属性越强。
⑤根据非金属单质的氧化性或对应阴离子的还原性强弱:
单质的氧化性越强,其对应阴离子的还原性越弱,元素的非金属性越强。
特别提醒
(1)元素的非金属性与金属性强弱的实质是元素的原子得失电子的难易,而不是得失电子的多少。
如Mg比Na失电子数多,但Na比Mg失电子更容易,故Na的金属性比Mg强。
(2)根据产物中元素化合价的高低可比较元素金属性和非金属性的强弱,例如2Fe+3Cl2=2FeCl3,Fe+S=FeS,则元素非金属性Cl>
S。
(3)用酸性强弱判断元素非金属性强弱时,一定是最高价含氧酸的酸性。
如酸性:
由H2SO4>
H3PO4可判断非金属性:
S>
P;
但酸性H2SO4>
HClO,HCl>
H2S,均不能用于判断元素非金属性强弱。
第二节元素周期律
一、原子核外电子的排布
1.电子层的表示方法及能量变化
电子层数
由内向外
数字表示法
字母表示法
L
M
N
O
P
Q
离核远近
由近及远
电子能量
由低到高
2.原子核外电子排布规律
(1)能量最低原理:
核外电子总是尽可能先排布在能量最低的(离原子核最近)的电子层里。
(2)每层最多容纳的电子数为:
2n2个
(3)最外层电子数最多不超过8个(k层为最外层时不超过2个)
(4)次外层电子数最多不超过18个。
(5)倒数第三层电子数最多不超过32个。
二、元素周期律
1.钠、镁、铝的性质比较:
(一)Na、Mg、Al和水的反应
Mg
Al
与冷H2O反应
与沸H2O反应
现象
与冷水剧烈反应放出氢气
与冷水反应缓慢,Mg带表面有气泡;
Mg带表面变红
与水不反应
化学方程式
2Na+2H2O=2NaOH+H2↑
Mg+2H2O=Mg(OH)2↓+H2↑
(二)Mg、Al和盐酸的反应
反应剧烈,放出大量的H2
反应迅速,放出大量的H2
反应方程式
Mg+2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
(三)Mg(OH)2的性质
加入NaOH
加入稀盐酸
不反应
Mg(OH)2+2HCl=MgCl2+2H2O
沉淀不溶解
沉淀溶解
(四)Al(OH)3的性质
加入NaOH,
现象
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+3HCl=AlCl3+3H2O
结论
Al(OH)3既能溶于,也能溶于稀盐酸
(五)归纳
单质与水(酸)反应
与冷水反应缓慢,与沸水迅速反应,放出氢气,与酸剧烈反应放出氢气
与酸迅速反应放出氢气
最高价氧化物水化物
NaOH
Mg(OH)2
Al(OH)3
碱性强弱比较
Mg(OH)2中强碱
Al(OH)3两性氢氧化物
2.硅、磷、硫、氯的性质比较
性质
Si
S
非金属单质与氢气反应的条件
高温
磷蒸气与氢气能反应
须加热
光照或点燃时发生爆炸而化合
最高价氧化物对应水化物的酸性强弱
H4SiO4
弱酸
H3PO4
中强酸
H2SO4
强酸
比H2SO4更强的酸
3、元素周期律:
元素的性质随原子序数的递增而呈周期性变化的规律。
实质:
元素原子核外电子排布周期性变化的结果。
4、元素周期表中主族元素性质的递变规律
内容
同周期(从左到右)
同主族(从上到下)
原子半径
逐渐减小
逐渐增大
电子层结构
电子层数:
相同
最外层电子数:
逐渐增多
得电子能力
逐渐增强
逐渐减弱
失电子能力
金属性
非金属性
主要化合价
最高正价:
主族序数
最低负价:
主族序数-8
最高正价数=主族序数
(O、F除外)
最高价氧化物对应水化
物的酸碱性
酸性逐渐增强
碱性逐渐减弱
酸性逐渐减弱
碱性逐渐增强
非金属元素气态氢化物
的形成及稳定性
气态氢化物的形成逐渐容易,气态氢化物稳定性逐渐增强
气态氢化物形成逐渐困难,气态氢化物稳定性逐渐减弱
三、元素周期表和元素周期律的应用
1.元素的分区
位于分界线附近的元素,既能表现出一定的非金属性,又能表现出一定的金属性。
2.元素周期律和元素周期表的应用
(1)根据周期表中的位置寻找未知元素。
(2)预测元素的性质(由递变规律推测)。
①比较不同周期、不同主族元素的性质。
如金属性Mg>
Al,Ca>
Mg,则碱性Mg(OH)2>
Al(OH)3,Ca(OH)2>Mg(OH)2(填“>
”、“<
”或“=”);
②推测未知元素的某些性质。
如已知Ca(OH)2微溶,Mg(OH)2难溶,可推知
Be(OH)2难溶;
再如:
已知卤族元素的性质递变规律,可推知未学元素砹(At)应为有色固体,与氢难化合,HAt不稳定,水溶液呈酸性,AgAt不溶于水等。
(3)启发人们在一定区域内寻找新物质。
①在周期表中金属与非金属的分界处寻找半导体材料;
②在周期表中的F、Cl、S、P等附近探索研制农药的材料;
③在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料等。
一、原子核外电子排布的特殊规律及电子数相等的微粒
1.记住1-20号元素的特殊的电子层结构
(1)最外层有1个电子的元素:
H、Li、Na、K;
(2)最外层电子数等于次外层电子数的元素:
Be、Ar;
(3)最外层电子数是次外层电子数2倍的元素:
C;
(4)最外层电子数是次外层电子数3倍的元素:
O;
(5)最外层电子数是内层电子总数一半的元素:
Li、P;
(6)最外层电子数是次外层电子数4倍的元素:
Ne。
(7)次外层电子数是最外层电子数2倍的元素:
Li、Si;
(8)次外层电子数是其他各层电子总数2倍的元素:
Li、Mg;
(9)次外层电子数与其他各层电子总数相等的元素:
Be、S;
(10)电子层数与最外层电子数相等的元素:
H、Be、Al。
2.10e-与18e-微粒
原子
分子
阴离子
阳离子
10e-
Ne
HF、H2O、
NH3、CH4
F-、
O2-、N3-、OH-、NH2-
Na+、
Mg2+、
Al3+、
H3O+、
NH4+
18e-
Ar
HCl、H2S、PH3、SiH4、
F2、H2O2、
N2H4、C2H6、CH3OH、CH3F
Cl-、S2-、HS-、
O22-
K+、Ca2+
二微粒半径的大小比较规律
1.同周期元素的原子半径随原子序数的递增逐渐减小。
如:
Na>
Mg>
Al>
Si(稀有气体的原子半径不参与比较)。
2.同主族元素原子的半径随原子序数的递增逐渐增大。
Li<
Na<
K<
Rb;
O<
S<
Se。
3.同周期阳离子半径随原子序数递增逐渐减小。
第三周期中:
Na+>
Mg2+>
Al3+。
4.同周期阴离子半径随原子序数递增逐渐减小。
P3->
S2->
Cl-。
5.同主族阳离子半径随原子序数递增逐渐增大。
第ⅠA族中:
Na+<
K+<
Rb+<
Cs+。
6.同主族阴离子半径随原子序数递增逐渐增大,如:
第ⅦA族中:
F-<
Cl-<
Br-<
I-。
7.阳离子半径总比相应原子半径小。
Na,Fe2+<
Fe。
8.阴离子半径总比相应原子半径大。
S,Br->
Br。
9.电子层结构相同的离子半径随核电荷数的增大而减小。
Cl->
K+>
Ca2+,Al3+<
Mg2+<
F-。
10.同一元素不同价态的离子半径,价态越高则离子半径越小。
Fe>
Fe2+>
Fe3+,H->
H>
H+。
在中学要求范畴内可按“三看”规律来比较微粒半径的大小:
一看电子层数:
在电子层数不同时,电子层数越多,半径越大;
二看核电荷数:
在电子层数相同时,核电荷数越大,半径越小;
三看电子数:
在电子层数和核电荷数均相同时,电子数越多,半径越大。
①此规律对于原子、离子之间的半径比较均适用;
②稀有气体元素的原子半径与同周期中相邻非金属原子半径不具有可比性,因测定依据不同。
第三节化学键
一、化学键、分子间作用力
1.化学键
(1)含义:
使离子相结合或原子相结合的作用力。
(2)特点:
①短程有效②强烈的相互作用
离子键
(3)分类:
化学键极性共价键
共价键
2.离子键和共价键非极性共价键
比较
离子键
共价键
概念
使阴、阳离子结合成化合物的静电作用
原子之间通过共用电子对所形成的相互作用
分类
————————
极性键
非极性键
成键粒子
阴、阳离子
特点
阴、阳离子间的相互作用
共用电对偏向一方
共用电对不偏向任一方
形成条件
①活泼金属和活泼非金属通过得失电子形成阴、阳离子
②带正电荷原子团(NH4+)与带负电荷的阴离子之间发生强烈相互作用
①不同非金属元素的原子间
②非金属元素与不活泼的金属元素之间
同种元素的原子间通过共用电子对结合
存在实例
离子化合物:
NaCl、NaOH
Na2SO4
共价化合物:
HCl、H2SO4
NH4Cl、NaOH
单质:
O2、
H2、Cl2
化合物:
C2H2、H2O2、Na2O2、
C2H6
3.化学反应的实
(1)化学键的形成
化学键的形成与原子结构有关,主要通过两个方面来实现。
①原子的价电子间的转移——离子键。
②原子的价电子间的共用——共价键。
(2)化学反应的本质
反应物分子内旧化学键的断裂和产物分子中_新化学键的形成_____。
4.分子间作用力和氢键
(1)分子间作用力
①定义:
把分子聚集在一起的作用力,又称范德华力。
②特点
a.分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
b.分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。
但像二氧化硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作用力。
③变化规律
一般说来,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。
例如,熔、沸点:
I2>
Br2>
Cl2>
F2。
(2)氢键
①定义:
分子间存在着一种比分子间作用力稍强的相互作用。
②形成条件:
除H外,形成氢键的原子通常是O、F、N。
③存在:
氢键存在广泛,如蛋白质分子、H2O、NH3、HF等分子之间。
分子间氢键会使物质的熔点和沸点升高。
【注意】
(1)由金属元素与非金属元素形成的化学键不一定是离子键,如AlCl3是共价化合物。
(2)由阳离子和阴离子结合生成的化合物不一定是离子化合物。
H++OH-=H2O,2H++CO32-=CO2↑+H2O。
(3)由两种共价分子结合生成的化合物也不一定不是离子化合物。
NH3+HCl=NH4Cl。
(4)有化学键被破坏的变化不一定是化学变化。
HCl溶于水,NaCl熔化等都有化学键被破坏,但都属于物理变化。
二、电子式、结构式
在元素符号周围,用“·
”或“×
”来表示原子的最外层电子(价电子)的式子。
书
写
微粒的种类
电子式的表示方法
注意事项
举例
元素符号周围标明价电子
价电子少于或等于4时以单电子分布,多于4时多出部分以电子对分布
阳离子
单原子
离子符号
右上方标明电荷
Mg2+
多原子
元素符号紧邻铺开,周围标清电子分布
用“[]”,右上方标明电荷
阴离子
元素符号周围合理分布价电子及所获电子
元素符号紧邻铺开,合理分布价电子及所获电子
相同原子不得加和,用“[]”,右上方标明电荷
单质及其化合物
离子化合物
由阳离子电子式和阴离子电子式组成
同性不相邻,离子合理分布
单质及共价化合物
各原子紧邻铺开,标明价电子及成键电子情况
原子不加和,无“[]”,不标明电荷
离子化合物形成过程
原子电子式→离子化合物电子式
电子转移方向及位置,用弧形箭头,变化过程用“→”,同性不相邻,合理分布
共价化合物形成过程
原子电子式→共价化合物电子式
无电子转移不用“→”,
不用“[]”,不标明电荷
2.结构式
用一根短线“-”表示一对共用电子,忽略其他电子的式子。
仅表示成键情况,不代表空间构型,
如H2O的结构式可表示为H-O-H或
都行。
写出常见物质的电子式:
N、O、N2、Cl2、H2O、NaCl、NaOH、NH4Cl
写出下列物质的结构式:
N2、CO2、CH4、NH3
用电子式表示下列物质的形成过程HCl、CaBr2
离子化合物和共价化合物及化学键与物质类别之间的关系
1.离子化合物、共价化合物与物质分类的关系
化合
物类型
定义
与物质分类
的关系
举例
离子
物
含有离
子键的
化合物
包括强碱、绝大多
数盐及活泼金属的
氧化物和过氧化物
NaCl、Na2O2
NaOH、
NH4Cl等
共价
只含有
的化合
包括酸、弱碱、极
少数盐、气态氢化
物、非金属氧化物、
大多数有机物等
H2S、SO2、
CH3COOH、
H2SO4、NH3、
H2O等
2.离子化合物、共价化合物的判断方法
(1)根据化学键类型来判断
一般来说,活泼的金属原子和活泼的非金属原子间形成的是离子键,同种或不同种非金属原子间形成的是共价键。
含有离子键的化合物一定为离子化合物,仅含有共价键的化合物一定为共价化合物。
(2)根据化合物的类型来判断
大多数碱性氧化物、强碱和盐都属于离子化合物;
非金属氢化物、非金属氧化物、含氧酸都属于共价化合物。
(3)根据化合物的性质来判断
①熔点、沸点较低的化合物是共价化合物。
②溶于水后不能发生电离的化合物是共价化合物。
③熔化状态下能导电的化合物是离子化合物,不导电的化合物是共价化合物。
3.化学键与物质类别之间的关系
除稀有气体无化学键外,其他物质内部都存在化学键。
化学键与物质类别关系规律可概括如下:
1.只含有极性共价键的物质一般是不同非金属元素形成的共价化合物。
如SiO2、HCl、CH4等。
2.只含非极性共价键的物质是同种非金属元素形成的单质。
如Cl2、P4、金刚石等。