学案化学反应速率化学平衡Word文档格式.docx
《学案化学反应速率化学平衡Word文档格式.docx》由会员分享,可在线阅读,更多相关《学案化学反应速率化学平衡Word文档格式.docx(13页珍藏版)》请在冰豆网上搜索。
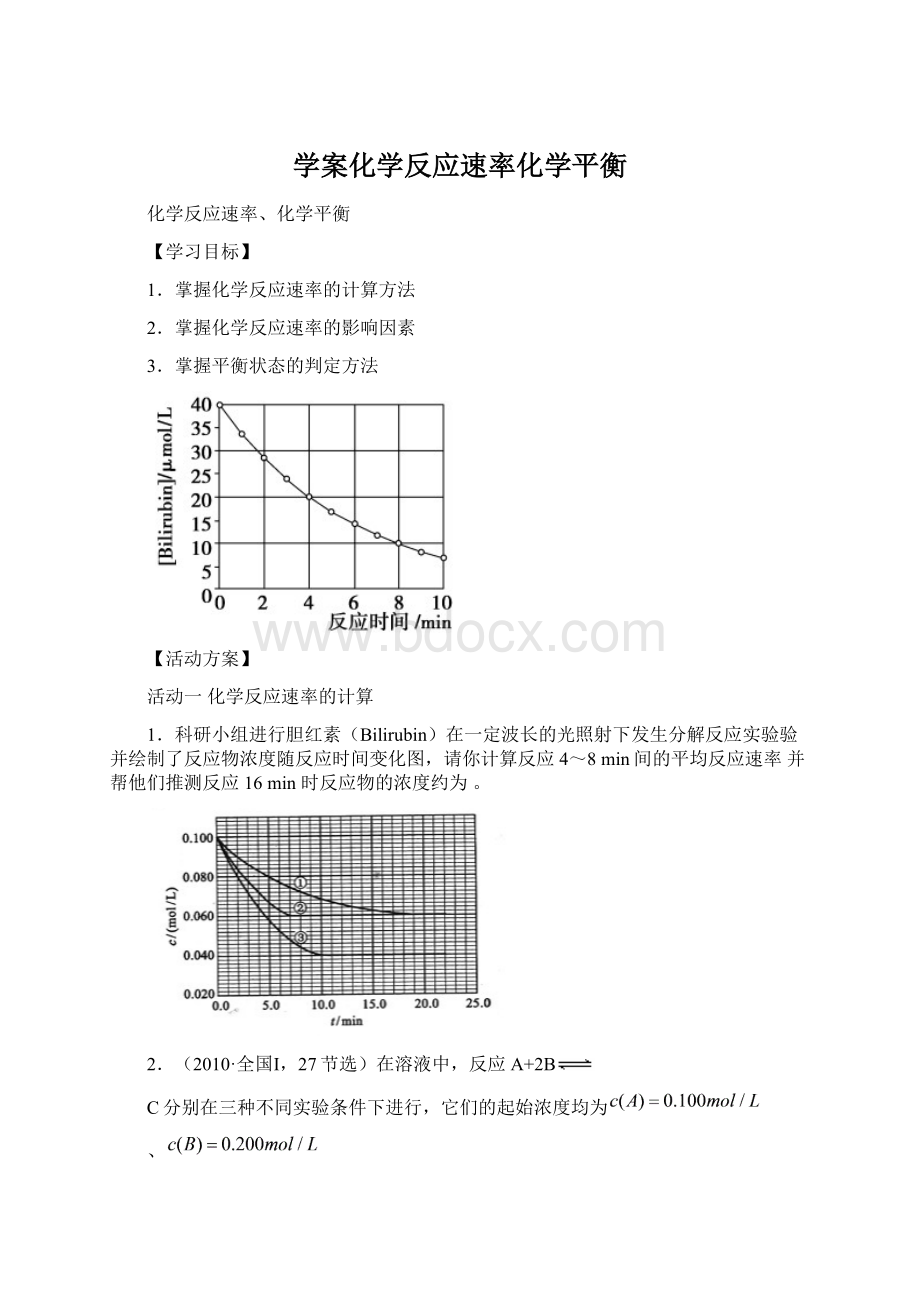
c/(mol·
L-1)
A
25
5
0.1
10
B
0.2
C
35
D
2、某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率,为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。
将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液
A
B
C
D
E
F
4mol/LH2SO4/mL
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
①请完成此实验设计,其中:
V1=,V6=,V9=;
②该同学最后得出的结论为:
当加入少量CuSO4溶液时,生成氢气的速率会大大提高。
但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。
请分析氢气生成速率下降的主要原因。
1.影响化学反应速率的因素:
温度、浓度、压强、催化剂、固体表面积、电化学
影响因素
温度
浓度
压强
催化剂
固体表面积
电化学
反应速率
2.从化学分子的角度分析以上影响因素。
3.理解“控制单一变量”在设计实验中的应用。
活动三化学平衡状态
1.(2011·
浙江,27节选)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应,将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)
2NH3(g)+CO2(g)。
可以判断该分解反应已经达到化学平衡的是___________。
A.
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变
2.(2011·
山东,28节选)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
一定条件下,将NO2与SO2以体积比1:
2置于密闭容器中发生上述反应NO2(g)+SO2(g)
SO3(g)+NO(g),下列能说明反应达到平衡状态的是。
a.体系压强保持不变b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变d.每消耗1molSO3的同时生成1molNO2
3.(2010·
上海,25节选)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)
2SO3(g)下列描述中能说明反应已经达到平衡的是
a.
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化d.容器中气体的分子总数不随时间而变化
1.平衡状态的判定维度:
速率、浓度、物质的量、平均分子量、密度、压强、体积分数、颜色。
2.本质是速率,其余是表象。
【课堂检测】
1.(2008·
上海,)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是()
A.4-3-2-1B.1-2-3-4C.3-4-2-1D.1-2-4-3
2.(2008·
上海)在2L密闭容器中,800℃时反应2NO(g)+O2(g)
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)用O2表示从0~2s内该反应的平均速率v=___________。
(2)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2)b、容器内压强保持不变
c、v逆(NO)=2v正(O2)d、容器内的密度保持不变
3.(2007·
广东)“碘钟”实验中,3I-+
=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。
某探究性学习小组在20℃进行实验,得到的数据如下表:
实验编号
①
②
③
④
⑤
c(I-)/mol·
L-1
0.040
0.080
0.160
0.120
c(
)/mol·
0.020
t/s
88.0
44.0
22.0
t1
回答下列问题:
(1)该实验的目的是_________________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0s(B)22.0s~44.0s(C)>44.0s(D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________。
参考答案:
1.2.5umol·
L-1·
min-1;
2.5umol·
L-1(提示:
4min-20,8min10,12min-5,16-2.5)
2.v(B)=
mol·
min-1
v(C)=
mol·
1.D,D中的温度最高,c(H2SO4)与其他组相同,c(Na2S2O3)最大,
2.①30,10,17.5②生成的铜单质会沉积在锌的表面,降低锌与溶液的接触面积。
1.BC2.B3.BD
1.AC(对比活动一中的单一变量)
2.AC
3.1.5×
10-3mol·
s-1,bc
4.
(1)研究反应物I-与S2O82-的浓度对反应速率的影响
(2)29.3s
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
化学平衡的移动
1、理解化学平衡移动
2、会应用反应速率、勒夏特列原理、化学平衡常数与浓度商的关系分析外界条件对化学平衡移动的影响
活动一化学平衡移动
1、对于一般的可逆反应,mA(g)+nB(g)
pC(g)+qD(g)达到平衡状态,当外界条件发生改变,若v(正)>v(逆),反应物浓度生应物浓度(填“增大”“减小”),称为平衡向移动(填“正”“逆”);
若v(正)<v(逆),反应物浓度生应物浓度(填“增大”“减小”),称为平衡向移动(填“正”“逆”)。
2.化学平衡移动原理:
改变影响化学平衡的一个因素(____、____、__),平衡将向着能够___________的方向移动。
3、在一定的温度下,对于可逆反应:
mA(g)+nB(g)
pC(g)+qD(g),
浓度商:
化学平衡常数:
Qc<K,平衡向移动;
Qc=K,反应处于平衡状态Qc>K,平衡向移动若升高温度,K值增大,则正反应为反应(填“吸热”或“放热”)。
若升高温度,K值减小,则正反应为反应(填“吸热”或“放热”)。
活动二会应用反应速率、勒夏特列原理、化学平衡常数与浓度商的关系分析外界条件对化学平衡移动的影响。
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)
CO2+H2(g)△H反应过程中测定的部分数据见下表(表中t3>t2>t1):
反应时间/min
n(CO)/mol
H2O/mol
1.20
0.60
0.80
t2
0.20
t3
①填写表格中空缺的数据;
②保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率,H2O的体积分数(填“增大”“减小”)
③保持其他条件不变,,反应达到平衡状态,向平衡体系中同时通入0.20molH2O和0.20molH2,与原平衡相比,达到新平衡时CO转化率(填“增大”“减小”)
④保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=mol。
⑤温度升至800℃,上述反应平衡常数为0.64,则△H0
课堂小结:
1、(2010安徽卷)低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)
H<
在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
2、(2011天津)已知反应②2CH3OH(g)
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
浓度/(mol·
L-1)
0.44
0.6
比较此时正、逆反应速率的大小:
v正______v逆(填“>
”、“<
”或“=”)。
1.减小,增加,正;
增加,减小,逆向。
2.C、T、P,减弱
3.注意强调“任意时刻”和“平衡状态”;
正向,逆向,吸热,放热。
①t10.20t20.80t30.800.20
②增大,增大
③增大(Qc=
<k,平衡正移)
④0.40
⑤<
1.C
2.>
等效平衡专题
1.认识到化学平衡的建立与“途径”无关。
2.运用“假设中间过程”的方法分析平衡的建立。
3.理解“等效平衡”的概念及建立的条件。
活动一反应前后气体体积不变的反应在不同情况下建立平衡的特点
在相同温度和压强下,对反应CO2(g)+H2(g)
CO(g)+H2O(g)进行六组实验,实验起始时放入容器内各组分的物质的量见下表
CO2
H2
CO
amol
0mol
2amol
⑥
3amol
上述六种情况达到平衡后,n(CO)的大小顺序是CO2的体积分数大小顺序。
若在条件为在温度、容积相同的6个密闭容器中进行实验,上述六种情况达到平衡后,n(CO)的大小顺序是CO2的体积分数大小顺序。
小结:
一定温度下,反应前后气体体积不变的反应在在恒容和恒压容器中建立平衡的特点。
即时巩固:
在一固定体积的密闭容器中,保持一定温度进行以下反应H2(g)+I2(g)
2HI(g)已知加入1molH2(g)和2molI2(g)时,达到平衡后生成amolHI(g)。
在相同体条件下,保持平衡时各组分的体积分数不变,根据下表编号①-③的状态填空
已知
编号
起始状态物质的量n/mol
平衡时HI(g)的物质的量n/mol
H2(g)
I2(g)
HI(g)
1
2
a
4
0.5a
m
g(g≥2m)
活动二反应前后气体体积改变的反应在不同情况下建立平衡的特点
在相同温度和压强下,按不同方式投入反应物,进行甲、乙、丙三组实验,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ·
mol
)
容器
甲
乙
丙
反应物投入量
1molN2、3molH2
2molNH3
4molNH3
c(NH3)mol·
L
c1
c2
c3
反应的能量变化
放出akJ
吸收bkJ
吸收ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
1.指出c1c2;
p1p2(填<、>、=)。
与
的数量关系。
a、b与92.4的数量关系。
2.指出2c2c3;
2p2p3;
2bc(填<、>、=);
a、c与92.4的数量关系。
若在条件为在温度、容积相同的3个密闭容器中进行实验则:
3.指出c1c2;
p1p2(填<、>、=)。
4.指出2c2c3;
2p2p3;
2bc(填<、>、=);
一定温度下,反应前后气体体积改变的反应在在恒容和恒压容器中建立平衡的特点。
如图所示,容器A左侧是可平行移动的活塞。
向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。
在相同温度和有催化剂存在的条件下,两容器各自发生:
X(g)+Y(g)
Z(g)+2W(g),△H<0
达到平衡时V(A)=1.2aL。
试回答:
(1)A中X的转化率为。
(2)A、B中X转化率大小关系为AB(填
“>”、“<”、“=”)
(3)打开K,一段时间后又达到新的平衡时,A的体积为L(连通管中气体体积不计)
(4)在(3)达到平衡后,同时等幅升高A、B的温度,达到平衡后,A的体积(填变大、不变、或变小),其理由是。
⑥>⑤>④=②>①=③;
⑥=④=②>⑤=③=①;
2a
0.5
2g-4m
(g-m)a
1.=;
=;
α1+α2=1;
a+b=92.4<>+αα
2.>;
>;
α1+α3=1;
a+
=92.4
3.=;
a+b=92.4
4.<;
α1+α3<1;
<92.4
(1)40%
(2)>
(3)2.6a
(4)变大;
温度升高,平衡向逆反应方向移动,体积减小;
但温度使气体体积增大,气体浓度减小,平衡向正反应方向移动,且压强不变时,气体体积与温度成正比,这是体积变化的主要原因。