高考化学计算专题Word下载.docx
《高考化学计算专题Word下载.docx》由会员分享,可在线阅读,更多相关《高考化学计算专题Word下载.docx(10页珍藏版)》请在冰豆网上搜索。
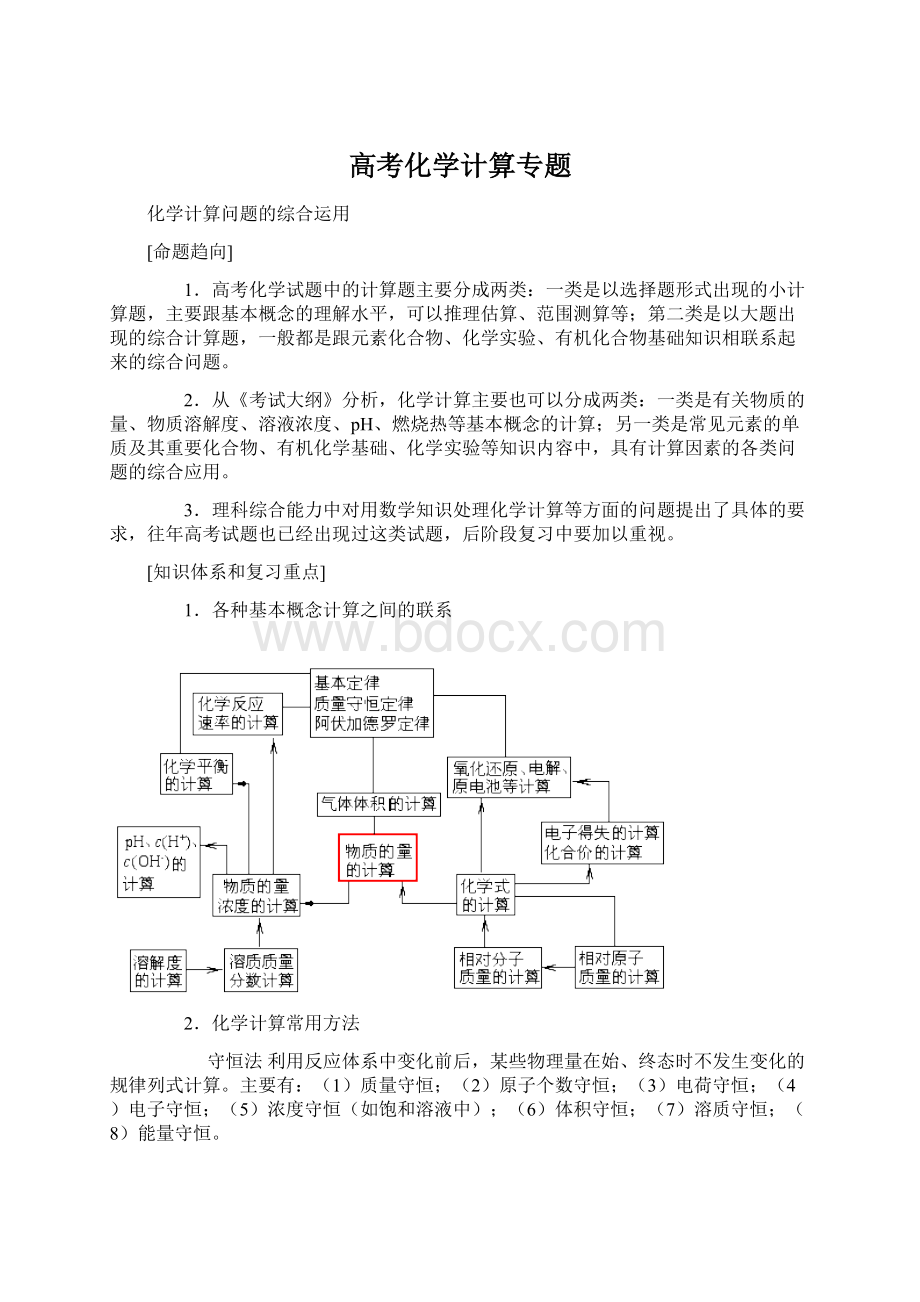
(5)平均摩尔电子质量法;
(6)平均密度法;
(7)平均浓度法……
关系式法对于多步反应体系,可找出起始物质和最终求解物质之间的定量关系,直接列出比例式进行计算,可避开繁琐的中间计算过程。
具体有:
(1)多步反应关系法:
对没有副反应的多步连续反应,可利用开始与最后某一元素来变建立关系式解题。
(2)循环反应关系法:
可将几个循环反应加和,消去其中某些中间产物,建立一个总的化学方程式,据此总的化学方程式列关系式解题。
十字交叉法实际上是一种数学方法的演变,即为a1x1+a2x2=a平×
(x1+x2)的变式,也可以转化为线段法进行分析。
(1)浓度十字交叉法;
(2)相对分子质量十字交叉法等。
极值法当两种或多种物质混合无法确定其成分及其含量时,可对数据推向极端进行计算或分析,假设混合物质量全部为其中的某一成分,虽然极端往往不可能存在,但能使问题单一化,起到了出奇制胜的效果。
常用于混合物与其他物质反应,化学平衡混合体系等计算。
讨论法当化学计算中,不确定因素较多或不同情况下会出现多种答案时,就要结合不同的情况进行讨论。
将不确定条件转化为已知条件,提出各种可能答案的前提,运用数学方法,在化学知识的范围内进行计算、讨论、推断,最后得出结果。
主要有以下几种情况:
(1)根据可能的不同结果进行讨论;
(2)根据反应物相对量不同进行讨论;
(3)运用不定方程或函数关系进行讨论。
估算法有些化学计算题表面看来似乎需要进行计算,但稍加分析,不需要复杂计算就可以推理出正确的答案。
快速简明且准确率高,适合于解某些计算型选择题。
但要注意,这是一种特殊方法,适用范围不大。
3.基本概念、基本理论、元素化合物、有机化学基础、化学实验等各部分内容中都隐含许多计算因素问题,复习中要加以总结归类。
如,有机化合物内容中的化学计算因素问题主要有:
(1)同系物通式的计算(通式思想的运用);
(2)同分异构体种数计算(空间想像、立体几何知识);
(3)有机化合物结构简式的确定(有机化合物性质跟所有化学基本计算的综合);
(4)有机物燃烧规律的计算(跟气体燃烧实验、气体吸收实验、气体干燥实验等的综合);
(5)有机反应转化率、产量的计算(跟工业生产实际的结合)。
[典型题析]
[例1]已知某饱和溶液的①溶剂质量;
②溶液质量;
③溶液的体积;
④溶质的摩尔质量;
⑤溶质的溶解度;
⑥溶液的密度。
利用以上部分已知条件不能计算出该溶液的物质的量浓度的是()。
(A)①②④⑥ (B)④⑤⑥ (C)②③④⑤ (D)③④⑥
[解析]根据物质的量浓度的计算公式(c=n/V、c=1000dw/M)入手分析。
对于A,由①和②求出溶质的质量,其结果与④结合求出溶质的物质的量,由①和⑥推出溶液的体积,把这两项结果代入公式c=n/V就可求出物质的量浓度。
对于B,根据⑤可求出溶质的质量分数,把所求得的质量分数、④和⑥一起代入c=1000dw/M就可求得物质的量浓度。
对于C,根据⑤推得溶质的质量,其结果和④一起可求得溶质的物质的量,再根据已给的已知条件③,可求出溶质的物质的量浓度。
对于D,其中没有溶质质量这一条件,无法求解物质的量浓度。
答案选D。
[例2]往100mLpH=0的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。
则反应前的混合溶液中含硝酸的物质的量为()
(A)0.02mol (B)0.08mol (C)0.10mol (D)0.16mol
[解析]应根据离子方程式进行计算
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
0.06 0.1 0.02
铜、H+过量,所以只可能是硝酸不足,进而可计算出硝酸的物质的量为0.02mol。
选A。
有的同学会习惯于用硝酸跟铜反应的化学方程式进行计算,忽视了硫酸电离出的H+造成错解。
要重视离子方程式在化学计算中的应用。
[例3]向Cr2(SO4)3的水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-)。
其平衡关系如下:
Cr3++3OH-
Cr(OH)3
CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol·
L-1的Cr2(SO4)3溶液50mL中,加入1.0mol·
L-1的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为()
(A)溶液为紫色 (B)溶液中有灰绿色沉淀 (C)溶液为亮绿色 (D)无法判断
[解析]这是一例涉及到两性氢氧化物的性质、离子反应、物质的量计算、pH估算等多方面知识的综合性试题,主要考查化学计算能力、知识迁移能力和信息加工能力等。
据题中Cr(OH)3的电离方程式可知,1molCr3+可跟4molOH-完全反应生成CrO2-。
题中条件可转化为0.005molCr3+跟0.05molOH-反应,所以Cr3+可全部生成CrO2-且还有0.03molOH-过量。
所得混合溶液的体积可近似看成是100mL,近似估算出pH>
13。
所以最后溶液为亮绿色,选C。
[例4]取0.15L未知浓度的浓硫酸,加入铜片后加热,使铜片全部溶解。
冷却所得的溶液到室温后定容为1L,取出定容后的溶液50mL,加入还原铁粉7.00g,充分反应后生成1.68L(标准状况)气体,溶液下部残渣质量为3.04g,所得溶液中只有硫酸亚铁。
求原硫酸溶液的物质的量浓度。
[解析]本题涉及到反应物过量总是的判断,多步反应的分析问题,溶液稀释有关计算等。
是一道既基础又有一定综合性的计算题。
解答这类计算题的关键是将题给信息进行加工处理。
可将题中信息可概括如下:
0.15L浓硫酸
1L溶液(CuSO4和H2SO4)
50mL溶液
生成1.68LH2(相当于0.075mol、消耗4.2gFe)、残留3.04g固体(可能是铜或铜、铁混合物)、FeSO4溶液。
先判断最后一步反应中铁是否过量:
2.8g铁若完全跟硫酸铜反应可生成3.2g铜。
说明铁过量,最后残留固体是铁、铜的混合物。
用差量法计算50mL溶液中CuSO4的物质的量为0.03mol。
所以原溶液中共有H2SO4:
(0.075+0.03×
2)×
1000/50=2.7mol
硫酸的物质的量浓度为:
18mol/L。
[例5]超细氮化铝粉末被广泛应用于大规模集成电路生产领域。
其制取原理为:
Al2O3+3C+N2
2AlN+3CO
由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质,为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的氢氧化钠溶液中共热并蒸干,AlN跟氢氧化钠溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为_________________________。
②该样品中的AlN的质量分数为_____________。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·
L-1(已折成标准状况,AlN不跟O2反应)。
该样品中含杂质炭_____g。
[解析]
(1)AlN跟氢氧化钠溶液反应,生成NaAlO2、并放出NH3,反应方程式为:
AlN+NaOH+H2O=NaAlO2+NH3↑
生成0.15molNH3,可计算出10.00g样品中含有AlN的质量为6.15g,所以AlN的质量分数为61.5%。
(2)加入氧气的物质的量为:
2.016/22.4=0.09mol
高温下2.016L(标准状况)O2充分反应,产物可能CO2、CO或CO2和CO的混合气体。
根据气体产物的密度可计算出气体产物的平均相对分子质量为30,所以生成气体必定是混合气体。
设混合气体中含有CO2xmol,COymol,根据氧原子守恒和平均相对分子质量的计算方法可得出:
2x+y=0.18
44x+28y=30(x+y)
解得:
x=0.02,y=0.14。
所以,样品中C的质量为:
(0.02+0.14)×
12=1.92g。
[评析]陌生的命题素材中包含着熟练的基本原理,要求解题者一环扣着一环地进行探索,第2问中,解题条件隐蔽,易给人造成障碍。
专题训练
1.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是()
①
②
③
④
⑤
甲
物质微粒数
标准状况下气体摩尔体积
固体体积
溶液的质量百分比浓度
非标准状况下物质的质量
乙
阿伏加德罗常数
标准状况下气体体积
固体密度
溶液的体积
物质的摩尔质量
(A)②③④ (B)③④⑤ (C)③④ (D)③
2.中和滴定是利用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸),若用A代表酸,用B代表碱,可以利用下式来计算未知碱的物质的量浓度的是(ν为化学计量数)()
(A)cB=VB/VA·
cAVA/VB (B)cB=VB/VA·
cAVB/VA
(C)cB=cAVA/VB (D)cB=VA/VB·
cAVA/VB
3.在四个不同的容器中,在不同的条件下进行合成氨反应。
根据在相同时间内测定的结果判断,生成氨的速率最快的是()
(A)υ(H2)=0.1mol·
L-1·
min-1 (B)υ(N2)=0.2mol·
min-1
(C)υ(NH3)=0.15mol·
min-1 (D)υ(H2)=0.3mol·
4.设NA为阿伏加德罗常数,如果ag某气态双原子分子的分子数为p,则bg该气体在标准状况下的体积V(L)是()
(A)22.4ap/bNA (B)22.4ab/pNA (C)22.4ap/ab (D)22.4pb/aNA
5.下列各组物质中各有两组份,两组份各取1mol,在足量氧气中燃烧,两者耗氧量不相同的是()
(A)乙烯和乙醇目 (B)乙炔和乙醛 (C)乙烷和乙酸甲酯 (D)乙醇和乙酸
6.CuCO3和Cu2(OH)2CO3的混合物34.6g恰好完全溶解于300mL2mol·
L-1盐酸溶液中,加热分解等量的这种混合物可得氧化铜()
(A)16.0g (B)19.2g (C)24.0g (D)30.6g
7.氯化铵晶体与消石灰的固体混合物90.5g,在150℃下加热至质量不再减少为止,得到残渣40.5g。
则原混合物中氯化铵和消石灰的物质的量之比()
(A)等于2:
1 (B)大于2:
1 (C)小于2:
1 (D)等于1:
1
8.某二价金属的碳酸盐和碳酸氢盐的混合物与足量盐酸反应,消耗H+和产生CO2的物质的量之比为5:
4,则混合物中碳酸盐和碳酸氢盐的物质的量之比为()
(A)1:
2 (B)1:
3 (C)3:
4 (D)4:
5
9.在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
序号
锌的质量(g)
锌的形状
温度(℃)
完全溶解于酸的时间(s)
A
2
薄片
400
B
15
200
C
25
100
D
30
t1
E
35
50
F
颗粒
t2
G
粉末
t3
则下列说法正确的是()
①t1=75s;
②t2>200>t3;
③单位时间内消耗锌的质量mG>mF>mB。
(A)①② (B)只有② (C)全部正确 (D)①
10.中和一定量的某醋酸溶液时,消耗氢氧化钠mg。
如果先向该醋酸的溶液中加入少量醋酸钠,然后再用氢氧化钠中和,此时可消耗氢氧化钠ng。
则m和n的大小关系是()。
(A)m>
n (B)m<
n (C)m=n (D)无法确定
11.实验室有甲、乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。
为确定甲、乙两瓶溶液的成分及其物质的量浓度,现操作如下:
①量取25.00mL甲溶液,向其中缓慢滴加乙溶液15.00mL,共收集到二氧化碳气体224mL。
②另取15.00mL乙溶液,向其中缓慢滴加甲溶液25.00mL,共收集到二氧化碳气体112mL。
上述气体体积均已换算为标准状况,则根据上述操述及实验数据填空:
(1)写出上述过程中所涉及反应的离子方程式____________;
(2)甲是_______,甲溶液的物质的量浓度为________,乙溶液的物质的量浓度为________;
(二氧化碳在溶液中的少量溶解忽略不计)
(3)将nmL的甲溶液与等体积的乙溶液按各种可能的方式混合,产生的气体体积为VmL(标准状况),则V的取值范围为__________________。
12.某校课外活动小组为测定生石膏的组成(CaSO4·
xH2O),即测定x值,做如下实验:
将生石膏放在坩埚中加热,加热前、后都进行称量。
随实验次数增加,加热时间不断延长,最后整理加热前后固体质量数据如下表(下图为根据数据绘制的图象):
实验顺序
加热前(g)
加热后(g)
3.44
3.26
3.12
3
2.90
4
2.80
6
2.78
7
2.72
8
(1)利用实验数据,通过计算推断生石膏的化学式。
(2)通过计算解释图象中产生AB段的原因。
(3)若将所得的固体残渣继续升温灼烧,发现质量还会减轻,简述你认为可能的原因。
13.将等物质的量的两种氧化物溶于100mL硫酸中,而后逐滴加入l.00mol·
L-1的NaOH溶液。
当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加。
当NaOH的体积V2=650mL时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小。
当V3=750mL时,沉淀量不再改变。
(1)最初加入的50mLNaOH溶液的作用是什么?
(2)计算所用硫酸的浓度。
(3)试判断两种氧化物各是什么,并计算其物质的量。
14.A、B都是芳香族化合物,1molA水解得到1molB和1molCH3COOH。
A、B的分子量都不超过200,完全燃烧时都只生成CO2和H2O,且化合物B中碳和氢元素的质量分数之和为0.652。
A溶液具有酸性,不能使氯化铁溶液显色。
请填写下列空白:
(1)A、B分子量之差为____________。
(2)B分子中应该有的氧原子数为____________。
(3)B的分子量是_______________。
(4)B可能的三种结构简式是_____________、_____________、_______________。
15.有机物A和B由C、H、O三种元素组成,两者互为同系物,且已知A分子的碳原子数较B分子少,B的相对分子质量不超过70。
现有等物质的量A和B的混合物,其中氧的质量分数为。
取一定量该混合物,与一定量的氧气混合点燃,在120℃101kPa的条件下,将燃烧产物通入足量浓硫酸,气体体积减少为原来的二分之一;
再将剩余气体通入碱石灰,气体全部被吸收。
(1)该混合物的平均相对分子质量为_____________。
(2)A的分子式为___________,B的分子式为_______________。
专题训练答案
1C。
2A。
3B。
4D。
5D。
6C。
7B。
8B。
9B。
10C。
11.
(1)CO32-+2H+=CO2↑+H2O,CO32-+H+=HCO3-,HCO3-+H+=CO2↑+H2O(不按上述顺序书写或未写CO32-+2H+=CO2↑+H2O不得分)
(2)盐酸(或HCl)0.8mol·
L-11.0mol·
L-1。
(3)0≤V≤8.96n或[0,8.96n]
12.
(1)CaSO4·
H2O
CaSO4+xH2O
136+18x 136 18x
3.44 2.72 0.72
x=2 CaSO4·
2H2O
(2)(实验数据和图象AB段说明分解过程中,有一固定组成的化合物存在。
)
CaSO4·
2H2O
CaSO4·
yH2O+(2-y)H2O
172 136+18y
3.44 2.90
y=1/2, 该化合物是2CaSO4·
H2O。
加热过程中生石膏转化成相对稳定的2CaSO4·
H2O,所以图象中存在一段时间内质量不变的AB段。
(3)CaSO4受高温灼烧还可以继续分解放出气体。
13.
(1)中和过量的硫酸。
(2)由题意知,其中一种氧化物为氧化铝,根据Al(OH)3+OH-=AlO2-+2H2O
该反应中用去的n(NaOH)=1.00mol/L×
(0.750-0.650)L=0.100mol
故氢氧化铝为0.100mol,而氧化铝为0.0500mol
根据Al3++3OH-=Al(OH)3
生成氢氧化铝用去0.300molNaOH。
而生成另一种氢氧化物也用去0.300molNaOH,且已知两种氧化物的物质的量相等,故另一种氧化物也是三价金属的氧化物,且不溶于过量的碱溶液中,可知其为氧化铁。
氧化铁的物质的量为0.0500mol。
14.
(1)42。
(2)3。
(3)138。
(4)
(还有间、对位两种)。
15.混合物中氧的质量分数为16/51,则其中碳、氢两种元素的质量分数之和为(51-16)/51。
再根据燃烧后生成等物质的量的CO2和H2O,可得出碳、氢两种元素的质量之比为12:
2。
所以,燃烧前混合物中C、H、O三种元素的原子个数比为:
C:
H:
O=35/14:
35×
2/14:
16/16=2.5:
5:
1。
则,混合物的平均分子式可能是(C2.5H5O)x。
结合"
B的相对分子质量不超过70"
进行讨论,可得出A为C2H4O,B为C3H6O。
平均相对分子质量为51。