元素化合物复习小专题总结1Word文档格式.docx
《元素化合物复习小专题总结1Word文档格式.docx》由会员分享,可在线阅读,更多相关《元素化合物复习小专题总结1Word文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
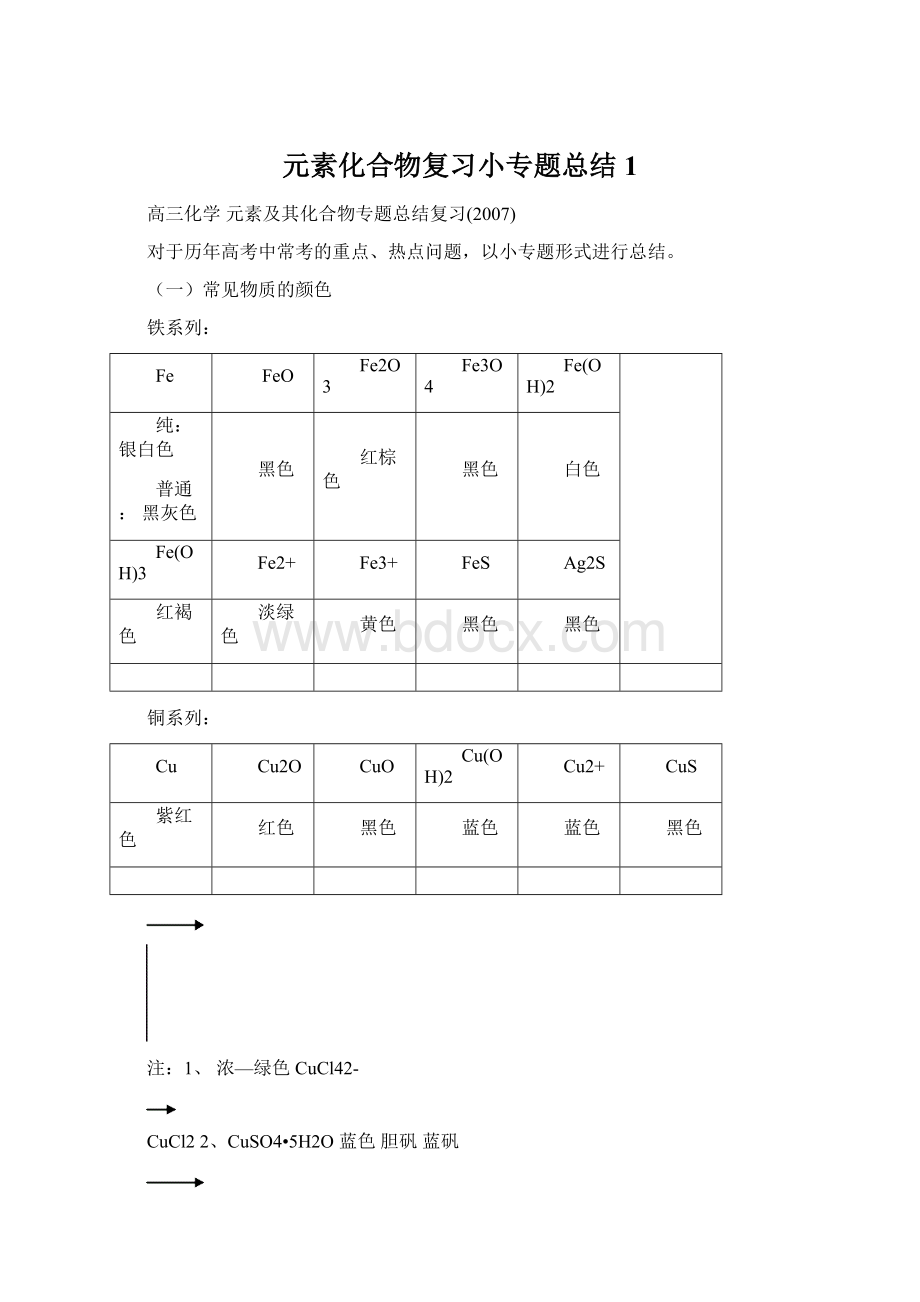
蓝色
注:
1、浓—绿色CuCl42-
CuCl22、CuSO4•5H2O蓝色胆矾蓝矾
稀—蓝色Cu(H2O)42+无水CuSO4白色
锰系列
MnO2
MnO4-
Mn2+
紫色
肉粉色
(无色)
第ⅦA族
1、卤素单质的颜色
F2
Cl2
Br2
I2
单质
淡黄绿色
黄绿色
红棕色
紫黑色
水溶液
——
橙黄色
萃取剂中(C6H6CCl4)
——
橙红色
2、卤化银的颜色
AgCl
AgBr
AgI
浅黄色
第ⅥA族S—黄色O3—淡蓝色
第ⅤA族红磷白磷NO2—红棕色
第ⅣA族石墨—灰黑色
第ⅠA族Na2O2—淡黄色
有机物三硝基甲苯—淡黄色
按七色:
赤:
Cu(紫红)Cu2O(红)Fe2O3(红棕)Fe(OH)3(红褐)Br2(红棕)NO2(红棕)红磷(红)在空气中久置的苯酚(粉红色)
橙:
萃取剂中Br2(橙红)
黄:
Na2O2(淡黄)AgBr(浅黄)AgI(黄)S(黄)Fe3+(黄)Cl2(黄绿)F2(浅黄绿)碘水(黄)三硝基甲苯(淡黄)工业盐酸(Fe3+)、蛋白质加浓硝酸、钠焰色
绿:
Fe2+(淡绿)
青(黑):
FeFeOFe3O4FeSCuSAg2SMnO2石墨(灰黑)
蓝:
Cu2+Cu(OH)2CuSO4•5H2OO3(淡蓝)
紫:
MnO4-[Fe(C6H5O)6]3-钾的焰色、
例题1(2004全国28)
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。
上层液体中插入两根石
墨电极,圆筒内还有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,
装置如右图。
接通电源,阳极周围的液体呈现棕色,
且颜色由浅变深,阴极上有气泡生成。
停止通电,取出电极,
用搅棒上下剧烈搅动。
静置后液体又分成两层,下层液体呈紫红色,
上层液体几乎无色。
(1)阳极上的电极反应式为。
(2)阴极上的电极反应式为。
(3)原上层液体是。
(4)原下层液体是。
(5)搅拌后两层液体颜色发生变化的原因是。
(6)要检验上层液体中含有的金属离子,其方法是,
现象是
例题2:
.A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。
下述
为相关实验步骤和实验现象:
请回答:
(1)写出A、B和C的化学式:
A,B,C。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸
根离子)的离子方程式:
,。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式:
。
例题3
物质A~G有如图所示转化关系(部分反应物和生成物没列出)。
已知向D溶液中滴入几滴KSCN溶液,溶液呈红色。
(1)写出化学式:
A_____甲______C_____F_________
(2)溶液D+Na2O2的反应现象是:
(二)反应类型专题小结
1、既能与强酸反应,又能与强碱反应的物质一般有:
•①某些金属Al
•②两性氧化物Al2O3
•③两性氢氧化物Al(OH)3
•④弱酸的酸式盐如NaHCO3、NaHS、NaHSO3、Na2HPO4、NaH2PO4等
•⑤弱酸的铵盐如:
(NH4)2S、(NH4)2CO3、CH3COONH4、(NH4)2SO3等
•⑥氨基酸如:
H2N-CH2-COOH
例题4:
有下列图示的一系列变化:
A的化学式可能是____________或_____________。
2、需要催化剂的反应
例题5:
.已知:
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。
元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是,Z是。
(2)写出③中反应的化学方程式:
(3)写出④中反应的化学方程式:
3、置换反应
①金属置换出金属Fe+CuSO4=Cu+FeSO4
铝热反应:
Al+高熔点金属氧化物
②金属置换出非金属Fe+2H+=Fe2++H22Na+2H2O=2NaOH+H2
2Mg+CO2=2MgO+C3Fe+4H2O=Fe3O4+4H2
例题6:
(06全国Ⅰ—27)
置换反应的通式可以表示为:
单质
(1)+化合物
(1)=化合物
(2)+单质
(2)
请写出满足以下要求的3个转换反应的化学方程式:
①所涉及的元素的原子序数都小于20;
②6种单质分属6个不同的主族。
例题7:
①若A为第三周期金属元素的单质,
不与NaOH溶液反应;
B为黑色固态的非金属单质。
则反应的化学方程式为
②若A为第三周期金属元素的单质,X是红棕色粉末;
化合物Y可溶于NaOH溶液。
则每生成1molB,反应中转移电子的数目为mol。
③若X在常温下为无色液体,Y是具有磁性的黑色晶体,B是气态非金属单质。
则A元素在周期表中的位置为周期______族。
该反应的化学方程式为。
例题8:
X、Y、Z为短周期元素的单质,U、V为它们的化合物,
这些物质之间的关系如下图所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同族时,写出反应I的化学方程式:
①若已知U是水:
(此小题不考虑Z参加反应)
___________________________
②若已知V是水:
_____________________________
③若U、V均为氧化物____________________
(2)如果X、Y的组成元素不同族时,
按下列要求写出X、Y、Z的分子式。
①X组成元素是地壳中含量最多的金属元素时,
则X为________;
Y为________;
Z为____________
②若Y组成元素在自然界中形成的化合物种类最多时,
③若Z是密度最小的物质,则X为________;
4、连续被氧化的反应
例题9:
已知下列物质均由短周期元素组成,X无论是盐酸还是NaOH溶液,转化均能进行,又知C的相对分子质量比D少16,A、B、C、D、E均含有相同一种元素。
(酸式盐)(无机强酸)
(1)当X为盐酸时,则E为_______,A中阴离子是______。
(2)当X为NaOH溶液时,写出A与X反应的离子方程式:
5、需要高温的反应
(1)C+(SiO2、H20、Fe2O3)
(2)SiO2+(CaO、Na2CO3、CaCO3)
(3)铝热反应(4)铁和水蒸气(5)硫铁矿、碳酸钙煅烧
例题10:
.A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。
A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:
(1)形成单质A的原子的结构示意图为,它的最高化合价为。
(2)B的化学式(分子式)为,B的晶体类型为。
B和碳反应生成A和E的化学方程式是。
(3)C的化学式(分子式)为,D的化学式(分子式)为。
例题11:
.A、B、C是中学化学中常见的单质。
甲、乙两化合物在常温下分别为固体和液体。
这些化合物和单质之间有如下关系:
(1)单质A、________B、________C、______
(2)写出③的化学方程式________________________
(3)甲还能与另一种常见金属在一定的条件下反应,写出该反应的化学方程式______。
6、在氧化还原反应中,水的作用
(1)水做氧化剂Na+H20—;
C+H2O-;
CO+H2O—;
Fe+H2O—
(2)水做还原剂F2+H2O—
(3)水既是氧化剂又是还原剂H2O电解H2+O2
(4)水既不是氧化剂也不是还原剂Na2O2+H2O—;
NO2+H2O—;
Cl2+H2O—
(三)常见物质的气味
刺激性气味:
HX、Cl2NH3NO2乙醛甲醛臭鸡蛋气味:
H2S
特殊臭味:
O3、电石生产的乙炔(含PH3、H2S)特殊气味:
C6H6苯酚
苦杏仁味:
硝基苯香味:
酯类化合物
(四)有毒的物质
第ⅦA族:
F2Cl2HF
第ⅥA族:
H2SSO2
第ⅤA族:
NONO2NaNO2白磷
第ⅣA族:
CO
有机物:
苯硝基苯甲醇苯酚
(五).关于10e-和18e-微粒
10e-的微粒:
NeO2-F-Na+Mg2+Al3+HFH2ONH3CH4OH-H3O+NH2-
NH4+
18e-的微粒:
ArCl-S2-K+Ca2+HS-HClH2SPH3SiH4F2H2O2CH3OHC2H6N2H4
例12(08年全国II—26)(16分)用A+、B-、C2―、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是①、B元素是②、C元素是③(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是④。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是⑤。
(4)F是由两种元素组成的三原子分子,其分子式是⑥,电子式是⑦。
(5)G分子中含有4个原子,其分子式是⑧。
(6)H分子中含有8个原子,其分子式是⑨。
例13(08年北京—26)(13分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知:
a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是。
(4)nmol丁与nmol丙在一定条件下反应,生成4nmol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是。
例14、a、b、c、d、e是常见的分子和离子,他们具有相同的电子数,已知a、b、e是离子且d能与一些酸性氧化物和碱性氧化物反应。
它们之间的关系为:
a+b
c+d,b+e
d。
则a的电子式为_____________,b的化学式为____________,e的电子式为____________。
实验室制取c的化学方程式为_______________________________。
例15、已知A、B、C、D是中学化学中常见的四种不同的微粒。
它们之间存在如下转化关系:
(1)如果A、B、C、D均是10电子的微粒,请写出:
A的化学式________________;
D的分子式_________。
(2)如果A和C是18电子的微粒,B和D是10电子的微粒,请写出:
①A和B在溶液中反应的离子方程式:
_______________________________。
②根据上述离子方程式,可以判断C和B结合质子的能力的大小是(用化学式或离子符号表示)______________________。
☆例16、有A、B、C、D四种单质,在一定条件下,B可以和A、C、D化合生成化合物甲、乙、丙,C和D化合生成化合物丁。
已知甲、乙、丙的每个分子中都含有10个电子,并且甲、乙、丙、丁有以下关系:
请填写以下空白:
(1)单质B的化学式;
(2)单质A跟化合物乙发生反应的化学方程式;
(3)根据化合物丙、丁中D元素的化合价,判断丙和丁能否在一定条件下发生化学反应生成D单质,若认为能反应,写出反应的化学方程式,若认为不能反应,简要说明理由。
答案:
例1、
(1)2I--2e-=I2
(2)2H++2e-=H2
(3)KI(或NaI)水溶液(4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中。
(6)焰色反应透过蓝色钴玻璃观察火焰呈紫色
例2、
(1)NaI,NaClO,AgI
(2)2I-+ClO-+H2O=I2+Cl-+2OH-
I2+5ClO—+2OH—=2IO3-+5Cl-+H2O
(3)2Fe3++SO32—+H2O=2Fe2++SO42—+2H+
(4)Cl2+2NaOH=NaClO+NaCl+H2O
例3、
(1)Fe,HNO3,H2,Fe(OH)3
(2)有气泡产生,并有红褐色沉淀。
例4、(NH4)2SO3;
NH4HSO3
例5、
(1)Cl(或氯)、K(或钾)
(2)Cl2+2KOH=KCl+KClO+H2O (3)
例6、2Al+6HCl=2AlCl3+3H22F2+2H2O=4HF+O22Mg+CO2==2MgO+C
例7、
(1)2Mg+CO2==2MgO+C
(2)3(2Al+Fe2O3=2Fe+Al2O3)
(3)4、Ⅷ、3Fe+4H2O=Fe3O4+4H2
例8、
(1)①2Na+2H2O==2NaOH+H2↑②2H2S+O2===2S+2H2O
③2C+SiO22CO+Si
(2)①X为Al;
Y为H2;
Z为Cl2②X为Mg;
Y为C;
Z为O2
③X为F2;
Y为O2;
Z为H2或X为Cl2;
Y为S;
Z为H2
例9、
(1)H2SO4S2-
(2)NH4++HS-+2OH-=NH3+S2-+2H2O
例10、
(1)+4
(2)SiO2原子晶体SiO2+2C
Si+2CO(3)CaSiO3Na2SiO3
例11、
(1)A、Fe;
B、O2;
C、H2
(2)Fe3O4+4H23Fe+4H2O
(3)3Fe3O4+8Al9Fe+4Al2O3
例12
(1)KC1S
(2)HC1
(3)F2
(4)H2SH
H
(5)H2O2(答PH3同样给分)
(6)C2H6
例13.(13分)
(1)
(2)①
②NH4Cl、Ca(OH)2(合理答案均给分)
③NH3·
H2O
NH4++OH-
(3)PCl5
(4)P3N3Cl6
例14、
(1)
;
OH-;
(2)2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
例15、
(1)NH4+;
H2O
(2)①H2S+OH—=HS—+H2O;
HS—+OH—=S2—+H2O②B>
C
例16、
(1)H2
(2)2F2+2H2O==4HF+O2(3)4NH3+6NO==5N2+6H2O