千人桥中学高考化学专题物质结构文档格式.docx
《千人桥中学高考化学专题物质结构文档格式.docx》由会员分享,可在线阅读,更多相关《千人桥中学高考化学专题物质结构文档格式.docx(16页珍藏版)》请在冰豆网上搜索。
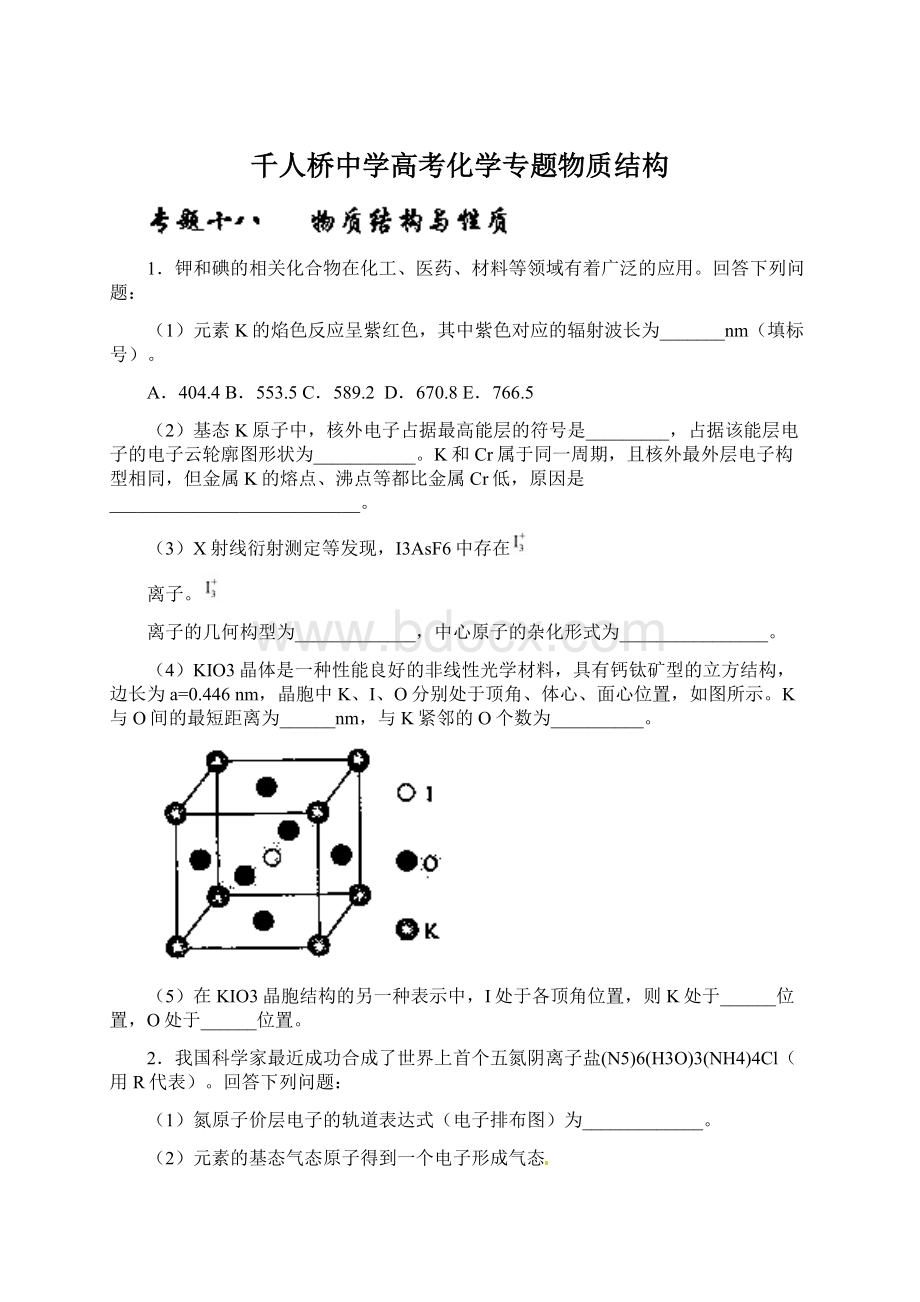
3.研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
(1)Co基态原子核外电子排布式为_____________。
元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。
MnO也属于NaCl型结构,晶胞参数为a'
=0.448nm,则r(Mn2+)为________nm。
4.铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。
某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(
)分子中碳原子轨道的杂化类型是_______________,1mol丙酮分子中含有σ键的数目为______________。
(3)C、H、O三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图−1所示,Cu可以完全替代该晶体中a位置Fe或者b位置
Fe,形成Cu替代型产物Fe(x−n)CunNy。
FexNy转化为两种Cu替代型产物的能量变化如题21图−2所示,其中更稳定的Cu替代型产物的化学式为___________。
5.铁及其氧化物是日常生活生产中应用广泛的材料。
请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是_______
_________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;
与ClO4-互为等电子体的分子或
离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。
则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);
己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a为_______nm(用含d和NA的代数式表示)。
6.物质的组成与结构决定了物质的性质与变化。
(1)C、H、N、O四种元素中电负性最大的是____(填元素符号),写出Fe2+的最外层电子排布式____。
(2)根据等电子原理,写出CN-的电子式___,CNO-中心原子的杂化方式为________。
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是___(用化学式表示),
的沸点比
____(填“高”或“低”);
原因是______________________.
(4)铁有δ、γ、α三种同素异形体,如下图所示。
γ-Fe晶体的一个晶胞中所含有的铁原子数为____,δ一Fe、α-Fe两种晶胞中铁原子的配位数之比为____。
已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为____pm(列表达式)。
7.
(1)Na+与Ne互为等电子体,电离能I2(Na)___I1(Ne)(填“<
”、“=”或“>
”).
(2)第四周期中,与Al原子未成对电子数相同的金属元素有___种。
气态氯化铝的分子组成为(AlCl3)2,分子中所含的化学键类型有_______,Al原子的杂化方式为____。
(3)可燃冰是天然气水合物,具有笼形结构如图A(表面的小球是水分子,内部的大球是甲烷分子)。
水分子成笼的作用力是_________,图A中最小的环中连接的原子总数是_________。
可燃冰晶体具有多种笼状结构,其中一种由1个图A所示笼分别用2个面与另外两个相同的笼共面而成,则中间笼实际占有_______
_____个水分子。
(4)金属镁晶体中原子的堆积方式为六方最密堆积如图B所示,晶胞可用图C表示。
设金属镁的原子半径为acm,晶胞的高为bcm,则该晶体的空间利用率为__________(写出计算式);
设晶胞中A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为__________________。
8.C、P、Cl、Fe等元素及其化合物有重要的应用,回答下列问题:
(1)C原子的价电子轨道表达式为__________________。
(2)CC14分子的空间构型是______________,其中心原子采取______________杂化,与CC14互为等电子体的一种离子是__________________(填写离子符号)。
(3)PC13属于________________分子(填“极性”或“非极性”)。
(4)FeO、NiO的晶体结构均与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为7.8×
l0-2nm、6.9×
l0-2nm,则熔点FeO_________NiO(填“>
”、“<
”或“=”),原因是___________________。
(5)已知FeCl3的沸点:
319℃,熔点:
306℃,则FeCl3的晶体类型为______________。
(6)
已知Fe单质有如图所示的两种常见堆积方式:
其中属于体心立方密堆积的是___________(填“a”或“b”);
若单质Fe按a方式紧密堆积,原子半径为rpm,NA表示阿伏加德罗常数的值,则单质Fe的密度为________g·
cm-3(列出算式即可)。
9.Cu、Ni、V为制造合金及合成催化剂的重要元素。
请回答:
(1)Cu元素位于元素周期表的_________区,其基态原子有_________种能量不同的电子。
(2)SO4是一种重要的配合物。
与SO42-互为等电子体的分子的化学式为__________(任写一种);
NH3分子的VSEPR模型为_______________。
(3)Ni(CO)4的熔点为-25℃,沸点为43℃。
其晶体类型为___________。
晶体中σ键和π键的数目之比为_________。
(4)Ni可作为
或
与H2加成的催化剂。
在相同压强下,
低,原因为_________________。
(5)
有增强胰岛素和降糖作用,其中所含非金属元素的电负性由小到大的顺序为______(用元素符号表示);
氧原子的杂化轨道类型为______________。
(6)已知:
钇钡铜氧晶体的晶胞是一个长方体(如图所示),其晶胞参数分別为anm、bnm,阿伏加德罗常数的值为NA。
则该晶体的密度为________g/cm3(列出计算式即可)。
10.工业上常用CO与H2在由Zn、Cu等元素形成的催化剂作用下合成甲醇,甲醇在Cu的催化作用下可氧化生成甲醛。
(1)下图是某同学画出CO分子中氧原子的核外电子排布图,
请判断该排布图________(填“正确”或“错误”),理由是_________________(若判断正确,该空不用回答)。
(2)写出两种与CO互为等电子体的离子_________。
在甲醇分子中碳原子轨道的杂化类型为_________。
(3)由黄铜矿冶炼的铜单质也可以参杂锌原子成为黄铜,写出黄铜合金中两种金属原子的外围电子排布式_______;
_______。
(4)甲醛与足量新制Cu(OH)2悬浊液加热可得砖红色沉淀Cu2O,写出该反应的化学方程式____________。
已知Cu2O晶胞的结构如图所示:
①在该晶胞中,Cu+的配位数是_____________________。
②若该晶胞的边长为apm,则Cu2O的密度为_______g·
cm-3(只要求列算式,设阿伏伽德罗常数为NA)
11.下列叙述正确的有
A.第四周期元素中,锰原子价电子层中未成对电子数最多
B.第二周期主族元素的原子半径随核电荷数增大依次减小
C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小
12.M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。
元素Y的负一价离子的最外层电子数与次外层的相同。
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。
元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为_______,已知晶胞参数a=0.542nm,此晶体的密度为_______g·
cm–3。
(写出计算式,不要求计算结果。
阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。
此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
13.物质结构与性质]
Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+Zn(CN)4]2-+4H++4H2O===Zn(H2O)4]2++4HOCH2CN
(1)Zn2+基态核外电子排布式为____________________。
(2)1molHCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。
不考虑空间构型,Zn(CN)4]2-的结构可用示意图表示为_____________。
14.NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×
10-10)有剧毒;
HCN、HOCN中N元素的化合价相同。
完成下列填空:
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;
H、C、N、O、Na的原子半径从小到大的顺序为_______。
(6)HCN是直线型分子,HCN是___________分子(选填“极性”或“非极性”)。
HClO的电子式为___________。
15.M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。
M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。
(1)R基态原子的电子排布式是①,X和Y中电负性较大的是②(填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
16.锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
(1)基态Ge原子的核外电子排布式为Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。
从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
GeCl4
GeBr4
GeI4
熔点/℃
−49.5
26
146
沸点/℃
83.1
186
约400
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。
Zn、Ge、O电负性由大至小的顺序是______________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________________,微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);
B为(
,0,
);
C为(
,
,0)。
则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为__________g·
cm-3(列出计算式即可)。
17.东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成Ni(NH3)6]SO4蓝色溶液。
①Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;
氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:
元素铜与镍的第二电离能分别为:
ICu=1959kJ/mol,INi=1753kJ/mol,ICu>
INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
18.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。
(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·
cm-3,其晶胞结构如图所示。
该晶体的类型为________________,Ga与As以________键键合。
Ga和As的摩尔质量分别为MGag·
mol-1和MAsg·
mol-1,原子半径分别为rGapm和rAspm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
1.【参考答案】
(1)A
(2)N球形K的原子半径较大且价电子数较少,金属键较弱
(3)V形sp3(4)0.31512(5)体心棱心
2.【答案】
(1)
(2)同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大N原子的2p轨道为半充满状态,具有额外稳定性,故不易结合一个电子
(3)①ABDC②5
③(H3O+)O-H…N(
)(
)N-H…N(
)
(4)
3.【答案】
(1)1s22s22p63s23p63d74s2或3d74s2OMn
(2)spsp3
(3)H2O>
CH3OH>
CO2>
H2H2O与CH3OH均为极性分子,H2O中氢键比甲醇多;
CO2与H2均为非极性分子,CO2分子量较大、范德华力较大(4)离子键和π键(或
键)(5)0.1480.076
4.【答案】
(1)3d5或1s22s22p63s23p63d5
(2)sp2和sp39mol(3)H<
C<
O
(4)乙醇分子间存在氢键(5)Fe3CuN
5.【答案】
小于Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,Fe3+的3d能级为半满状态较稳定。
正四面体形sp3杂化CCl4、PO43-(其他合理答案均可)体心立方
1:
2:
4
6.【答案】O3s23p63d6
spMgO〉CaO高由于
可形成分子间氢键,而
可形成分子内氢键,故
高44:
3
7.【答案】>
4共价键、配位键sp3氢键1015
8.【答案】
正四面体sp3SO42-或PO43-极性<
FeO、NiO的晶体结构相同,所带电荷相同,但Fe2+的离子半径大于Ni2+的离子半径,则FeO的晶
格能小于NiO的晶格能,因此熔点FeO<
NiO。
分子晶体b
9.【答案】ds7CCl4、SiCl4、CBr4、SiF4等合理答案即可四面体形分子晶体1:
1
形成分子内氢键,而
形成分子间氢键H<C<N<Osp3
10.【答案】错误违背泡利原理CN-、C22-sp3铜3d104s1锌3d104s2HCHO+4Cu(OH)2+2NaOH
Na2CO3+2Cu2O+6H2O2(16×
2+64×
4)×
1030/(a3NA)
11.BC
12.【答案】
(1)金属晶体金属键12(每空1分,共3分)
(2)1s22s22p63s23p5ArHClO4正四面体(每空1分,共4分)
(3)①CuCl
(每空2分,共4分)
②Cu+可与氨形成易溶于水的配位化合物(或配离子)Cu(NH3)4]2+(2分,1分,共3分)
13.【答案】
(1)1s22s22p62s23p63d10(或Ar]3d10)
(2)3;
(3)sp3和sp;
(4)NH2-;
(5)
;
14.【答案】
(5)2p;
H<
O<
N<
Na
(6)极性;
15.【答案】
(1)①1s22s22p63s1或Ne]3s1②Cl
(2)H2S分子间不存在氢键,H2O分子间存在氢键
(3)平面三角形
(4)Na+
(5)K2Cr2O7+3H2O2+4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O
16.【答案】
(1)3d104s24p2;
2;
(2)锗的原子半径大,原子之间形成的ρ单键较长,p-p轨道肩并肩重叠的程度很小或几乎不能重叠,难以形成π键;
(3)GeCl4、GeBr4、GeI4熔沸点依次升高;
原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强;
(4)O>Ge>Zn;
sp3;
共价键;
(6)①(
②
。
17.【答案】
(1)1s22s22p63s23p63d84s2或Ar]3d84s22
(2)①正四面体
②配位键N
③高于NH3分子间可形成氢键极性sp3
(3)金属铜失去的是全充满的3d10电子,镍失去的是4s1电子
(4)①3:
1
18.【答案】
(1)1s22s22p63s23p63d104s24p3;
(2)大于,小于;
(3)三角锥形,sp3;
(4)GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高;
(5)原子晶体;