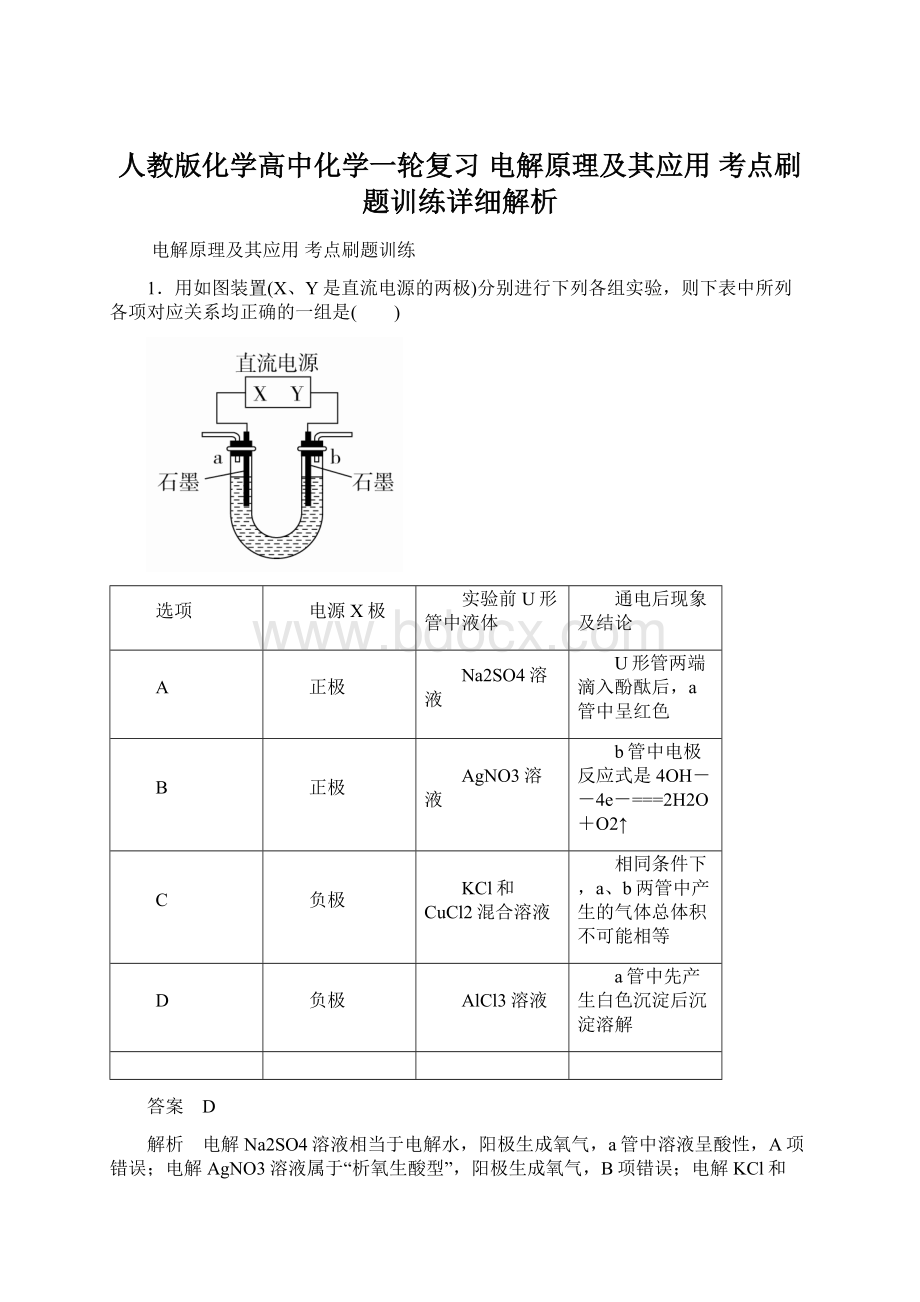
人教版化学高中化学一轮复习 电解原理及其应用 考点刷题训练详细解析Word格式.docx
《人教版化学高中化学一轮复习 电解原理及其应用 考点刷题训练详细解析Word格式.docx》由会员分享,可在线阅读,更多相关《人教版化学高中化学一轮复习 电解原理及其应用 考点刷题训练详细解析Word格式.docx(21页珍藏版)》请在冰豆网上搜索。
A项,电子由A极流出,错误;
B项,阳极OH-放电生成氧气,气体X为氧气,通常表现氧化性,错误;
C项,电极E为阳极,若活性电极为阳极,电极优先失电子,无气体X生成,错误。
3.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是( )
A.通电后中间隔室的SO
离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O-4e-===O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
答案 B
解析 负极区(阴极)电极反应为:
4H++4e-===2H2↑,正极区(阳极)电极反应为:
4OH--4e-===2H2O+O2↑。
A项,通电后SO
向正极移动,正极区OH-放电,溶液酸性增强,pH减小;
C项,负极区反应为4H++4e-===2H2↑,溶液pH增大;
D项,当电路中通过1mol电子的电量时,会有0.25molO2生成。
4.用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体。
下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式:
Cl-+2OH--2e-===ClO-+H2O
C.阴极的电极反应式:
2H2O+2e-===H2↑+2OH-
D.除去CN-的反应:
2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O
解析 若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极,A项正确;
Cl-要生成ClO-,Cl的化合价升高,故在阳极发生氧化反应,又已知该溶液为碱性条件,故B项正确;
阳离子在电解池的阴极得电子发生还原反应,碱性条件下,H2O提供阳离子H+,故C项正确;
由于溶液是碱性条件,故不应该出现H+,D项错误。
5.下列图示中关于铜电极的连接错误的是( )
答案 C
解析 镀件上镀铜时,铜应作阳极,与电源正极相连,镀件作阴极,与电源负极相连。
6.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应为2Cu+H2O
Cu2O+H2↑。
下列说法正确的是( )
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成
答案 A
解析 根据电池反应方程式及图可知,铜极发生氧化反应,连接电源正极,当有0.1mol电子转移时,有0.05molCu2O生成,石墨极发生还原反应产生H2,因此A项正确。
7.某小组为研究电化学原理,设计如图装置。
下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液由蓝色逐渐变成浅绿色
D.a和b分别连接直流电源的正、负极,电压足够大时,Cu2+向铜电极移动
解析 a和b不连接时,发生置换反应,A正确;
a和b连接时,形成原电池,铜片作正极,溶液中Cu2+放电,B正确;
铁片作负极,失去电子形成Fe2+,溶液由蓝色逐渐变成浅绿色,C正确;
a和b分别连接直流电源正、负极,a作阳极,铜片失去电子形成Cu2+,Cu2+向铁电极移动,D错误。
8.如图装置电解一段时间,当某极析出0.32gCu时,Ⅰ、Ⅱ、Ⅲ中溶液pH分别为(常温下,溶液足量,体积均为100mL且电解前后溶液的体积变化忽略不计)( )
A.13、7、1B.12、7、2
C.1、7、13D.7、13、1
解析 Ⅰ中发生反应:
2KCl+2H2O
2KOH+Cl2↑+H2↑,Ⅱ中反应的实质是电解水,pH=7,Ⅲ中发生反应:
2CuSO4+2H2O
2Cu+2H2SO4+O2↑,三个电解槽串联,则三个电解槽相同时间内转移电子的物质的量相同:
n(e-)=2n(Cu)=2×
0.32g÷
64g/mol=0.01mol,所以Ⅰ中的产物:
n(H2)=0.005mol,n(KOH)=0.01mol,c(OH-)=
=0.1mol·
L-1,则pH=13,Ⅲ中的产物:
n(H2SO4)=n(Cu)=0.005mol,c(H+)=
L-1,所以pH=1,故选A。
9.金属镍有广泛的用途。
粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:
氧化性Fe2+<
Ni2+<
Cu2+)( )
A.阳极发生还原反应,其电极反应式:
Ni2++2e-===Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
解析 根据电解原理可知,与电源正极相连的电极是阳极,失电子,发生氧化反应,故A错误;
阳极反应有:
Zn-2e-===Zn2+,Fe-2e-===Fe2+,Ni-2e-===Ni2+,Pt为惰性金属,不放电,而Cu要在金属Ni全部转化为Ni2+后才能放电,但此时Cu已没有了支撑物,最后和Pt一起落下,形成阳极泥,故D正确;
阴极因氧化性Ni2+>
Fe2+>
Zn2+,故阴极反应为Ni2++2e-===Ni,可见,阳极质量减少的是溶解的Zn、Fe、Ni,而阴极质量增加的只是析出的Ni,两者质量是不相等的,故B错误;
电解后,溶液中除留下Fe2+、Zn2+外,还有Ni2+,C也错误。
10.在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。
A.X是电源的负极
B.阴极的电极反应式是H2O+2e-===H2+O2-、CO2+2e-===CO+O2-
C.总反应可表示为H2O+CO2
H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1∶1
解析 H2O、CO2混合气体制备H2和CO时,氢元素及碳元素的化合价降低,H2O和CO2发生还原反应,则该极为阴极,连接电源的负极,A选项正确;
因电解质是金属氧化物,故该过程中可以传递O2-,则阴极反应为H2O+2e-===H2+O2-,CO2+2e-===CO+O2-,B选项正确;
图中阳极放出的是O2,2O2-+4e-===O2↑,则总反应方程式为H2O+CO2
H2+CO+O2,C选项正确;
从总反应方程式看,阴极和阳极生成的气体的物质的量之比是2∶1,D选项错误。
11.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )
A.电流方向:
电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:
Cu2++2e-===Cu
解析 分析图可知:
左侧两个烧杯的装置形成原电池,且Ⅰ为负极,Ⅱ为正极,而最右边的装置为电解池,因此,该装置中电子流向:
电极Ⅰ→A→电极Ⅳ,则电流方向:
电极Ⅳ→A→电极Ⅰ,A正确;
电极Ⅰ发生氧化反应,B错误;
电极Ⅱ的电极反应为Cu2++2e-===Cu,有铜析出,C错误;
电极Ⅲ为电解池的阳极,其电极反应为Cu-2e-===Cu2+,D错误。
12.纳米级Cu2O由于具有优良的催化性能而受到关注。
采用离子交换膜控制电解液中OH-的浓度制备纳米级Cu2O的装置如图所示,发生的反应为2Cu+H2O
A.钛电极发生氧化反应
B.阳极附近溶液的pH逐渐增大
C.离子交换膜应采用阳离子交换膜
D.阳极反应式是2Cu+2OH--2e-===Cu2O+H2O
解析 钛电极为阴极,发生还原反应,A项错误;
铜作阳极,阳极上铜发生失电子的氧化反应,阳极反应式为2Cu+2OH--2e-===Cu2O+H2O,OH-由阴极区迁移到阳极区参与反应,离子交换膜应为阴离子交换膜,C项错误,D项正确;
由阴极区迁移过来的OH-在阳极全部参与反应,阳极附近溶液的pH不变,B项错误。
13.电解硫酸钠溶液生产硫酸和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。
测得同温同压下,气体甲与气体乙的体积比约为1∶2,下列有关说法正确的是( )
(说明:
阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
A.a电极反应式为2H++2e-===H2↑
B.产物丙为硫酸
C.d为阴离子交换膜
D.Na2SO4溶液浓度增大
解析 电解硫酸钠溶液的实质是电解水,又同温同压下气体甲与气体乙的体积比约为1∶2,则甲为O2,乙为H2,故a电极上为H2O电离出的OH-放电,产生氧气,A项错误;
a电极为阳极,阳极上H2O电离出的OH-放电,SO
向阳极移动,因此产物丙为硫酸,B项正确;
b为阴极,阴极上H2O电离出的H+放电,Na+向阴极移动,则d为阳离子交换膜,C项错误;
Na2SO4溶液中Na+向阴极移动、SO
向阳极移动,因此Na2SO4溶液的浓度减小,D项错误。
14.人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图。
下列有关说法正确的是( )
A.a为电源的负极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.阳极室中发生的电极反应为2H++2e-===H2↑
D.若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2g(忽略气体的溶解)
解析 由图可知,左室电解产物为CO2和N2,发生氧化反应,故a为电源的正极,右室电解产物为H2,发生还原反应,故b为电源的负极,A项错误;
由图可知,左侧阳极室Cl-首先放电,生成氯气,氯气再氧化尿素生成氮气、二氧化碳,阳极室中发生的反应依次为2Cl--2e-===Cl2↑,CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl,阴极反应式为6H2O+6e-===6OH-+3H2↑(或6H++6e-===3H2↑),根据上述反应式可以看出阴极室产生的OH-与阳极室产生的H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,故B、C项错误;
两极收集到的气体的总物质的量为
=0.6mol,由上述分析可知N2~CO2~3H2~CO(NH2)2,n(N2)=n(CO2)=n[CO(NH2)2]=0.6mol×
=0.12mol,m[CO(NH2)2]=0.12mol×
60g/mol=7.2g,故D项正确。
15.原电池与电解池在生活中和生产中有着广泛应用。
下列有关判断中错误的是( )
A.装置①研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e-===Fe2+
B.装置②研究的是电解CuCl2溶液,它将电能转化为化学能
C.装置③研究的是电解饱和食盐水,电解过程中,B极上发生氧化反应
D.三个装置中涉及的主要反应都是氧化还原反应
解析 装置③B极为阴极,发生的是还原反应。
16.用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。
A.电池工作时,正极反应式为O2+2H2O+4e-===4OH-
B.电解时,a电极周围首先放电的是Cl-
C.电解时,电子流动路径是:
负极―→外电路―→阴极―→溶液―→阳极―→正极
D.忽略能量损耗,当电池中消耗0.02gH2时,b极周围会产生0.02gH2
解析 因电解质溶液为酸性,电池工作时正极反应式为O2+4e-+4H+===2H2O;
电解时,阳极a周围首先放电的是还原性强的Br-;
电解时,电子不能通过电解质溶液,在电解质溶液中是通过离子的定向移动而导电的;
由电子守恒可知D项叙述正确。
17.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH
,模拟装置如图所示。
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为4OH--4e-===2H2O+O2↑
C.电解一段时间后,阴极室溶液的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
解析 阳极上Fe发生氧化反应,阳极室溶液由无色变为浅绿色,A项错误;
阴极上H+发生还原反应,2H++2e-===H2↑,B项错误;
根据阴极上电极反应,阴极消耗H+,电解一段时间后,阴极室溶液pH升高,C项正确;
电解一段时间后,阴极室溶液pH升高,NH
与OH-反应生成NH3·
H2O,因此阴极室溶液中溶质除(NH4)3PO4外,还可能有NH3·
H2O,D项错误。
二.非选择题
18.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
请按要求回答下列问题:
(1)甲烷燃料电池负极反应是____________。
(2)石墨(C)极的电极反应是_____________。
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为________L;
丙装置中阴极析出铜的质量为________g。
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制取漂白液,则a为电池的________极,电解质溶液最好用________。
若用于制取Fe(OH)2,使用硫酸钠作电解质溶液,则阳极选用________作电极。
答案
(1)CH4+10OH--8e-===CO
+7H2O
(2)2Cl--2e-===Cl2↑
(3)4.48 12.8
(4)负 饱和NaCl溶液 铁
解析
(1)甲烷燃料电池负极上发生氧化反应,即甲烷在负极上被氧化。
在KOH溶液中甲烷被氧化的产物为碳酸钾,负极反应为CH4+10OH--8e-===CO
+7H2O。
(2)原电池的负极与电解池的阴极相接,铁极为阴极,则C极为阳极,在C极上发生氧化反应,电极反应为2Cl--2e-===Cl2↑。
(3)n(O2)=
=0.1mol,甲池中正极反应为O2+2H2O+4e-===4OH-,由电子守恒知,经过甲、乙、丙装置的电子的总物质的量为0.4mol。
乙池中的铁极与甲池的负极相连,铁极为阴极,发生还原反应,电极反应为2H2O+2e-===2OH-+H2↑,n(H2)=
=0.2mol,V(H2)=0.2mol×
22.4L·
mol-1=4.48L。
丙池中精铜为阴极,发生还原反应,电极反应为Cu2++2e-===Cu,n(Cu)=
=0.2mol,m(Cu)=0.2mol×
64g·
mol-1=12.8g。
(4)漂白液的有效成分是次氯酸盐,制备原理是2Cl-+2H2O
2OH-+Cl2↑+H2↑,Cl2+2OH-===Cl-+ClO-+H2O,气体与液体反应,最好采用逆向接触,即气体在下端产生,碱溶液在上端生成,使其充分反应,所以该装置的下端为阳极,上端为阴极,阴极与电源负极相连,故a极为负极。
生活中常见且廉价的氯化物是氯化钠,故电解质溶液最好用饱和NaCl溶液。
若制备Fe(OH)2,用Na2SO4溶液作电解质溶液,选用铁作阳极。
19.完成下列高考组合题。
(1)利用LiOH和钴氧化物可制备锂离子电池正极材料。
LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。
B极区电解液为________溶液(填化学式),阳极电极反应式为______________________,电解过程中Li+向________(填“A”或“B”)电极迁移。
(2)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式:
___________________________。
②分析产品室可得到H3PO2的原因_____________________。
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。
并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。
其缺点是产品中混有________杂质,该杂质产生的原因是_____________________。
(3)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:
_______________________。
答案
(1)LiOH 2Cl--2e-===Cl2↑ B
(2)①2H2O-4e-===O2↑+4H+
②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO
穿过阴膜扩散至产品室,二者反应生成H3PO2
③PO
H2PO
或H3PO2被氧化
(3)NH3 根据反应:
8NO+7H2O
3NH4NO3+2HNO3,可知电解过程中还产生HNO3
解析
(1)B极产生H2,根据反应:
2H++2e-===H2↑,说明B极为阴极,随着电解进行,溶液中c(H+)减小、c(OH-)增大,B极附近电解液为LiOH溶液,随着电解的进行,溶液中c(LiOH)增大。
A极为阳极,电解液为LiCl溶液,电极反应:
2Cl--2e-===Cl2↑;
在电解过程中Li+向阴极附近移动,即向B极迁移。
(2)②中应该从闭合回路的角度,阴、阳离子的流向分析;
③注意阳极反应生成O2,O2具有氧化性,H3PO2和H2PO
均具有还原性,二者会被O2氧化生成PO
。
(3)电解NO制备硝酸铵,阳极反应为5NO-15e-+10H2O===5NO
+20H+,阴极反应为3NO+15e-+18H+===3NH
+3H2O,从两极反应产物分析电解产物,每生成3molNH4NO3同时还生成2molHNO3,因此,要全部转化成NH4NO3需补充NH3。
20.完成下列高考组合题。
(1)PbO2可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。
阳极发生的电极反应式为__________________,阴极上观察到的现象是______________;
若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为___________,这样做的主要缺点是____________________。
(2)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。
电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S
①写出电解时阴极的电极反应式:
__________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成______________________________________。
(3)离子液体是一种室温熔融盐,为非水体系。
由有机阳离子、Al2Cl
和AlCl
组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为____________。
若改用AlCl3水溶液作电解液,则阴极产物为________。
答案
(1)Pb2++2H2O-2e-===PbO2↓+4H+
石墨上有红色金属析出
Pb2++2e-===Pb
不能有效利用Pb2+
(2)①2H2O+2e-===H2↑+2OH-
②S
+2H+===(n-1)S↓+H2S↑
(3)负 4Al2Cl
+3e-===Al+7AlCl
H2
解析
(1)电极反应式的书写首先标化合价看价态变化,Pb2+化合价升高生成PbO2,所以在阳极发生Pb2+-2e-―→PbO2,Cu(NO3)2溶液水解显酸性,所以用H+配平电荷得Pb2+-2e-―→PbO2+4H+,补水配氢得Pb2+-2e-+2H2O===PbO2↓+4H+。
“阴得”——阳离子在阴极发生得电子的反应,依据金属活动性顺序可知Cu2+先得电子Cu2++2e-===Cu,然后Pb2++2e-===Pb,所以不加Cu(NO3)2,Pb2+会有部分在阴极放电。
(2)①阴极只有H+得电子生成H2。
②反应物为S
、H+,产物有S,所以S
中S的化合价既升高也降低,有H2S生成,配平即可。
(3)电镀时,镀件应作阴极,与电源负极相连,在阴极上发生得电子的还原反应生成铝。
由电解液的组成可知阴极电极反应式为4Al2Cl
;
若用AlCl3水溶液作电解液,在阴极上H+得电子生成H2。
21.某课外小组分别用图中所示装置对原电池和电解原理进行实验探究。
请回答:
Ⅰ.用甲图装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是________(填序号)。
A.铝B.石墨
C.银D.铂
(2)N极发生反应的电极反应式为____________________。
(3)实验过程中,SO
________(填“从左向右”“从右向左”或“不”)移动;
滤纸上能观察到的现象有_____________________。
Ⅱ.用乙图装置进行第二组实验。
实验过程中,观察到与第一组实验不同的现象:
两极均有气体产生,Y极区溶液逐渐变成紫红色;
停止实验,铁电极明显变细,电解液仍然澄清。
查阅资料得知,高铁酸根离子(FeO
)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-===FeO
+4H2O和_____________________________