学年高一化学上学期期中试题 4Word格式文档下载.docx
《学年高一化学上学期期中试题 4Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《学年高一化学上学期期中试题 4Word格式文档下载.docx(11页珍藏版)》请在冰豆网上搜索。
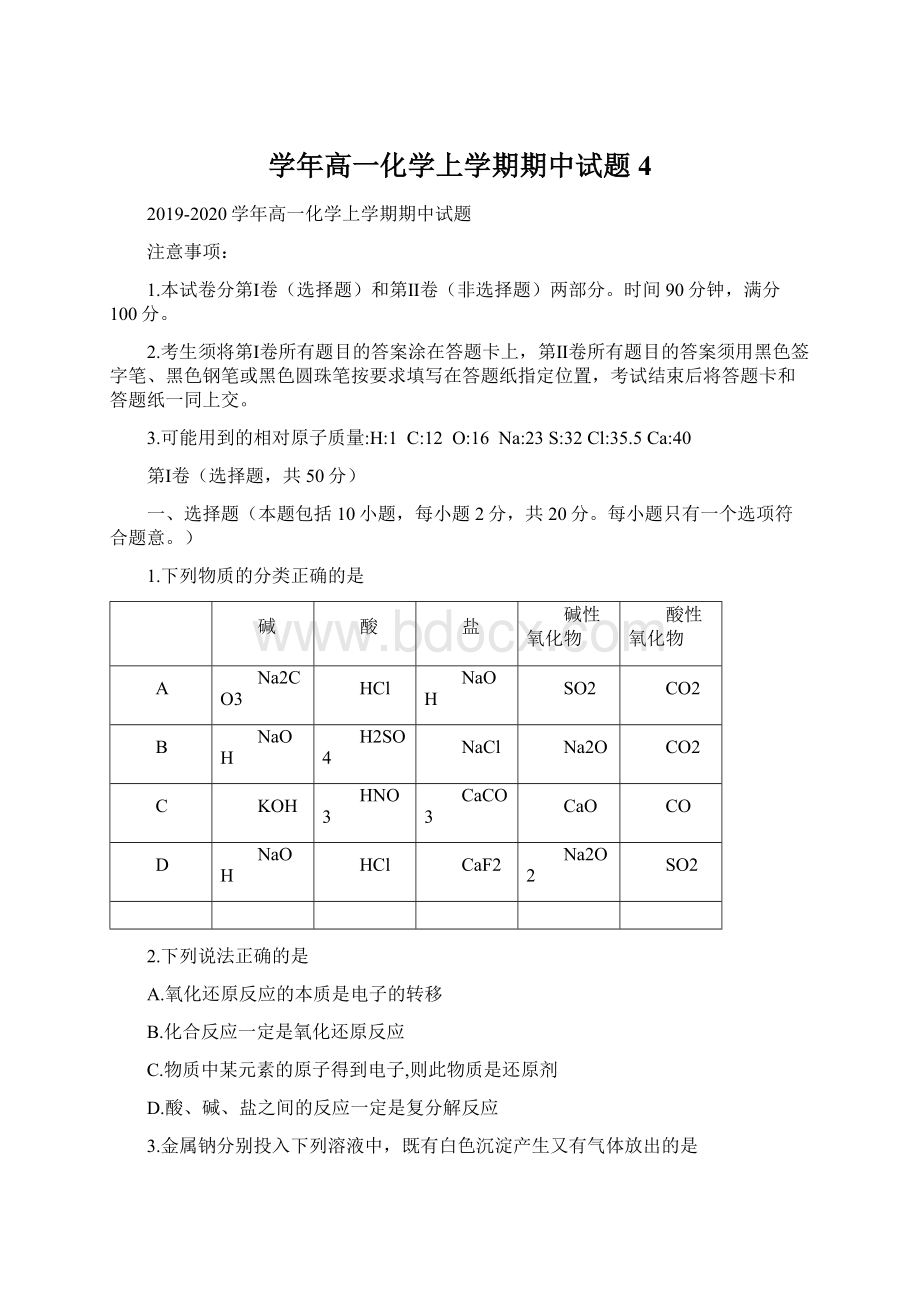
H2SO4
NaCl
Na2O
C
KOH
HNO3
CaCO3
CaO
CO
D
CaF2
Na2O2
2.下列说法正确的是
A.氧化还原反应的本质是电子的转移
B.化合反应一定是氧化还原反应
C.物质中某元素的原子得到电子,则此物质是还原剂
D.酸、碱、盐之间的反应一定是复分解反应
3.金属钠分别投入下列溶液中,既有白色沉淀产生又有气体放出的是
A.MgCl2溶液 B.K2SO4溶液C.FeCl3溶液D.NH4NO3溶液
4.相同温度和压强下,3体积的X2气体与6体积的Y2气体化合生成6体积的气态化合物A,则生成物A的化学式为
A.XY B.X3Y2C.X2Y3D.XY2
5.下列各组溶液中,c(Cl-)最大的是
A.250mL1mol·
L-1FeCl3
B.800mL0.5mol·
L-1MgCl2
C.500mL1mol·
L-1KCl
D.200mL1mol·
L-1CaCl2
6.下列化学方程式能用离子方程式2H++CO32-===H2O+CO2↑表示的是
A.HCl+NaHCO3===NaCl+H2O+CO2↑
B.2HCl+BaCO3===BaCl2+H2O+CO2↑
C.H2SO4+Na2CO3===Na2SO4+H2O+CO2↑
D.2CH3COOH+Na2CO3===2CH3COONa+H2O+CO2↑
7.下列说法正确的是
A.焰色试验时火焰呈黄色,说明该物质中含有钠元素
B.某物质的焰色不显紫色,说明该物质中肯定没有钾元素
C.焰色试验不能用于物质的鉴别
D.做焰色试验的金属丝可以用铜丝、光洁无锈的铁丝
8.下列反应的离子方程式书写正确的是
A.稀硫酸滴在CuO中:
CuO+2H+===Cu2++H2O
B.稀硫酸与Ba(OH)2溶液混合:
SO42-+Ba2+===BaSO4↓
C.稀硝酸滴在大理石上:
CaCO3+2H+===Ca2++H2CO3
D.实验室制取Fe(OH)3胶体:
Fe3++3H2O===3H++Fe(OH)3(胶体)
9.已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示,则下列关于C的性质的叙述错误的是
A.其水溶液显碱性
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.向C中加少量水,C溶解并伴有吸热现象
10.如图所示,①和②为两个体积相同的固定容器,图中“”和“
”分别表示氢原子和氧原子,则下列说法正确的是
A.若①中的H2为1mol,则②中所含分子总数为3.01×
1023个
B.①和②中气体的质量之比为1∶4
C.H2、O2均能发生化合反应,但不能发生置换反应
D.两容器的温度和压强均相同
二、选择题(本题包括10小题,每小题3分,共30分。
11.关于一些重要的化学概念有下列说法:
①Fe(OH)3胶体和CuSO4溶液都是混合物
②BaSO4是一种难溶于水的电解质
③硫酸、纯碱、小苏打分别属于酸、碱、盐
④置换反应都属于离子反应
⑤金属氧化物一定是碱性氧化物
⑥非金属氧化物一定是酸性氧化物
⑦由同种元素组成的物质不一定属于纯净物
其中正确的是
A.①②⑤⑥B.①②⑦C.②③④⑥D.③④⑤⑦
12.有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。
下列离子方程式中,
只能表示一个化学反应的是
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
③Cl2+H2O===H++Cl-+HClO
④CO32-+2H+===CO2↑+H2O
⑤Ag++Cl-===AgCl↓
A.只有③ B.②③C.③⑤D.①④
13.在反应KClO3+6HCl
KCl+3Cl2↑+3H2O中,还原产物与氧化产物的质量比是
A.1:
6B.1:
5C.6:
1D.5:
1
14.下列物质提纯的方案错误的是
选项
被提纯的物质
杂质
除杂试剂
除杂方法
NaOH溶液,浓H2SO4
洗气
NaOH溶液
过滤
Cl2
饱和食盐水,浓H2SO4
Na2CO3固体
NaHCO3固体
——
加热
15.下列有关钠的叙述正确的是
①钠在空气中燃烧生成氧化钠
②金属钠有强还原性
③钠与硫酸铜溶液反应,不能置换出Cu
④金属钠可以保存在煤油中
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价为+1价
A.①②④ B.②③④⑤ C.①④⑤ D.①②④⑤
16.设NA为阿伏加德罗常数的值,如果ag某气态双原子分子的分子数为p,则bg该气体在标准
状况下的体积V(L)为
A.
B.
C.
D.
17.已知两瓶气体分别是HCl和Cl2,可以区别它们的方法或试剂是
①观察颜色 ②打开瓶盖看有无白雾
③硝酸银溶液 ④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸
A.①②③④B.①②③⑤C.①②④⑤D.②③④⑤
18.下列选项中的离子因发生氧化还原反应而不能大量共存的有色溶液是
A.Cu2+、OH-、Ba2+、NO
B.Fe3+、K+、SO42-、OH-
C.MnO4-、Cl-、H+、Na+D.Cl-、Na+、ClO-、K+
19.我国的四大发明之一黑火药,爆炸时的主要反应是S+2KNO3+3C===K2S+3CO2↑+N2↑,下列说
法不正确的是
A.每生成0.5molN2,反应中转移6mol电子
B.硝酸钾、硫黄在黑火药爆炸反应中是氧化剂
C.KNO3有强氧化性,乘坐汽车、火车、飞机时不能随身携带
D.上述反应的生成物都是无毒的,所以燃放爆竹时不会污染环境
20.如图所示,在A处通入未经干燥的氯气。
当关闭B阀时,C处的红布条看不到明显现象;
当打开B阀后,C处的红布条逐渐褪色。
则D瓶中盛放的溶液可能是:
①NaOH溶液②H2O③浓硫酸④饱和NaCl溶液
A.①③B.①④C.②③D.②④
第Ⅱ卷(非选择题,共50分)
三、非选择题(本题包括4个小题,共50分)
21.(本小题共14分)
(1)研究物质时会涉及物质的组成、分类、性质和用途等方面。
①Na2O2属于____________(填物质的类别),检验其组成中所含阳离子的方法是______________。
②将包有少量____色Na2O2固体的棉花放在石棉网上,用滴管向棉花上滴几滴水,观察到的现象是__________________,由此得出的结论是___________________________________________。
③在潜水艇和消防员的呼吸面具中,Na2O2所发生反应的化学方程式为______________________
___________________________,从氧化剂和还原剂的角度分析,在该反应中Na2O2的作用是___________________。
某潜水艇上有25人,如果每人每分钟消耗的O2在标准状况下体积为0.80L(标准状况下O2的密度为1.429g/L),假设所需要的O2全部由Na2O2来提供,则该潜水艇一天所需要的Na2O2的物质的量是_____________。
(2)写出下列反应的离子方程式:
①NaHCO3溶于醋酸:
__________________________________________________。
②过量CO2与NaOH溶液:
_____________________________________________。
③工业制漂白液:
______________________________________________________。
④生活中漂白粉的漂白原理:
____________________________________________。
22.(本小题共13分)
(1)实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气,该反应的化学方程式为:
2KMnO4+16HCl(浓)
2MnCl2+2KCl+5Cl2↑+8H2O
用双线桥法表示该反应过程中的电子转移情况,该反应中氧化剂为______________,HCl的作用是______________________。
(2)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的离子方程式是
。
(3)已知在碱性溶液中可发生如下反应2R(OH)3+3ClO-+4OH-=2RO4n-+3Cl-+5H2O,则RO4n-中
R的化合价是________。
A.+3 B.+4C.+5D.+6
(4)填写下列空白:
①等物质的量的CO和CO2中:
所含的分子数目之比为_______,相同条件下体积之比为_______,所含的原子总数目之比为_______。
②有下列物质:
a.硫酸 b.盐酸 c.氯气 d.硫酸钡 e.甲烷 f.铜 g.CH3COOH h.氯化氢
i.蔗糖 j.氨气 k.CO2 l.NaHCO3 m.Al(OH)3 n.NaOH溶液
其中属于非电解质的为_____________(填序号,下同。
),属于电解质的为______________。
23.(本小题共11分)
某实验小组进行氯气性质的实验探究,设计了如图实验装置来制备并验证氯气的性质(部分夹持装置未画出)。
请回答相关问题:
(1)A中放置固体二氧化锰的装置名称是_________。
(2)制备实验开始时,先检查装置气密性,如何检查整套装置的气密性?
______________________________________________。
(3)检查完装置的气密性后,接下来的操作依次是________(填序号)。
A.往烧瓶中加入MnO2粉末B.加热C.往烧瓶中加入浓盐酸
(4)写出A中反应的化学方程式。
(5)装置B的作用是______________________________________________。
(6)硬质玻璃管C中事先装有两个蘸有相关试剂的棉球,左侧棉球的实验现象为
________________;
产生该现象的原因可能是________________________________
________________________________________________________________________。
24.(本小题共12分)
某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制1.60mol/L稀盐酸和1.60mol/LNaOH溶液;
②向一粒研碎后的药片(1.60g)中加入20.00mL蒸馏水;
③用1.60mol/LNaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL1.60mol/L稀盐酸。
请回答下列问题:
(1)正确的操作顺序是__________________________(填序号)
(2)测定过程中发生反应的离子方程式为___________________________________、
___________________________。
(3)该测定实验共进行了4次。
4次测定所消耗的NaOH溶液的体积如下:
测定次数
第1次
第2次
第3次
第4次
V【NaOH(aq)】/mL
13.00
12.90
13.10
实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制NaOH溶液应选用的容量瓶的规格为___________。
(4)①配制上述NaOH溶液时需要的主要仪器有托盘天平、烧杯、_______________________。
②该实验的第一步是计算,称取_____gNaOH固体。
③用烧杯称取NaOH固体时,下列操作步骤的正确顺序是__________________(相同的操作可重复使用)。
a.调整天平零点b.将砝码放回砝码盒c.将游码拨回零刻度处
d.称取小烧杯的质量e.称取小烧杯和NaOH的质量f.记录称量的数据
④称取NaOH固体时,若将砝码放在天平左盘,将NaOH固体放在右盘,游码在1.4的刻度
线处。
则实际称得的NaOH固体为____________g。
⑤写出下列操作对所配制的溶液浓度造成的影响(填“偏大”“偏小”或“不变”)。
a.称量时砝码与NaOH固体在托盘中位置颠倒:
______________。
b.未洗涤烧杯及玻璃棒:
c.定容摇匀后,发现液面低于刻度线,重新加水至刻度线:
⑥取50mL上述配制准确的NaOH溶液,加水稀释至100mL,所得NaOH溶液的物质的量
浓度为________________。
化学参考答案2019.11
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21.(共14分。
除特别注明外,每空一分,)
(1)①金属氧化物;
焰色试验,火焰呈黄色
②淡黄;
棉花立刻燃烧起来;
过氧化钠与水反应放热,且有氧气产生
③2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑(2分);
既做氧化剂又做还原剂;
2.57×
103mol(2分)
(2)①HCO3-+CH3COOH=CH3COO-+CO2↑+H2O
②CO2+OH-=HCO3-
③Cl2+2OH-=Cl-+ClO-+H2O
④CO2+H2O+2ClO-+Ca2+=CaCO3↓+2HClO
22.(共13分)
(1)双线桥略(2分)KMnO4(1分)酸和还原剂(1分)
(2)2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O(2分)
(3)D(2分)
(4)①1:
1(1分)、1:
1(1分)、2:
3(1分)②eijk(1分);
adghlm(1分)
23.(共11分)
(1)圆底烧瓶(1分)
(2)如图连接好装置,关闭分液漏斗的活塞,将导管末端插入水面下,微热烧瓶,导管末端有气泡冒出,冷却后,导管末端形成一段稳定的水柱。
(2分)
(3)A、C、B(2分)
(4)MnO2+4HCl(浓盐酸)
MnCl2+2H2O+Cl2↑(2分)
(5)吸收氯气中的HCl气体(1分)
(6)棉花红色褪去(1分);
可能是氯气与水反应生成的酸与氢氧化钠发生中和反应,将氢氧化钠消耗完所致。
也可能是氯气与水反应生成的次氯酸的强氧化性,使红色褪去(2分)。
24.(共12分。
每空一分)
(1)①②④③或②①④③
(2)CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O
(3)100mL
(4)①容量瓶(100mL)、量筒、药匙、玻璃棒、胶头滴管
②6.4③adfefbc④3.6
⑤a.偏小;
b.偏小;
c.偏小
⑥0.80mol/L