高一化学必修1一二章综合测试题附答案汇编Word文档格式.docx
《高一化学必修1一二章综合测试题附答案汇编Word文档格式.docx》由会员分享,可在线阅读,更多相关《高一化学必修1一二章综合测试题附答案汇编Word文档格式.docx(15页珍藏版)》请在冰豆网上搜索。
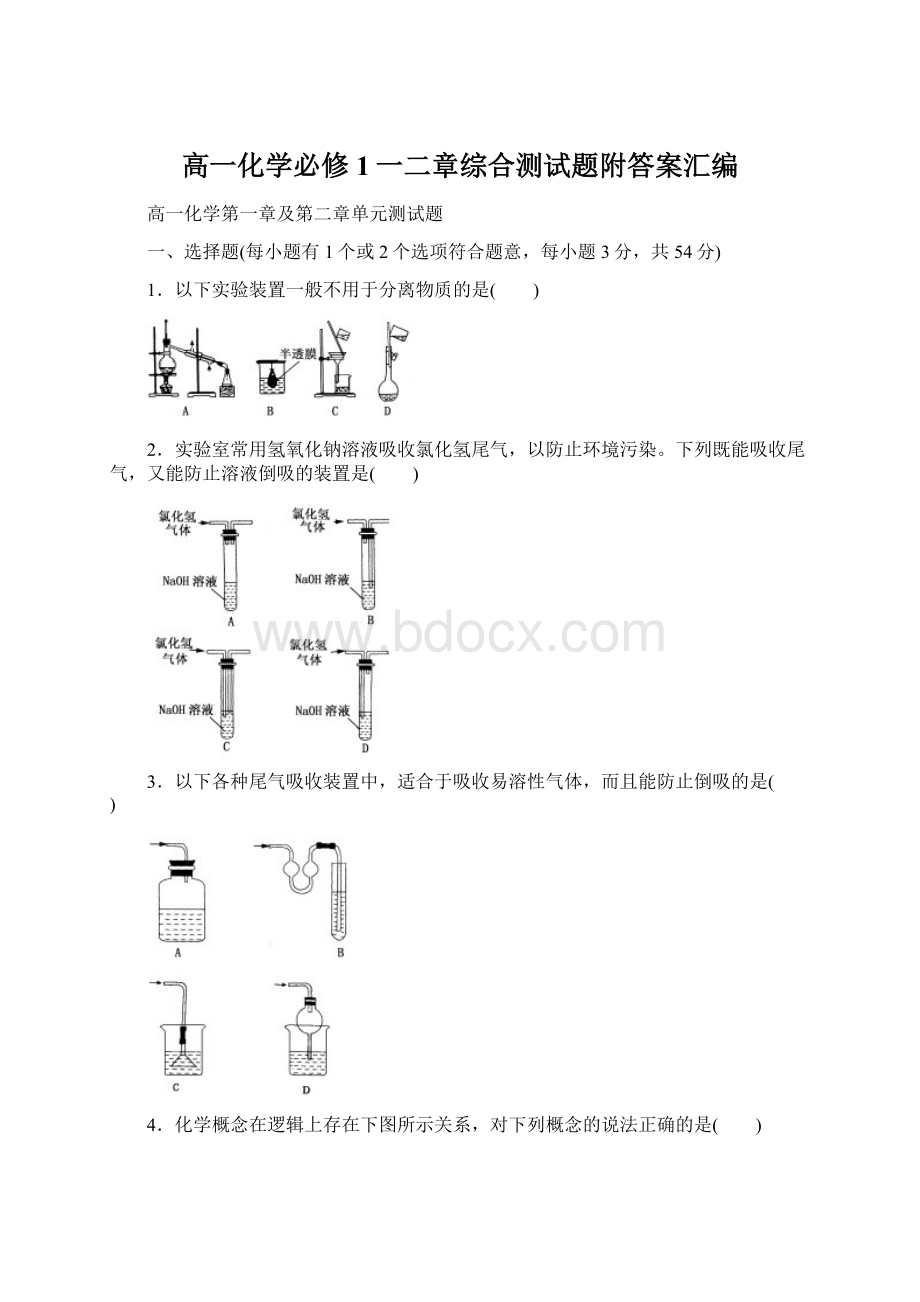
cm-3的溶液,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol·
L-1,质量分数为w,下列表达式正确的是( )
A.c=(w×
1000×
d)/M
B.m=V×
d×
(w/100)
C.w=(c×
M)/(1000×
d)%
D.c=(1000×
m)/(V×
M)
8.配制250mL0.10mol·
L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中进行定容时仰视刻度线
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度
9.在一定温度下,已知有关某饱和溶液的一些数据:
①溶液的质量,②溶剂的质量,③溶液的体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度,利用下列各组数据计算该饱和溶液的物质的量浓度,不能算出的一组是( )
A.④⑤⑥B.①②③④
C.①④⑥D.①③④⑤
10.用下列方法来制备溶胶:
①0.5mol·
L-1BaCl2溶液和等体积2mol·
L-1硫酸相混合并振荡;
②把1mL饱和三氯化铁溶液滴加入20mL沸水中,边加边振荡;
③把1mL水玻璃加入10mL1mol·
L-1盐酸中,用力振荡。
可行的是( )
A.①②B.①③
C.②③D.①②③
11.一般情况下胶体稳定,胶体微粒不易聚集,主要原因是( )
A.胶体有丁达尔现象
B.胶体有布朗运动
C.胶体微粒因吸附带电荷离子而带电,带同种电荷的微粒间相互排斥
D.胶体微粒直径在1~100nm之间,微粒小,不受重力作用
12.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·
H2C2O4·
2H2O。
若用0.1000mol·
L-1的NaOH溶液中和相同质量的KHC2O4·
2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·
L-1)为( )
提示:
①H2C2O4是二元弱酸
②10[KHC2O4·
H2C2O4]+8KMnO4+17H2SO4===8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889B.0.08000
C.0.1200D.0.2400
13.下列反应的离子方程式中,错误的是( )
A.铁跟稀硫酸反应:
2Fe+6H+===2Fe3++3H2↑
B.碳酸氢钙溶液跟盐酸反应:
Ca(HCO3)2+2H+===Ca2++2H2O+2CO2↑
C.醋酸跟氢氧化钾溶液反应:
CH3COOH+OH-===CH3COO-+H2O
D.碳酸镁跟硫酸反应:
MgCO3+2H+===Mg2++H2O+CO2↑
14.下列反应中,离子方程式为H++OH-===H2O的是( )
A.CH3COOH+NaOH===CH2COONa+H2O
B.HNO3+KOH===KNO3+H2O
C.H2SO4+Ba(OH)2===BaSO4↓+2H2O
D.2HCl+Cu(OH)2===CuCl2+2H2O
15.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
A.NH
、Cu2+、Cl-、NO
B.K+、Na+、SO
、S2-
C.K+、Na+、AlO
、SO
D.Ba2+、Fe2+、NO
、Br-
16.下列反应中,既是化合反应,又是氧化还原反应的是( )
(1)铁和氯气反应:
2Fe+3Cl2
2FeCl3
(2)氯气通入溴化钠溶液:
Cl2+2NaBr===2NaCl+Br2
(3)氯化钠溶液和浓硫酸混合加热:
2NaCl+H2SO4(浓)
Na2SO4+2HCl↑
(4)二氧化锰跟浓盐酸在加热条件下反应:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(5)氢气在氯气中燃烧:
H2+Cl2
2HCl
A.
(1)
(2)B.
(1)(3)C.
(1)(4)D.
(1)(5)
17.相等物质的量的KClO3分别发生下述反应:
①有MnO2催化剂存在时,受热分解得到氧气;
②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl。
下列关于①和②的说法不正确的是( )
A.都属于氧化还原反应B.发生还原反应的元素相同
C.发生氧化反应的元素不同D.生成KCl的物质的量相同
18.下列化学方程式中,表示电子转移的方向和数目都正确的是( )
二、非选择题(本题包括8个小题,共46分)
19.(山东临朐一中2009-2010学年度高一上学期期中考试,4分)H1N1病毒是一种没有超常抵抗力的病毒。
研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将H1N1病毒杀灭。
氯气与氢氧化钙溶液充分反应,得到以次氯酸钙[Ca(ClO)2]为主要成分的漂粉精,其稳定性比漂白粉高。
将漂粉精溶于适量水中,呈白色浊状物,静置沉降。
取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为______________________________。
另取少许上层清液,先滴加适量的________(填化学式)酸化,再滴加________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________________________________。
20.(6分)某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”如图所示。
在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗,为使液体顺利流下,还需插入“空气导入管”与大气相通。
(1)“空气导入管”下口应在______________,上口应在______________。
A.滤纸边沿下方B.滤纸边沿上方C.待过滤液液面上方D.待过滤液中E.A和B项均可F.C和D项均可
(2)试简要说明自动加液过滤的原理:
________________
21.(6分)向100mL某二价金属M的氢氧化物澄清溶液中加入过量的NaHCO3溶液生成了MCO3沉淀。
过滤,将沉淀置于足量的盐酸中,在标准状况下收集到4.48L气体;
将滤液加水稀释到250mL,取出25mL恰好与20mL盐酸完全反应,标准状况下收集到1.12L气体。
(1)M的氢氧化物与NaHCO3反应的化学方程式为
________________________________________________________________________。
(2)要计算M的相对原子质量,你认为还必须提供下列哪项数据________(选填字母序号)
A.M的氢氧化物溶液的物质的量浓度(设为2mol·
L-1)
B.M的碳酸盐的质量(设为39.4g)
C.与M的碳酸盐反应的盐酸的物质的量浓度(可设为0.1mol·
D.题设数据充足:
不需要补充数据
根据你的选择,试列式计算金属M的相对原子质量。
(3)求与滤液反应的盐酸的物质的量浓度。
22.(6分)已知氢氧化铁胶体是氢氧化铁粒子吸附多余Fe3+生成的。
现将氢氧化铁固体粉碎使粒子直径在1~100nm之间,并悬浮于水中,再向悬浊液中加入____________或____________适量,即可制得Fe(OH)3胶体。
(填两类不同物质)
23.(6分)
(1)已知硫酸溶液的浓度越大密度也越大。
40%的H2SO4溶液和50%的H2SO4溶液等质量混合后,所得溶液溶质的质量分数____________(填“大于”“小于”或“等于”)45%;
如果是等体积混合,混合以后所得溶液溶质的质量分数____________(填“大于”“小于”或“等于”)4.5%。
(2)已知98%的浓H2SO4的物质的量浓度为18.4mol/L,试判断49%的H2SO4溶液的物质的量浓度__________(填“大于”“小于”或“等于”)9.2mol/L。
24.(6分)据报道,在全国各地发生了多起因洁污剂混合放出氯气而中毒的事件,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。
请根据你的化学知识作出如下推断(这一推断的正确性有待证明):
(1)当事人使用的液态洁污剂之一必定含氯元素,若可能存在的离子组合是ClO-和Cl-或者ClO
和Cl-,则当另一种具有__________(填“酸性”、“碱性”或“中性”)的液态洁污剂与之混合,可能发生反应而产生氯气。
(2)该可能发生的反应中发生氧化反应的过程是
______________________________________。
(3)写出ClO-和Cl-可能发生反应的离子方程式
25.(6分)用KMnO4氧化密度为1.19g·
cm-3。
溶质质量分数为36.5%的HCl溶液。
反应方程式如下:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
(1)15.8gKMnO4能使多少克HCl发生上述反应?
有多少克HCl被氧化?
(2)若Cl2在标准状况下的密度为3.17g·
L-1,则产生的Cl2在标准状况下的体积为多少?
26.(6分)在t℃时,ag某化合物饱和溶液的体积为bmL,将其蒸干后得到Cg摩尔质量为dg·
mol-1不含结晶水的固体物质,计算:
(1)此物质在t℃时溶解度;
(2)在t℃时,此化合物的饱和溶液中溶质的物质的量浓度。
答案
1.【答案】D【解析】 A项为蒸馏,用于互溶而沸点不同的液体混合物的分离;
B为渗析,用于胶体的净化;
C为过滤,用于固体与液体的分离;
D为配制一定物质的量浓度溶液中的移液操作,不属于分离物质的操作。
本题考查的是分离的基本操作原理。
2.【答案】B【解析】 本题中A装置虽然能防止倒吸,但会有氯化氢逸入空气而造成环境污染。
C、D装置中进气管插入了液面以下,不能起到防止倒吸的作用。
3.【答案】BD【解析】 本题主要考查尾气的吸收及防止液体倒吸装置的设计等内容。
装置A设计原理错误,气体没有“通路”易发生爆炸;
装置C漏斗已伸入液面以下,发生倒吸时不能及时使漏斗与液面脱离,不能达到目的。
装置B中的双球及装置D中干燥管的容积大,发生倒吸时引起的液面差大,可使导气管下端及时与液面脱离从而防止倒吸。
4.【答案】B【解析】 A中纯净物与混合物属于并列关系,C中单质与化合物属于并列关系,D中氧化反应与化合反应属于交叉关系。
5.【答案】C【点拨】 本题要求根据试题给定的甲、乙两物质的性质,综合分析后选出最佳方案。
升华法显然不行,又因为甲、乙物质均溶于水,所以用分液法、萃取法也不行,故只能根据沸点的差异,采取分馏法最为方便。
6.【答案】A【解析】 12mol·
L-1的溶液500mL,其溶质的物质的量为n(X)=0.5k×
12mol·
L-1=6mol。
而标准状况下,气体摩尔体积为22.4L·
mol-1,所以,气体体积V=22.4L·
mol-1×
6mol=134.4L。
【点拨】 不要忘记标准状况下,气体的摩尔体积为22.4L·
mol-1
7.【答案】D【解析】 根据质量分数、物质的量浓度的概念,可推导出它们之间的关系。
质量分数换算成物质的量浓度c=
=
,A不正确;
已知溶液的体积和密度及质量分数,求得溶质质量m=V×
w,B错误;
换算成质量分数w=
×
100%=
,C错误;
已知溶质质量、溶液的体积和溶质分子量,求物质的量浓度c=
,D正确。
【点拨】 对物质的量浓度的计算要熟记,并且能正确运用。
8.【答案】C【解析】 B项,如下图甲所示,定容后液面高于容量瓶的刻度线,溶液体积偏大,NaOH物质的量浓度偏小;
C项,如下图乙所示,情况与B项相反;
A、D两项易判断会偏小。
【点拨】 对于配制一定体积一定物质的量浓度的溶液这部分知识,同学们应不仅熟悉实验的操作步骤、仪器的使用,还应掌握对实验结果进行误差分析。
构成实验误差的因素是多方面的,中学阶段仅对由于操作不当引起的实验误差进行讨论和判断。
9.【答案】 C【点拨】 这是对基本公式的考查。
A项由c=
、w=
可得,c=
;
B项由c=
可得结论;
C项缺少溶液的质量;
D项由c=
、p=
。
10.【答案】 C【解析】 BaCl2和H2SO4反应可生成BaSO4沉淀,在溶液中还有H+、Cl-,所以是离子反应而不能形成溶胶,凡题含①均不是本题答案,选项A、B、D都应弃去。
【点拨】 本题考查有关溶胶的制备,在课本上实验部分要求会用上述方法制备氢氧化铁胶体。
11.【答案】 C【点拨】 由于胶体中同一种胶粒带有相同的电荷,胶体的粒子间相互排斥,因而在一般情况下胶体粒子不容易凝聚,而是比较稳定的分散系,故可长时间保存。
12.【答案】 B【点拨】 本题关键要根据信息找出反应物量的关系:
30NaOH~10[KHC2O4·
H2C2O4]~8KMnO4
30 10 8
0.1000mol·
L-1×
3V c(KMnO4)×
V
c(KMnO4)=0.08000mol·
L-1
13.【答案】 AB【点拨】 解本题时应采用正向思维,对每一个离子方程式进行分析。
因为每一个离子方程式都应与化学方程式及实际情况相吻合,不能随意臆造。
浓硫酸与铁作用生成三价铁,而稀硫酸与铁作用生成二价铁,故A选项不正确。
Ca(HCO3)2是可溶于水的盐,应写成离子形式,反应前后Ca2+的数目并没有变,因此离子方程式中不应出现Ca2+,故B选项也不正确。
醋酸是弱酸,在离子方程式中应写成分子式,碳酸镁是微溶于水的盐,此处表示固体,故不能用离子形式表示,应用化学式表示,所以C、D正确。
14.【答案】 B【解析】 A中CH3COOH为弱酸,D中Cu(OH)2为不溶性弱碱,因此都不能写成离子形式;
C中BaSO4为沉淀不能删去。
15.【答案】 D【点拨】 A项,在强酸性溶液中可共存;
B项、C项,在强碱性溶液中可共存;
D项,在强酸性溶液中Fe2+被NO
氧化,在强碱性溶液中Fe2+生成Fe(OH)2沉淀。
16.【答案】 D【点拨】 化合反应是两种或两种以上的物质生成一种物质的反应,因此
(1)(5)属于化合反应。
判断一个反应是否是氧化还原反应,关键是看有无化合价的变化。
题中
(1)Fe由0价到+3价,Cl由0价到-1价;
(2)NaBr中的Br由-1价到0价,Cl2中的Cl由0价到-1价;
(4)HCl中的Cl由-1价到0价,MnO2中的Mn由+4价到+2价;
(5)H2中的H由0价到+1价,Cl2中的Cl由0价到-1价,都有化合价的变化,因此
(1)
(2)(4)(5)都是氧化还原反应。
同时满足两2个条件的只有
(1)(5),故答案为D。
17.【答案】D【点拨】 有催化剂时发生的反应是2KClO3
2KCl+3O2↑,发生氧化反应的元素为氧,发生还原反应的元素为氯;
若不用催化剂时发生的反应是4KClO3
3KClO4+KCl,被氧化与被还原的元素皆为氯元素。
由两种条件下反应的化学方程式可推知等物质的量的KClO3参加反应时,生成的KCl的物质的量不同。
18.【答案】B【解析】 A项中KClO3中的氯元素由+5价降到0价,不能与盐酸中氯元素的-1价“错位”,故应转移5e-,正确的表示方法为:
C项中CO中的碳元素由+2价升到+4价,转移2e-,反应中CO的化学计量数为2,故转移2e-×
2,正确的表示方法为:
D项中HgS中汞元素由+2价降到0价,转移2e-,O2中氧元素由0价降到-2价,转移2e-×
2,且应为得电子,故反应中共转移6e-,其中硫元素失电子,正确的表示方法为:
【点拨】
(1)标出箭头的方向,由反应物指出生成物;
(2)必须指向同种变价元素。
19.【答案】 Ca2++CO
===CaCO3↓;
HNO3;
AgNO3;
Cl-+Ag+===AgCl↓
20.【答案】
(1)A F
(2)待过滤的液体由流出管流入漏斗,当漏斗里的液面封住“空气导入管”的管口时,空气停止进入烧瓶,液体停止流入漏斗;
随着过滤的进行,当漏斗里的液面降到“空气导入管”的下口以下时,空气又进入烧瓶,液体又流入漏斗。
21.【答案】
(1)M(OH)2+2NaHCO3===MCO3↓+Na2CO3+2H2O
(2)B137(3)3.5mol·
【点拨】 因为沉淀与盐酸产生的二氧化碳为4.48L(标准状况),所以有下式成立:
n(CO2)=n(MCO3)=4.48L÷
22.4L·
mol-1=0.2mol
M(MCO3)=39.4g÷
0.2mol=197g·
Mr(M)=197-60=137
(3)因为25mL滤液与盐酸反应生成的二氧化碳为1.12L(标准状况),所以有下式成立:
n(CO2)=1.12L÷
mol-1=0.05mol其中25mL滤液中n(Na2CO3)=
=0.02mol,消耗HCl0.04mol;
剩余的CO2由过量的NaHCO3生成,n(HCl)=n(NaHCO3)=0.03mol
(3)个性体现则c(HCl)=0.07mol÷
0.02L=3.5mol·
L-1。
22.【答案】 ①含Fe3+的盐溶液 ②适量强酸溶液(或加H+)
【解析】 首先了解Fe(OH)3胶体粒子的结构是:
许多分子的集合体并在表面选择吸附许多Fe3+。
题中Fe(OH)3粒子,悬浮于水中但表面没有吸附Fe3+,它是不能稳定存在的。
故应向悬浮液中加入含Fe3+的盐溶液或加酸溶液使部分Fe(OH)3和酸反应生成Fe3+。
23.【答案】
(1)等于 大于
(2)小于
小饰品店往往会给人零乱的感觉,采用开架陈列就会免掉这个麻烦。
“漂亮女生”像是个小超市,同一款商品色彩丰富地挂了几十个任你挑,拿上东西再到收银台付款。
这也符合女孩子精挑细选的天性,更保持了店堂长盛不衰的人气。
【解析】 解答此类题目的主要依据是溶液混合前后溶质的质量和物质的量不变。
(1)设两种浓度H2SO4溶液的质量均为m,混合后溶液中溶质的质量分数为w,则m×
40%+m×
50%=(m+m)×
w,解得w=45%。
三、主要竞争者分析设40%的H2SO4溶液的密度为p1,50%的H2SO4溶液的密度为p2,由题意知p1<p2,当二者等体积混合时,设其体积为V,则混合后溶质的质量分数为:
就算你买手工艺品来送给朋友也是一份意义非凡的绝佳礼品哦。
而这一份礼物于在工艺品店买的现成的礼品相比,就有价值意义,虽然它的成本比较低但它毕竟它是你花心血花时间去完成的。
就像现在最流行的针织围巾,为何会如此深得人心,更有人称它为温暖牌绝大部分多是因为这个原因哦。
而且还可以锻炼你的动手能力,不仅实用还有很大的装饰功用哦。
100%
、DIY手工艺市场现状分析=
+
=45%+
>45%。
加拿大beadworks公司就是根据年轻女性要充分展现自己个性的需求,将世界各地的珠类饰品汇集于“碧芝自制饰品店”内,由消费者自选、自组、自制,这样就能在每个消费者亲手制作、充分发挥她们的艺术想像力的基础上,创作出作品,达到展现个性的效果
(2)分别计算两种溶液的物质的量浓度。
7、你喜欢哪一类型的DIY手工艺制品?
设98%、49%的H2SO4溶液的密度分别为p1、p2,则c1=
=10p1,
c2=
=5p2,
因为p1>p2,故
10p1>5p2,
即c2<
c1=9.2mol/L。
据上述部分的分析可见,我校学生就达4000多人。
附近还有两所学校,和一些居民楼。
随着生活水平的逐渐提高,家长给孩子的零用钱也越来越多,人们对美的要求也越来越高,特别是大学生。
他们总希望自己的无论是衣服还是首饰都希望与众不同,能穿出自己的个性。
但在我们美丽的校园里缺少自己的个性和琳琅满目的饰品,所以我们的小饰品店存在的竞争力主要是南桥或是市区的。
这给我们小组的创业项目提供了一个很好的市场机会。
24.【答案】
(1)酸性
(2)Cl-Cl2(3)ClO-+Cl-+2H+===Cl2↑+H2O
【解析】
(1)此反应既是离子反应,又是氧化还原反应,反应中由电荷守恒可知必须有带正电荷的H+存在,所以酸性溶液与之混合才能够反应产生氯气。
(2)发生氧化反应的过程是Cl-被氧化生成Cl2。
(3)据氧化还原反应的规律配平
ClO-+Cl-+2H+===Cl2↑+H2O。
25.【答案】
(1)参加反应的HCl为29.2g,其中有18.25g被氧化
(2)标准状况下可产生5.6L氯气
316 584 355
15.8g m(HCl) m(Cl2)
m(HCl)=15.8g×
584/316=29.2g
m(Cl2)=15.8g×
355/316=17.75g
(1)参加反应的HCl的质量为29.2g,其中被氧化的HCl的质量为参加反应的HCl总质量的10/16,则被氧化的HCl的质量为29.2g×
10/16=18.25g
(2)产生氯气的体积为17.75g/3.17g·
L-1=5.6L
26.【答案】
(1)该物质的溶解度为
S=
100=
g
(2)该物质的物质的量浓度
c=
mol·
【解析】 根据题意可知,a为饱和溶液质量,b为溶液体积,C为饱和溶液中溶质的质量,根据溶解度公式S=
100和c=
代入后即可求得答案。