第八章卤代烃Word文档下载推荐.docx
《第八章卤代烃Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《第八章卤代烃Word文档下载推荐.docx(20页珍藏版)》请在冰豆网上搜索。
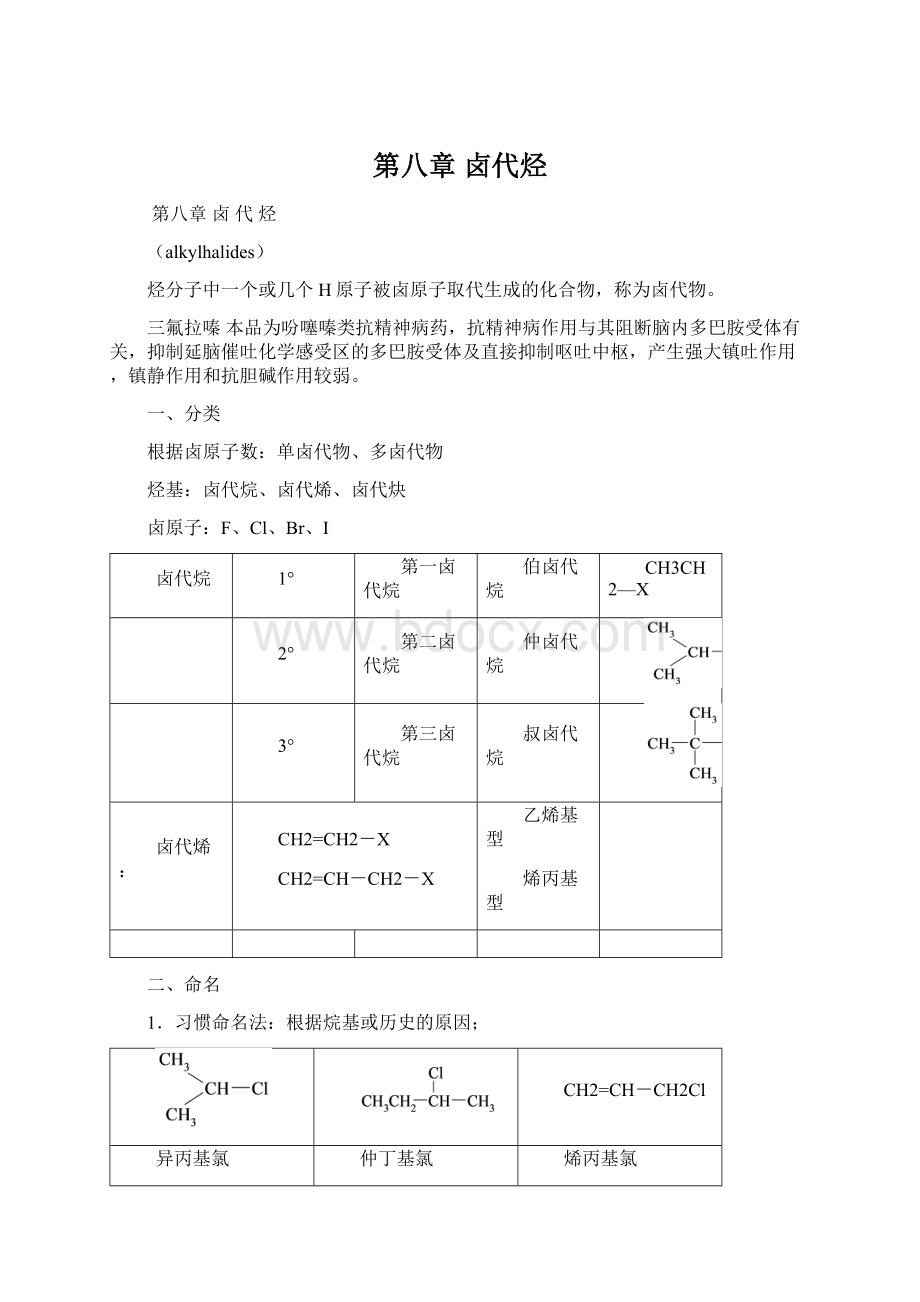
CHI3
碘仿
CF3CF2CF3
全氟丙烷
2.系统命名法
卤代烃看作为烃的卤素取代衍生物
选主链:
连有卤原子的最长碳链为主链
2-乙基-1-溴丁烷卤素作为取代基2-甲基-3-溴丁烷
顺-1-甲基-2氯环己烷
CH2=CH-CH2-Cl
3-氯丙烯
(双链编号为最小)
三氯甲烷
溴苯
氯苄或苄氯
5-甲基-1-溴环己烯
三、卤代烃的性质
物理性质(自学)
基本上和烃类化合物相似
低级为气体或液体,高级为固体
bp随着分子量↑bp↓
d一氟或一氯代烷<
1一溴或一碘代烷>
1
溶解度不溶于水
化学性质:
结构:
X作为官能团
存在偶极矩,在一定条件C-X键
可以发生断裂:
C-X—→C++X-
由于受卤素的影响,与卤素相连的C以及更运一些的C上的H也显示一定的活性。
(一)取代反应(亲核性反应)
溴乙烷在水溶液中加热,生成乙醇也称为溴乙烷的水解
在反应中,H2O分子中,O含有孤对电子,进攻带有部分正电荷的C原子,结果C-Br键断裂,形成C-O键。
底物:
反应中接受试剂的进攻CH3CH2Br
亲核试剂:
进攻电核密度较小的C原子
离去基因:
Br带了一对电子离去,成为负离子
这种类型的反应称为亲核取代反应(SN)
实际上,在卤代烷的水解中,我们通常加入NaOH,反应在碱性条件下进行,
OH-亲核能力比H2O:
大
同时NaOH中和反应中生成的HX
HBr+NaOH-→NaBr+H2O平衡右移
同样卤代烷也可以和(上述反应中)的一些试剂发生亲核取代反应
为负离子或带有孤对电子的中性分子
溶剂解概念:
既作溶剂又作亲核试剂
SN反应活性:
R—X
R—定I->
Br->
Cl-从键能考虑
X—定
>
卤代烷
CH2=CH-X
原因:
产生p-π共轭C—X键具有部分双链性质
p-π共轭,体系时量降低
∴反应条件不同,结构不同,反应速度不同
溴代烷与KF在高沸点溶剂中加热可氟代
bp129.6°
bp62.8°
蒸出
氯代烷或溴代烷与NaI在丙酮中反应,Cl、Br可以被I取代,这是制备碘代烷常用的方法,NaI溶于丙酮,NaBr、NaCl不溶。
亲核取代反应历程:
通过卤代烷的亲核取代反应可以制备多种有机化合物,因此研究取代反应的机理有着重要的意义。
A:
两种反应历程:
溴代烷水解R-Br+NaOH-→ROH+NaBr
RBr反应速度
(1°
、2°
)k[RBr][OH-]双分子亲核取代SN2
RBr
k[RBr]
单分子亲核取代
SN1
(3°
)
它们经由不同的历程,前者反应速率涉及两个分子,后者涉及一个分子。
SN2反应历程
由于SN2反应的速率由两种反应物浓度所决定,所以在决定的反应速率的步骤中肯定包含有两种粒子的碰撞,其历程可表示为:
研究表明:
OH-负离子是从溴原子背面沿着C-Br键的键轴进攻C原子的,在逐渐接近的过程中,C-O键部分形成,C-Br键逐渐伸长和弯弱。
但未完全断裂。
甲基上的三个H原子也向溴原子一方逐渐偏转。
这时需要吸收能量。
当三个H原子偏转到与C原子在同一平面时,羟基与溴处在两平面的两边,这时能量最高,形成过渡态。
即达到最高能量状态。
因此形成过渡态的速度是整个反应的决定步骤,是慢的一步。
从结构上看,在过渡态时,C原子的杂化状态从原来的sp3转变成sp2,碳上还有一个2p轨道在平面的两边,一边与亲核试剂相连,一边与离去基团的电子云重迭。
过渡态时亲核试剂与C原子的键尚未完成形成,C-Br键尚未完全断裂,负电荷分散在Br和OH两个基团上。
一旦达到过渡状态,即释放能量,与O原子形成C-O键,溴形成负离子离去,此时C原子又恢复了sp3杂化状态。
三个H原子也完全偏转到溴原子一边。
这样就完成了取代反应。
因此这里羟基并不是占据了原来溴原子的位置,而是从溴原子的背面进攻中心碳原子。
整个过程就好象伞被大风吹得向外翻转一样/
如果卤代烷的α-C是手性C,那么所得产物醇的构型与原来卤烃的构型相反,即构型发生了转化,这一过程称为Walden转化。
从图中可以看出:
整个反应是连续进行的,即旧键的断裂和新键的形成是同时发生的,过渡态位于整个反应的能量最高点。
虽然整个反应是放热反应,但由于过渡态的形成需要外界提供能量。
因此,过渡态的形成是整个反应的关键。
而过渡态时涉及到两个分子。
例如:
(-)-2-溴辛烷(+)-2-辛醇
特点:
总之SN2反应历程的特点:
1)反应一步完成,旧键断裂和新键形成同时进行
2)反应速度与卤烃和亲核试剂均有关
3)反应过程中伴随构型转化
SN1反应历程
反应只与卤烃浓度有关,而与亲核试剂浓度无关,只取决于卤烃分子中C-X键的断裂难易。
只和叔丁基溴浓度有关,而碱浓度对反应无影响
首先C-X键发生断裂生成中间体C+离子和X-离子,这个过程需要能量,是控制反应速度的一步,也是慢的一步。
C+离子一旦生成即马上与亲核试剂结合,(两面即可)速度极快,是快的一步,是反应速度快的步骤。
生成的产物从理论上讲应该是外消旋化的。
1、分两步进行2、外消旋化
有重排产物产生,则可说明反应经过C+离子中间体,反应为SN1
特点3反应速度仅和卤代烃浓度有关,产物由其稳定性决定
思考题:
影响SN反应的因素
卤代烃的SN反应按哪种历程进行呢?
其影响因素很多,情况也很复杂,在此作一简单介绍:
1.烷基(R-)结构的影响
SN1:
烯丙基>3°
>2°
>1°
>乙烯基型
SN2:
烯丙基>1°
>3°
为何出现上述活性次序呢?
电效应:
当反应按SN1历程进行时,决定反应速度的是生成C+离子的第一步,而C+离子的稳定性次序为:
>2°
>1°
>CH3+
p-π共轭
SN1
电荷无法分散
sp杂化
立体效应(空间效应):
当反应按SN2历程进行时,亲核试剂进攻α-C原子时,如果α-C周围愈拥挤,那么进攻试剂接近α-C时,阻力应愈大,反应速度就愈慢。
平面型结构,所占体积较小
可见,随着α-C上烷基数目的增加,空间阻力愈大,反应速度下降
因此:
CH2=CHCH2Br>CH3X>1°
>3°
>CH2=CHX
例:
综上所述,无论SN1、SN2反应,
CH2=CHCH2XCH2=CHX
最快最慢
2°
1°
卤代烃易按SN2历程,3°
卤烃易按SN1历程反应,2°
卤代烃两者兼而有关。
2.亲核试剂浓度的影响
由于决定反应速度是C+X离解成C+,Nu浓度、亲核能力对SN1影响不大。
Nu试剂:
反应速度慢的一步,因此,Nu浓度大,能力强,对SN2有利
3.离去基因
SN反应无论按哪种历程进行,离去基团总是带有一对电子离去,C-X键越弱,X-越易离去,对SN1和SN2都有利。
X原子离去倾向-I>-Br>-Cl>-F
因此RI>RBr>RCl>RF
I-离子来说:
易进行
I-是很好的亲核试剂,同时也是很好的离去基团。
4.溶剂极性
极性大,加速C-X离解,利于SN1,而对SN2不利。
(二)消去反应(消除反应)
当卤代烷在碱性水溶液中进行水解时,人们发现除了得到醇以外还有烯烃生成,这种分子中失去一个简单的分子而形成不饱和键的反应称为消除反应(E反应),假使反应在NaOH醇溶液中进行,主要产物不是醇而是烯。
我们常用此方法在分子中形成双键和叁键。
从以上可得出下列结论:
常用的碱:
NaOH/醇RONa/ROH
1)卤素总是与β-C上的H一起脱去,β位上的H被消除(β-消除)
2)脱HX时,总是生成稳定烯烃为主,共轭烯、双键上连有较多取代基,称为查依采夫消除规则(Saytzeff)区域选择性
那么,为什么双键两端所连取代基多、稳定呢?
超共轭效应:
当与双键相邻C上存在C-H键时C-Hσ电子云和π电了云之间也会发生部分重迭作用,形成一种共轭体系,称之为超共轭效应,或σ-π共轭或σ-p共轭。
∴我们常说烷基是推电子基。
σ-π和π-π不同点:
σ-π斜着重迭,π-π共轭,p轨道平行重迭,∴σ-π重迭程度小。
∴超共轭比π-π共轭弱较多
消除反应的历程:
大量研究工作表明,消除反应历程亦可分成单分子消除(E1)及双分子消除(E2)
E1反应:
E1历程和SN1历程相似,反应也是分二步进行,以叔丁基氯的碱性水解为例:
第一步:
卤代烷离解得C+离子
第二步:
生成的C+离子并不象SN1反应那样和试剂(OH-)结合,而是由-OH-来夺取其β-C上的H。
上述二步中,第一步是反应速度决定步骤。
此步速度只与反应物卤烃浓度有关,而与试剂浓度无关,故称为单分子消除反应。
由于E1与SN1都是经由C+离子而进行的,因此E1和SN1是同时进行的。
1、反应分两步进行;
2、速度只与卤烃浓度有关而与碱浓度无关。
E2反应:
E2历程与SN2历程相似,反应也是一步完成的,但E2和SN2不同,当试剂接近卤烃分子时(以溴丙烷)OH-不是进攻α-C(发生亲核取代反应),而是进攻β-H,并逐渐形成过渡态,随着反应的进行,H-C和C-Br键的断裂和π键的形成,它们是同步进行的。
反应一步完成,新键的形成和旧键的断裂同时进行。
过渡态时涉及两个分子,称为双分子消除。
比较E2和SN2历程,可以看出,在反应中,OH-既能起亲核试剂的作用去进攻α-C发生亲核取代反应,又能起碱的作用去夺取β-C上的H,发生消除反应,因此SN2和E2反应是相互竞争的。
影响消除反应E1、E2的因素:
由于消除反应和亲核取代反应的历程有着一定的相似性,所以一般说来,有利于SN1的因素也有利于E1,有利于SN2的因素也有利E2。
R结构:
RXE1反应3°
-C+稳定易生成
试剂浓度:
单分子反应与碱性试剂浓度无关
双分子反应随碱性试剂浓度降低而减小
因此,降低碱性试剂浓度有利于E1,增加碱性试剂浓度有利于E2。
溶剂极性,极性大,有利于C-X离解,有利于E1。
E2消除反应的立体化学
在E2反应中H-C和C-Br键断裂和π键生成是同步进行的,随着反应的进行,α和β-C原子逐渐由sp3→sp2,而与β-H和卤素相连的碳原子由sp3转变为p轨道,并在侧面重迭,形成π键。
两个p轨道对称轴相互平行时才能有效地重迭。
因此只有H-C-C-X四个原子在同一平面上,才能满足这样的要求。
∴消除反应可以按两种方式进行:
顺式消除和反式消除,实验事实说明:
大多数情况下为反式消除,即反式共平面消去。
前者比后者快500倍
反式共平面原因:
距离大,排斥力小(Brδ-、OHδ-)
(2R、3R)-二溴丁烷
mego-2,3二溴丁烷
消除和取代反应的竞争
在此,我们对卤烃的消除和亲核取代反应可以说有了一些了解,那么能否控制这两种并存而又相互竞争的反应呢?
一般来说,要完全控制比较困难,但还是有一些规律可循的。
1)R的结构
卤代烃——取代为主3°
卤代烃——消除为主
卤代烃——视反应条件而定
制烯时最好用3°
卤烃;
制醇时最好用1°
卤烃
2、试剂碱性强,浓度大,有利于消除,反之有利于取代
酸性:
HI>HBr>HCl酸性:
RSH>ROH
碱性:
I-<Br-<Cl-碱性:
RS-<RO-
亲核性:
I->Br->Cl-亲核性:
RS->RO-
RO->OH-
酸性H2O>ROH碱性HO<RO-
∴试剂碱性越强,浓度越大,就越有利于与β-H结合而发生消除。
3、溶剂的影响
一般来说,溶剂极性小,有利于消除,极性大有利于取代
4、温度的影响
虽然升高温度对E和SN反应都应该是有利的,但是由于消除反应中要涉及C-H断裂,需要较高的活化能。
因此升高温度对消除反应更有利些。
因此,碱性强、浓度大、溶剂极性小、温度高有利于消除。
(三)与金属的反应(有机金属化合物的生成)
1.与Mg的反应(Grignard)试剂,格氏试剂
卤代烃基镁(反应活性高)
乙醚作用:
二分子乙醚与格氏试剂形成络合物,稳定且能溶于乙醚中。
RX活性RI>RBr>RCl一般用溴代烃
A:
应用:
C-Mg键极化的
C上具有显著的碳负离子性质,亲核性试剂
B:
制备使用中的注意事项
2.与Li的反应
活性比格氏试剂大,但价格高,应用范围同格氏试剂。
CH3CH2CH2CH2Li遇空气即燃烧
四、还原
五、不饱和卤烃和芳香卤烃
卤烃中卤原子的活性与直接和卤原子相连的烃基结构有很大关系,当向卤烃的乙醇溶液中滴加AgNO3试液,观察卤化银沉淀生成的快慢,可判断卤原子的活性。
CH3CH2X
CH2=CH-X
+AgNO3
室温不反应
加热后生成AgX↓
加热后也不反应
室温下立即生成AgX↓
卤原子活性:
卤烯丙型>卤代烷型>卤乙烯型
不饱和卤烃、芳香卤烃分类
n=0
卤乙烯型
卤苯型
不活泼
n=1
卤烯丙型
卤苄型
活泼
n>1
结构与卤代烷类似
与卤代烷类似
怎样解释上述活性次序呢?
Cl原子外层电子排布:
↑↓
↑
3s2
3px2
3py2
3pz1
Cl原子未成对电子的p轨道3pz1与Csp2杂化轨道形成C-Clσ键,Cl上尚未两个各含有两个电子的未成键p轨道,随着C-Clσ键旋转,当转到p轨道与
π轨道相互平行时,即可从侧面发生重迭,形成p-π共轭的结果,Cl原子上的p电子向双键一边偏转。
C-Cl键有部分双键特片。
C原子和Cl原子的结合就比一般的牢固较多,因此,Cl原子就不易起反应,即不活泼。
p-π共轭体系:
上述p-π共轭可从氯乙烯分子中,C=C、C-Cl键长,得以证实。
乙烯
氯乙烷
氯乙烯
C=C
σ134pm
138pm
C-Cl
σ177pm
169pm
氯丙烯型:
那么卤丙烯型卤素为什么特别活泼呢?
烯丙基氯解离后,生成烯丙基C+离子,同样存在p-π共轭,这在前面已讲过。
∴乙烯基型卤烃活性差,氯丙烯型卤烃较活泼
同样:
对于
相对于