学年高三化学一模II卷大题汇编实验题Word格式.docx
《学年高三化学一模II卷大题汇编实验题Word格式.docx》由会员分享,可在线阅读,更多相关《学年高三化学一模II卷大题汇编实验题Word格式.docx(17页珍藏版)》请在冰豆网上搜索。
36.写出氨水中
的电离方程式。
设计实验证明:
稀释氨水时上述电离平衡会发生移动。
4、(本题共15分)
33.
(2分)
34.
(2分);
bc(2分)
35.黄绿色褪去,有白烟生成(2分);
取样溶于水,加入氢氧化钠溶液并加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝,证明有
(3分)
36.
⇌
(1分);
方案一:
取相同pH的氨水与
溶液,分别稀释相同倍数,氨水的pH大于
方案二:
取pH=a的氨水,稀释10倍后,氨水的pH大于a-1(3分,合理即可)
2017金山一模
三、(本题共l9分)
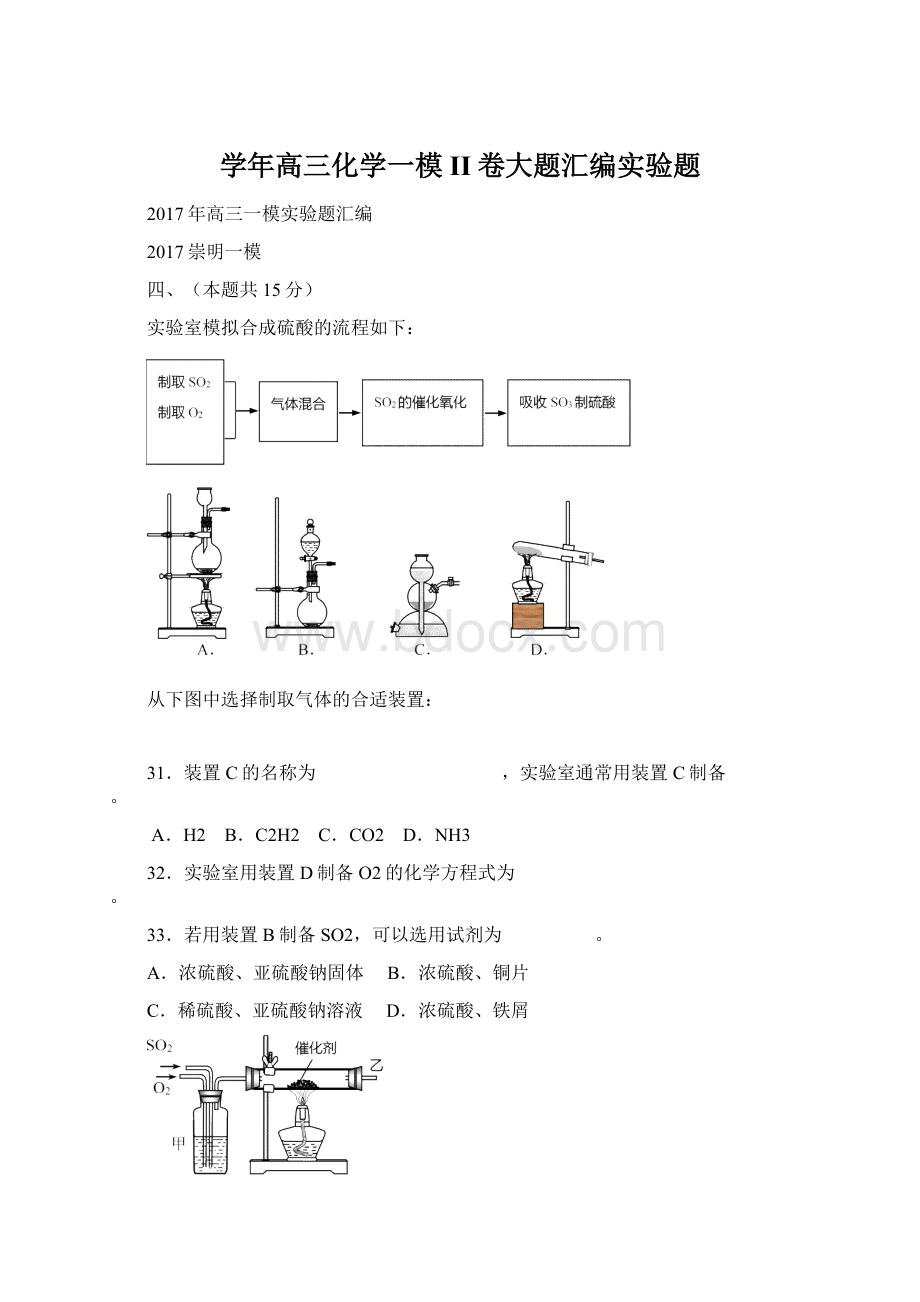
实验室常用氯化铵与氢氧化钙的固体混合加热制取氨气,实验室提供的有关装置见下表:
完成下列填空:
25.从上图中选择实验室制取氨气的发生装置________(选填编号)、收集装置________
(选填编号)。
26.用注射器收集50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡
皮塞封闭针头。
充分振荡后注射器内_______(选填“有”“无”)气体剩余,液体呈_______色,
用化学方程式解释液体颜色变化的原因_______________________________________。
27.工业合成氨的简易流程如下:
通过循环I可利用的气态物质是____
A.催化剂b.只有N2c.只有H2d.N2和H2
28.将CO2通入到氨化的饱和食盐水中制备NaHCO3固体,反应的化学方程式
_______________________________________。
29.NH3、PH3、AsH3三种氢化物热稳定性由强到弱的顺序是______________,理由是
________________________________________________________。
30.工业上用氨水吸收SO2尾气,最终得到化肥(NH4)2SO4。
(NH4)2SO4溶液呈_______性,
用离子方程式解释原因______________________________________;
该溶液中存在多种守恒,
用离子浓度表示其中一种守恒关系______________________________________。
三、(本题共19分)
25.b(1分)①(1分)
26.无(1分)红(1分)
27.d(2分)
28.NaCl+CO2+NH3+H2O→NaHCO3+NH4Cl(2分).
29.NH3>
PH3>
AsH3(2分)
理由:
N、P、As原予半径依次增大,使得N-H、P-H、As-H键长依次增长,热稳定性
逐渐减弱(2分。
合理给分。
)
30.酸(1分)、
(2分)
任意写一种:
电荷守恒:
[NH4+]+[H+]=2[SO42-]+[OH-]
物料守恒:
2[SO42-]=[NH4+]+[NH3
H2O]
质子守恒:
[H+]=[OH-]+[NH3
2017静安一模
4、综合题3(本题共14分)
某同学用含少量硫酸铁的硫酸钠固体,制取芒硝(Na2SO4.10H2O),操作流程图如下所示,请回答下列问题:
29.操作Ⅰ的名称是;
操作Ⅲ所需的玻璃仪器有。
30.试剂A为;
试剂B为,加入试剂B的目的是,实验中加入适量试剂B的实验方案为。
31.操作Ⅴ的步骤依次是(用编号填入)
a.过滤b.冷却c.蒸发浓缩d.蒸发至接近蒸干
四、综合题3(本题共14分)
29、溶解(1分);
烧杯、漏斗、玻璃棒(各1分,共3分)
30、氢氧化钠(或NaOH);
硫酸(H2SO4);
除去操作Ⅱ中过量的NaOH;
在滴加硫酸的过程中,不断用pH试纸(或pH计)测定溶液的pH至恰好为7(各2分,共8分)
31、cba
2017闵行一模
(二)(本题共11分)
27.CCl4含有(12)键的(13)分子(均选填“极性”或“非极性”)
28.灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是(14)。
29.为更好地完成实验,灼烧海带时,需加入一定量的氢氧化钠充分混合后再灼烧,此操作的目的是
(15)
30.向盛有KI溶液的试管中加入少许CCl4和氯水,(16)(填“上”或“下”)层呈紫红色。
如果氯水加过量,CCl4层会由紫红色变成无色。
整个过程中被氧化的微粒是(17)。
写出并配平CCl4层由紫色变成无色的化学反应方程式:
(18)+(19)+(20)→(21)+(22)
题号
序号
答案
分值
(二)
(12)
极性
1分
(13)
非极性
(14)
坩埚、玻璃棒、坩埚钳(两个就给分)
2分
(15)
减少碘的损失(碘易与氢氧化钠反应,可加入一定量的氢氧化钠充分混合后再灼烧,可减轻碘的损失)
(16)
下
(17)
I2、I-
(18)
I2
分
(19)
5Cl2
(20)
6H2O
(21)
2
(22)
10HCl
2017青浦一模
四、(本题15分)
CuCl广泛应用于化工和印染等行业。
某研究性学习小组拟热分解CuCl2·
2H2O制备CuCl,并进行相关探究。
已知:
该小组用下图所示装置进行实验(夹持仪器略)。
请回答下列问题:
29.仪器X的名称是______________。
30.实验操作的先后顺序是①→_______→_______→_______→⑤。
①检査装置的气密性后加入药品②熄灭酒精灯,冷却
③在“气体入口”处通干燥HCl④点燃酒精灯,加热
⑤停止通入HCl,然后通入N2
31.在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是__________。
32.装置D中发生反应的离子方程式_________________________________。
33.反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是_____________________________________________。
②若杂质是CuO,则产生的原因是________________________________________________。
34.若m克CuCl2·
2H2O全部转化为CuO(铜元素无损耗),则固体质量减少_________克(用含m的式子表示)
四、(本题共15分)
29.干燥管(2分)
30.3→4→2(2分)
31.先变红,后褪色(2分)
32.Cl2+2OH-→ClO-+Cl-+H2O(2分)
33.①加热时间不足或浓度偏低(2分)②通入HCl的量不足(2分)
34.
2017松江一模
五、(本题共15分)
工业上以浓缩海水为原料提取溴的部分流程如下:
3Br2+3CO32-→5Br-+BrO
+3CO2。
37.反应釜1中发生反应的离子方程式为(20)。
38.
中通入热空气的目的是(21);
上述流程中,步骤
③
的目的是(22)。
39.在实验室中完成操作⑤时,常用的仪器除了酒精灯、锥形瓶、温度计、接收器、接液管、石棉网及必要的夹持仪器,还需要的玻璃仪器有(23)、(24)。
40.蒸馏后废液为Na2SO4溶液,从该溶液中提取芒硝(Na2SO4.10H2O)的实验操作依次是
(25)。
41.检验Na2CO3吸收Br2后的溶液中是否含有CO32-。
请设计相关实验方案。
可供选择的试剂有:
稀硫酸、四氯化碳、澄清石灰水。
(26) 。
5、(本题共15分)
37.(20)Cl2+2Br-→Br2+2Cl-(2分);
38.(21)尽可能地吹出溶液中的溴;
(22)富集海水中的溴(4分);
39.(23)冷凝管(24)蒸馏烧瓶(4分);
40.(25)蒸发浓缩、冷却结晶、过滤洗涤(2分);
41.(26)取烧瓶B中的溶液适量,加入澄清石灰水,若变浑浊,则说明有CO32-(或取样,加入过量的稀硫酸酸化;
将酸化后产生的气体通入盛有四氯化碳的洗气瓶;
再通入澄清石灰水,若变浑浊,则说明有CO32-。
)(3分)。
2017杨浦一模
(三)(本题共15分)
对氨的实验室制法、氨气及铵盐的性质进行探究。
回答下列问题:
Ⅰ.氨气的制备
32.若用A装置制备氨气,写出反应的化学方程式_________(15)______________。
欲收集一瓶干燥的氨气,选择上图中的装置(可重复使用),其连接顺序为:
a→____(16)_______(按气流方向,用小写字母表示)。
33.用装置B,将浓氨水与氢氧化钠固体混合,也能制得氨气,请解释该法能制备氨气的原因________________________________(17)___________________________________。
Ⅱ.按右图装置进行氨气的性质实验(旋塞1和旋塞2实验前关闭),G、H是两个等体积的容器。
34.先打开旋塞1,H瓶中现象是________(18)_______,
原因是_______(19)______________。
一段时间后,关
闭旋塞1,再打开旋塞2,H瓶中现象是________(20)________。
Ⅲ.设计实验,探究某一因素对一定物质的量浓度NH4Cl水解程度的影响。
限选试剂与仪器:
NH4Cl固体、蒸馏水、烧杯、胶头滴管、玻璃棒、药匙、电子天平、pH计、温度计、恒温水浴槽(可控制温度)
35.上述所列仪器中缺少一样必要的玻璃仪器,其名称是____(21)___________。
36.根据上述所给的试剂和仪器,推测实验目的:
探究_______(22)________对NH4Cl水解程度的影响。
32.2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O(2分)
a→c→d→h→g→(d→c或c→d)→i(2分)
33.已知氨水中存在:
,氢氧化钠溶于水(或氨水)的过程是放热的,促使NH3·
H2O分解放出氨气;
氨气与氢氧化钠
34.有白烟,生成了氯化铵固体(2分)石蕊试液倒吸入H瓶中,石蕊试液变成了红色(2分)
35.容量瓶(2分)
36.浓度或者温度(2分)
2017长宁(嘉定)一模
工业上以食盐、氨气、二氧化碳等物质为原料制取纯碱。
31.实验室提纯粗盐的一个重要环节是除去粗盐水中的杂质阳离子。
某粗盐样品(主要含Ca2+、Mg2+),提纯该粗盐时,可考虑在粗盐水中加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A、B。
32.上述实验操作依次为:
取样、、沉淀、、加入盐酸调pH、、冷却结晶。
33.以上“加入盐酸调pH”目的是。
34.写成工业上以食盐、氨气、二氧化碳等物质为原料制取纯碱反应的化学方程式:
35.氨气与二氧化碳通入的先后顺序是:
,
因为:
。
该过程没有析出碳酸钠晶体,其原因是。
36.标准状况下,吸收11.2升二氧化碳气体,理论上至少需要1mol/L的氨水体积为mL。
四、(本题共15分)
31、Ca(OH)2或CaO;
Na2CO3;
32、溶解;
过滤;
蒸发;
33、中和过量的碳酸钠和氢氧化钠;
34、NaCl+NH3+H2O+CO2→NaHCO3↓+NH4Cl;
2NaHCO3
Na2CO3+H2O+CO2↑;
35、先通入氨气后通入二氧化碳;
氨气的溶解度较大,且生成的氨水呈碱性,有利于二氧化碳的吸收;
碳酸钠的溶解度比碳酸氢钠大;
36、500
2017浦东新区一模
(3)(本题共25分)
31.一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠。
实验装置如图所示。
烧瓶(甲)中所盛的固体原料是,洗气瓶(乙)中所盛试剂是;
烧瓶(丁)中稀硫酸的作用是;
实验结束后,通过
操作分离出NaHCO3晶体。
32.将(丙)中NaHCO3晶体分离后,母液中主要含有四种离子(不计H+、OH-)。
它们是
、、、。
若在母液中加入消石灰,溶液中新生成的物质可能有(填写化学式)。
33.单独将CO2一种气体通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的性。
34.将所得NaHCO3灼烧后得到碳酸钠。
不做溶解操作、不使用带导管的实验装置。
证明NaHCO3已完全分解的简便方法是;
验证产品中是否混有NaCl的基本方法是。
35.某纯碱样品中含有少量NaHCO3,欲知NaHCO3的质量分数,可将样品灼烧,并吸收称重分解所得CO2的质量。
相关装置中先后使用的两种干燥剂(或吸收剂)是(先)、(后)。
36.已知某纯碱样品中只含NaCl一种杂质,还需定量测定其纯度,比较精准的一种方法是将样品配成溶液后用标准酸溶液进行滴定。
①若以甲基橙为指示剂,在滴定过程中其颜色由变成。
②将0.100mol/L标准硫酸溶液装入滴定管;
称取纯碱样品,用烧杯和100mL瓶配成待测液。
③用管取出其中10.00mL装入瓶;
至滴定终点,用去标准硫酸溶液15.00mL。
④100mL待测液中Na2CO3的质量为g。
(三)31.碳酸钙,饱和碳酸氢钠溶液;
吸收挥发出的NH3,过滤
32.Na+、HCO3-、NH4+、Cl-。
NH3·
H2O、NaOH、CaCl2
33.(水溶液呈)碱
34.继续加热,质量不再发生变化则说明已完全分解(恒重操作);
取样,先加足量硝酸酸化,再加入AgNO3溶液,有白色沉淀则证明混有NaCl。
35.浓硫酸、碱石灰
36.①黄色、橙色②容量瓶③滴定管、锥形瓶④1.59g
2017黄浦一模
(四)实验室可用氯气和金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解,100℃左右时升华,下列图示是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(I)和(II)所示。
36.B中反应的化学方程式为:
。
37.D中的反应开始前,需排除装置中的空气,应采取的方法是。
38.D中反应的化学方程式为。
39.装置(I)的主要缺点是。
40.装置(II)的主要缺点是,如果选用此装置来完成实验,则必须采用的改进措施是。
(四)(15分)
36.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(3分)
Δ
37.在B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D(3分)
38.2Fe+3Cl22FeCl3(3分)
39.导管易被产品堵塞;
尾气中含有没有反应完的氯气,排入空气会造成污染(3分)
40.产品易受潮解在E、F瓶之间连接装有干燥剂的装置(3分)
2017奉贤一模
三、(本题共11分)
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛,HNO2因外观和食盐相似,又有咸味,容易使人误食中毒。
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸。
27、写出亚硝酸的电离方程式:
28、在酸性条件下,当NaNO2与KI按物质的量1:
1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为(填化学式).
29、请你设计一个实验方案鉴别氯化钠和亚硝酸钠:
(提示AgNO2呈白色,在溶液中以沉淀形式存在)
30、碱性工业废水中的NO2-可用铝粉除去.产生无毒无味的气体,若反应过程中转移6mol电子,则生成该气体在标准状况下的体积为L。
31、若往20mL0.01mol⋅L−1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是()
A、
若b点混合溶液显酸性:
B、c点混合溶液中:
C、d点混合溶液中:
27、
28、NO电子式略
29、提示:
滴加酸性高锰酸钾溶液,褪色的是亚硝酸钠,不褪色是氯化钠
30、22.4
31、A
四、(本题共16分)
氨气是重要的化工原料.
32、实验室可用浓氨水和(选填编号)制取氨气.
A.烧碱
B.生石灰
C.氯化铵
检验氨气易溶于水的简单操作是:
收集一试管氨气,.
33、往饱和食盐水中依次通入足量的NH3和足量的CO2,生成沉淀的化学式为
过滤后,使余液尽可能析出较多NH4Cl晶体的方法是:
再通入足量的NH3、冷却并加入.侯德榜制碱法(联合氨碱法)的CO2自(选填编号).
A.石灰石煅烧
B.含碳物质燃烧
C.合成氨厂的副产品
某NaHCO3晶体含有NaCl杂质,某同学在测定其NaHCO3的含量时,称取5.000g试样,配制成100mL溶液,用标准盐酸溶液滴定(用甲基橙做指示剂),测定数据记录如下:
滴定次数
待测液(mL)
0.5000mol/L盐酸溶液的体积(mL)
初读数
终读数
第一次
20.00
1.00
21.00
第二次
如右图Ⅰ
如右图Ⅱ
34、第二次滴定,从图2−Ⅰ图2−Ⅱ显示消耗的盐酸溶液体积为
35、该实验测定NaHCO3含量的计算式为ω(NaHCO3)=
36、该同学测定结果有一定的误差,产生该误差的原因可能是(选填编号).
A待测液中加入甲基橙作指示剂,用标准酸液滴定至变橙色
B锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
C滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
D滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定。
32、AB;
倒插入水中,水迅速充满试管;
33、NaHCO3;
NaCl;
C;
34、20.20ml;
35、10.1%;
36、CD