学年化学苏教必修2讲义专题2 化学反应与能量转化 第3单元 第1课时Word格式文档下载.docx
《学年化学苏教必修2讲义专题2 化学反应与能量转化 第3单元 第1课时Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《学年化学苏教必修2讲义专题2 化学反应与能量转化 第3单元 第1课时Word格式文档下载.docx(18页珍藏版)》请在冰豆网上搜索。
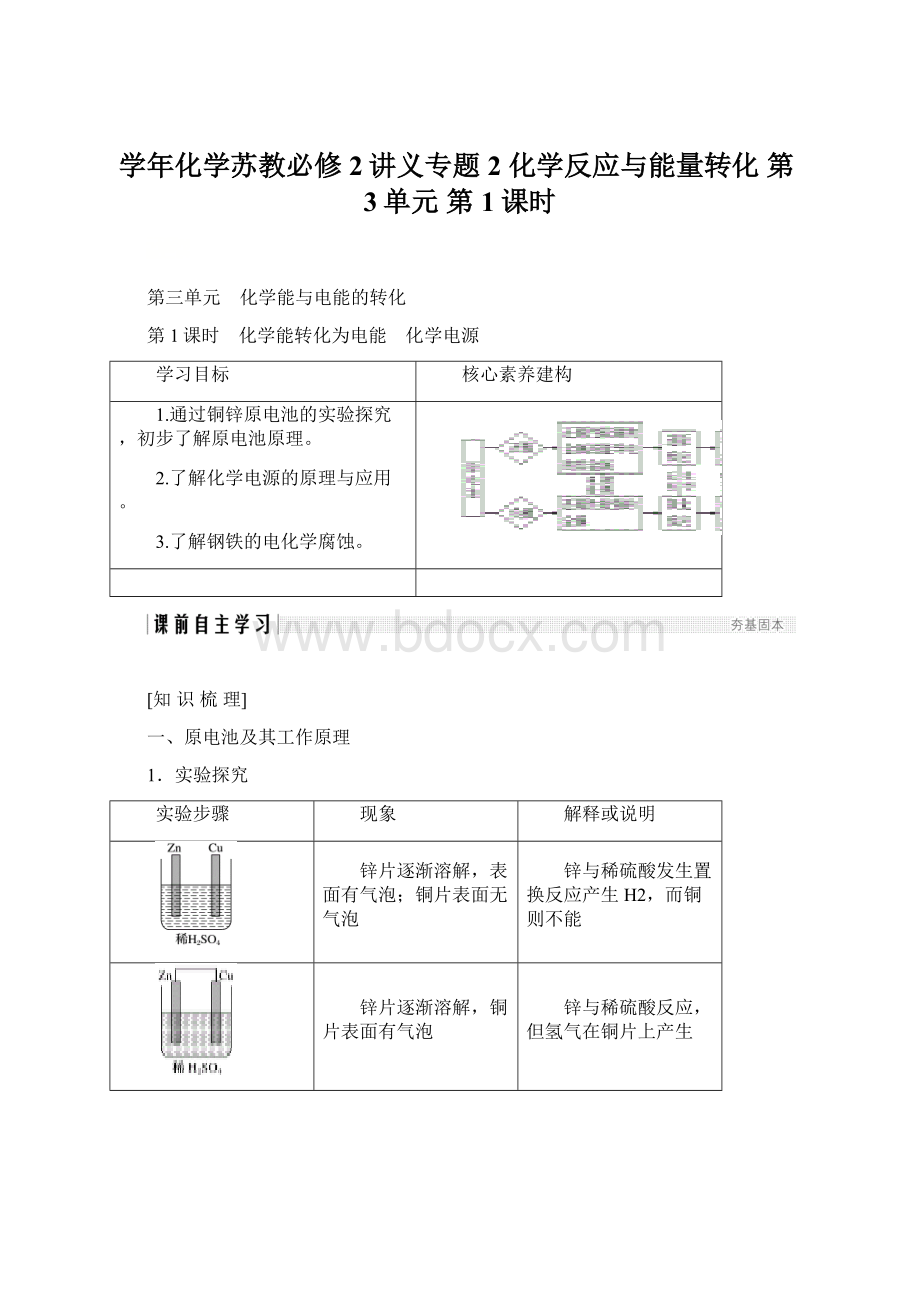
3.按要求完成下列实验,并填表
两锌片逐渐溶解且表面都有气泡,电流计指针不偏转
锌与稀硫酸反应,但导线中无电流
无现象
乙醇是非电解质,与Zn、Cu都不反应
结合以上实验,分析原电池的构成条件是什么?
答案 理论上,自发的氧化还原反应均可构成原电池。
具体条件是:
(1)具有活动性不同的两个电极(金属与金属或金属与能导电的非金属);
(2)两电极均插入电解质溶液中;
(3)两极用导线相连,形成闭合回路。
【自主思考】
1.是否所有的化学反应理论上都可以设计成原电池?
提示 不是。
原电池是利用氧化还原反应原理,将还原反应与氧化反应分别在两极发生,使电子在导线中定向移动,形成电流。
2.根据课本中的活动与探究回答:
H+得到的电子是Cu失去的吗?
在这个过程中Cu起什么作用?
你怎样知道导线中有电子通过?
提示 不是;
Cu做导体,起传导电子的作用;
电流表的指针发生了偏转。
3.若将铜锌原电池中的Cu电极换成石墨,可以吗?
为什么?
提示 可以,因为Cu在该原电池中起到的是传递电子的作用,其本身并未参与电极反应。
所以,把Cu电极换成能导电的材料就可以。
当然,该材料的活泼性不能比负极活泼。
二、钢铁的电化学腐蚀
实验内容
在一块表面无锈的铁片上滴一大滴含酚酞的食盐水,放置一段时间
实验现象
液滴周围逐渐呈现红色,并慢慢形成红色的锈斑
实验结论
钢铁在潮湿的空气中很快被腐蚀
钢铁的电化学腐蚀原理
图示
形成条件
钢铁表面形成的电解质溶液中溶有O2,通常溶液呈中性或弱碱性
负极是Fe,正极是C
负极反应式:
2Fe-4e-===2Fe2+,正极反应式:
2H2O+O2+4e-===4OH-
总反应式
2Fe+2H2O+O2===2Fe(OH)2
溶液中的反应
4Fe(OH)2+O2+2H2O===4Fe(OH)3,2Fe(OH)3===Fe2O3·
xH2O+(3-x)H2O
电化学腐蚀概念
不纯金属或合金与电解质溶液接触,发生原电池反应,比较活泼的金属失去电子被氧化,这种腐蚀叫做电化学腐蚀
4.钢铁在干燥的空气中长时间不易生锈,但在潮湿的空气里很快就会生锈,纯的铁片在潮湿的空气里也不容易生锈,这是什么原因呢?
提示 钢铁腐蚀实质上是发生了原电池反应,潮湿的空气具备了构成原电池的条件,而干燥的空气中不具备与电解质溶液接触的条件;
纯的铁片不能构成原电池的两电极,所以不容易生锈。
三、化学电源
1.分类
(1)一次电池:
不能充电,用过之后不能复原。
(2)二次电池:
可充电,可多次重复使用。
2.常见的化学电源
电池名称
电池组成
电池反应
锌锰干电池
锌筒为负极,石墨棒为正极,MnO2和NH4Cl作电解质
Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH)
银锌纽扣电池
负极是锌,正极是氧化银,电解质溶液是氢氧化钾溶液
Zn+Ag2O+H2O
Zn(OH)2+2Ag
铅蓄电池
负极是Pb,正极是PbO2,电解质溶液是硫酸溶液
Pb+PbO2+2H2SO4
2PbSO4+2H2O
镍氢电池
负极是贮氢合金,正极是泡沫氧化镍,电解质溶液是KOH溶液
NiO(OH)+MH
NiO+M+H2O(MH表示贮氢合金M中吸收结合的氢)
氢氧燃料电池
负极通氢气,正极通氧气,KOH溶液为电解质溶液
2H2+O2===2H2O
甲醇-空气燃料电池
负极通甲醇,正极通入空气,电解质溶液是KOH溶液
2CH3OH+3O2+4OH-===2CO
+6H2O
5.铅蓄电池的电池反应式为Pb+PbO2+2H2SO4===2PbSO4+2H2O。
请写出负极、正极的电极反应式。
提示 负极:
Pb-2e-+SO
===PbSO4;
正极:
PbO2+2e-+4H++SO
===PbSO4+2H2O。
6.燃料电池两电极反应有何特点?
提示 两个电极均为惰性电极,本身不参与反应。
燃料电池常用的燃料有H2、CH4、C2H4、CH3OH等可燃性物质,在反应中燃料一般表现为失去电子,在电源负极通入。
常用的氧化剂是氧气,在反应中表现为得到电子,在电源正极通入。
[效果自测]
1.判断
(1)原电池是一种电能转化为化学能的装置。
( )
(2)负极失去电子发生氧化反应。
(3)正极是电子流出极。
(4)用导线连接的铜片和锌片插入稀H2SO4中,铜片上有大量气泡产生。
(5)在铜-锌-稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌。
(6)原电池中阳离子向正极移动。
答案
(1)×
(2)√ (3)×
(4)√ (5)×
(6)√
2.下列说法正确的是( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极材料是Pb,负极材料是PbO2
解析 碱性锌锰干电池是一次电池;
燃料电池是一种高效且不会污染环境的新型电池;
铅蓄电池放电的时候正极材料是PbO2,负极材料是Pb。
答案 C
探究一、原电池工作原理
【合作交流】
1.将反应:
Zn+Cu2+===Cu+Zn2+,设计成原电池写出正、负极反应式。
提示 正极:
Cu2++2e-===Cu,负极:
Zn-2e-===Zn2+。
2.某种燃料电池的工作原理示意图如下所示,a、b均为惰性电极。
(1)使用时,空气从________(填“A”或“B”)口通入。
(2)假设使用的“燃料”是甲醇(CH3OH),a极的电极反应式为____________________。
提示
(1)B
(2)CH3OH-6e-+8OH-===CO
【点拨提升】
1.原电池正、负极的判断方法
关键提醒 判断原电池要“四看”
一看本质:
反应是自发进行的氧化还原反应。
二看电极:
具有两个活泼性不同的电极(燃料电池的电极一般是惰性电极)。
三看溶液:
电解质溶液(一般负极材料与电解质溶液反应)。
四看回路:
电极、电解质溶液构成闭合回路。
2.原电池的工作原理(以铜锌原电池为例)
【典题例证1】 右图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上记录如下,卡片上描述合理的是( )
实验记录:
①导线中电流方向:
Zn→Cu
②Cu极上有气泡产生,发生还原反应
③锌片变薄
实验结论:
④Zn为正极,Cu为负极
⑤正极反应式:
Cu-2e-===Cu2+,发生氧化反应
⑥H+向Cu极移动,SO
向Zn极移动
A.①②③B.④⑤⑥
C.③④⑤D.②③⑥
解析 锌比铜活泼性强,因此在Cu—Zn—H2SO4原电池中,锌为负极,电子由锌→铜,导线中电流由铜→锌,锌失去电子而溶解,溶液中的H+移向铜片,在Cu极得到电子而产生H2气泡。
故D项正确。
答案 D
方法拓展:
判断电极时,有时不能只看金属的活泼性强弱,还要看电解质溶液的性质,如:
①Al在强碱性溶液中比Mg更易失电子,Al作负极,Mg作正极;
②Fe、Al在浓HNO3中钝化后,比Cu等金属更难失电子,Cu等金属作负极,Fe、Al作正极。
【学以致用1】 一个原电池反应的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池的合理组成是( )
电解质溶液
A
Zn
Cu
CuCl2
B
H2SO4
C
CuSO4
D
ZnCl2
解析 由总反应式知,Zn被氧化,作原电池的负极,符合条件的有B、C、D,正极反应为Cu2++2e-===Cu,B选项中是2H++2e-===H2↑,D选项不含Cu2+,故应选C。
探究二、原电池原理的应用
3.实验室用稀H2SO4与Zn反应制H2时,用纯锌快还是粗锌快?
提示 粗锌。
4.钢铁制品在潮湿空气中易生锈的原理是什么?
提示 发生了原电池反应。
1.加快氧化还原反应的速率
自发进行的氧化还原反应,形成原电池时反应速率增大。
例如,Zn与稀H2SO4反应时,滴加少量CuSO4溶液,则Zn和置换出的Cu在稀H2SO4中构成原电池,加快Zn与稀硫酸反应的速率。
2.比较金属的活动性强弱
两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
例如,有两种金属a、b,用导线连接插入到稀H2SO4中,观察到a极溶解,b极上有气泡产生,则a为负极,b为正极,金属活动性a>b。
3.用于金属腐蚀保护
使金属制品作原电池的正极而得到保护。
例如,将铁质输水管道与锌块相连,锌作原电池的负极失电子,保护铁不被腐蚀。
4.设计电池
理论上能自发进行的氧化还原反应都可以设计成原电池。
如:
把Fe+2Fe3+===3Fe2+设计成原电池,可用Fe作负极,铜(或石墨)作正极,FeCl3溶液作电解质溶液。
【典题例证2】 有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D流向C;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。
据此,判断四种金属的活动性顺序是( )
A.A>B>C>DB.A>C>D>B
C.C>A>B>DD.B>D>C>A
解析 金属与稀H2SO4溶液组成原电池,活泼金属为负极,失去电子发生氧化反应,较不活泼的金属为正极,H+在正极表面得到电子生成H2,电子运动方向由负极→正极,电流方向则由正极→负极。
在题述原电池中,A—B原电池,A为负极;
C—D原电池,C为负极;
A—C原电池,A为负极;
B—D原电池,D为负极。
综上可知,金属活动性:
A>C>D>B。
答案 B
【学以致用2】 试根据氧化还原反应:
2FeCl3+Cu===2FeCl2+CuCl2设计原电池,并画出装置图。
指出电解质溶液是________,负极是________,电极反应式为___________,正极是________,电极反应式为__________________________。
解析 氧化还原反应中的氧化剂在正极反应,还原剂在负极反应。
根据方程式可知,铜作负极,FeCl3为电解质,正极选用不与FeCl3反应但能导电的物质。
答案 FeCl3 Cu Cu-2e-===Cu2+ 石墨 2Fe3++2e-===2Fe2+
1.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极的材料必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是正极
D.原电池工作时,电路中的电流是从负极到正极
解析 构成原电池的电极可以是金属与金属,也可以是金属与非金属等,A项错误;
原电池中电子流出的一极是负极,C项错误;
原电池工作时,电流是从正极到负极,D项错误。
2.下列各组材料中,不能组成原电池的是( )
选项
两极材料
Zn片、石墨
Cu片、Ag片
Zn片、Cu片
Fe片、Cu片
插入溶液
H2SO4溶液
AgNO3溶液
蔗糖溶液
稀盐酸
解析 C项中蔗糖溶液不是电解质溶液。
3.钢铁发生电化学腐蚀时,正极上发生的电极反应是( )
A.2H++2e-===H2↑
B.Fe2++2e-===Fe
C.2H2O+O2+4e-===4OH-
D.Fe3++e-===Fe2+
解析 钢铁发生吸氧腐蚀时,负极反应为Fe-2e-===Fe2+,正极反应为O2+4e-+2H2O===4OH-,C正确。
4.常用的纽扣电池为银锌电池,它分别以锌和氧化银为电极。
放电时锌极上的电极反应是Zn+2OH--2e-===Zn(OH)2,氧化银极上的反应是Ag2O+H2O+2e-===2Ag+2OH-,下列判断中,正确的是( )
A.锌是负极,发生氧化反应,氧化银是正极,发生还原反应
B.锌是正极,发生氧化反应,氧化银是负极,发生还原反应
C.锌是负极,发生还原反应,氧化银是正极,发生氧化反应
D.锌是正极,发生还原反应,氧化银是负极,发生氧化反应
解析 放电时是原电池。
负极是较活泼金属,还原性物质,发生氧化反应;
正极是较不活泼金属或导体,氧化性物质,发生还原反应。
答案 A
5.在铜锌原电池中,以硫酸铜为电解质溶液,锌为________极,电极上发生的是________反应(填“氧化”或“还原”),电极反应式为____________________。
锌片上观察到的现象为________;
铜为________极,电极上发生的是________反应(填“氧化”或“还原”),电极反应式是________;
铜片上观察到的现象是________,原电池总反应的离子方程式为________________。
解析 CuSO4为电解质溶液时,铜锌原电池的负极为锌,电极反应式为Zn-2e-===Zn2+,所以锌片不断溶解,正极为铜,电极反应式为Cu2++2e-===Cu,所以铜极不断变粗,电池总反应式为Zn+Cu2+===Zn2++Cu。
答案 负 氧化 Zn-2e-===Zn2+ 锌片溶解 正 还原 Cu2++2e-===Cu 铜极变粗 Zn+Cu2+===Zn2++Cu
课时作业
基础巩固
1.下图装置能够组成原电池的是( )
解析 根据原电池的形成条件进行分析解答。
(1)由较活泼的电极与较不活泼的电极构成原电池的两极,可排除A选项;
(2)要有电解质溶液,可排除D选项;
(3)一般能自发地发生氧化还原反应,可排除C选项。
2.下列关于原电池的叙述中正确的是( )
A.正极和负极必须是两种不同的金属
B.电子流入的一极为正极
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5g锌溶解,正极上就有0.1g氢气生成
解析 原电池中电子从负极流出,从正极流入。
它的正、负极可以是两种活动性不同的金属,也可以是金属与非金属;
原电池工作时负极上发生氧化反应,正极上发生还原反应;
当锌片上有6.5g锌溶解时,正极上析出0.2g氢气。
3.右图为铜锌原电池示意图,下列说法正确的是( )
A.锌片逐渐溶解
B.烧杯中溶液逐渐呈蓝色
C.电子由铜片通过导线流向锌片
D.Zn为正极,Cu为负极
解析 在该原电池中,Zn作负极,Zn溶解并失e-,在外电路中e-由Zn→Cu,在Cu电极表面,H+得e-生成H2,故Cu并没有参加任何反应,故A选项正确,B、C两项错误;
锌的活动性大于铜,Zn为负极,Cu为正极,D选项错误。
4.李明在学完了原电池的知识之后,设计了如图所示的柠檬水果电池,观察到外电路上的电流从电极X流向电极Y。
已知他选择了铁为X极,则Y极应该是( )
A.锌B.石墨
C.银D.铜
解析 电流的方向与电子的流动方向相反,则电子由电极Y经导线流向电极X,因此Y电极的活泼性强于铁,故Y电极只能为锌。
5.有如图装置,下列有关该装置反应开始时的叙述正确的是( )
A.锌极附近滴入酚酞,溶液呈红色
B.铁极发生的电极反应为2H2O+O2+4e-===4OH-
C.铁极发生吸氧腐蚀生成铁锈
D.溶液中的OH-向铁极移动
解析 装置相当于中性溶液中较活泼金属锌发生吸氧腐蚀,锌极发生反应Zn-2e-+2OH-===Zn(OH)2,滴入酚酞,溶液不呈红色,A错误;
铁极发生还原反应,而铁的腐蚀是氧化反应,B正确,C错误;
溶液中阴离子向锌极(负极)移动,D错误。
6.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验
装置
部分实
验现象
a极质量减小,b极质量增大
b极有气体产生,c极无变化
d极溶解,c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>
b>
c>
dB.b>
d>
a
C.d>
a>
cD.a>
c
解析 装置一是原电池,a极质量减小,说明a极金属失电子形成离子,故a极金属比b极金属活泼;
装置二没有形成原电池,可知b比c活泼,且c位于金属活动性顺序表中氢的后面;
装置三形成原电池,易知d比c活泼;
装置四中,电流从a极流向d极,则电子是从d极流向a极,知d比a活泼。
因此四种金属的活动性顺序为d>
c。
7.由A、B两种金属和稀硫酸组成的原电池,A是正极,则下列推断正确的是( )
A.A的金属性强于B
B.A电极上发生的电极反应是还原反应
C.电子不断由A电极经外电路流向B电极
D.A在金属活动性顺序表中一定排在氢前面
解析 原电池中,负极金属的活动性比正极金属的活动性强,电子从负极流向正极,正极金属的活动性比负极金属的活动性弱,但不一定排在氢的前面。
8.以前所用锌锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为Zn-2e-===Zn2+,2MnO2+2NH
+2e-===Mn2O3+2NH3+H2O。
下列有关锌锰干电池的叙述中,正确的是( )
A.干电池中锌筒为正极,石墨棒为负极
B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器
C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.干电池可实现化学能向电能和电能向化学能的相互转化
解析 锌锰干电池中,较活泼的金属锌筒为负极,石墨棒为正极,A错误;
长时间使用后,锌筒上消耗出现空洞,糊状电解质流出,容易腐蚀用电器,B正确;
原电池中电子流动方向由负极经外电路流向正极,而电流方向相反,C错误;
干电池中只有化学能转化为电能,D错误。
9.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图。
下列有关氢氧燃料电池的说法,正确的是( )
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:
解析 燃料电池是将化学能转化为电能,A项不正确;
a极通入H2发生氧化反应,是电池的负极,B项不正确;
外电路中电子由负极流向正极,即由电极a通过导线流向电极b,C项不正确。
10.据报道,锌电池可能将会取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。
其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解液和空气。
则下列叙述正确的是( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-===Zn2+
C.正极发生氧化反应
D.电解液为强酸
解析 Zn与O2反应的电子转移情况为
===2ZnO,所以Zn作负极,负极发生氧化反应,Zn-2e-===Zn2+。
O2是正极反应物,发生还原反应。
若电解液是强酸,电池的化学反应不是2Zn+O2===2ZnO,而是Zn+2H+===Zn2++H2↑。
能力提升
11.将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
(1)锌片上发生的电极反应式为__________________;
银片上发生的电极反应式为______________。
(2)若起始时该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,则生成H2体积(标准状况)为________,电子转移数目是________。
解析
(1)因金属的活动性顺序为Zn>
Ag,所以将锌片和银片浸入稀硫酸中组成原电池时,锌片作负极,发生氧化反应Zn-2e-===Zn2+;
银片作正极,发生还原反应2H++2e-===H2↑。
(2)锌片与银片总质量减轻,是因为负极锌失去电子溶解,根据电子得失守恒,负极每有1mol锌溶解,正极必产生1molH2,并转移2mol电子。
根据电子得失守恒有:
Zn+2H+===Zn2++H2↑~转移电子
65 22.4L 2e-
60g-47g VL x
=
得V=4.48L,x=0.4mol,故N(e-)=0.4NA。
答案
(1)Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)4.48L 0.4NA
12.燃料电池是目前正在探索的一种新型电池。
它主要是利用燃料在燃烧过程中把化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是
x极:
O2(气)+2H2O(液)+4e-===4OH-
y极:
H2(气)+2OH--2e-===2H2O(液)
回答下列问题:
(1)x是________极,发生________反应。
(填“氧化”或“还原”,下同)
(2)y是________极,发生________反应。
总反应方程式为______________。
(3)若反应后得到5.4g液态水,此时氢氧燃料电池转移的电子数为________。
解析
(1)x极:
O2得电子发生还原反应,所以为正极。
(2)y极:
H2失电子发生氧化反应,所以为负极。
x极、y极得失电子应相同,故x极电极方程式与y极电极方程式乘以2相加得总反应方程式为2H2+O2===2H2O。
(3)4mole-~ 2H2O
4mol 2×
18g
n(e-) 5.4g
n(e-)=0.6mol。
答案
(1)正 还原
(2)负 氧化 2H2+O2===2H2O (3)0.6NA
13.市场上出售的“热敷袋”其主要成分是铁屑、碳粉、木屑和少量氯化钠、水等。
热敷袋启用之前用塑料袋密封与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。
使用完毕后,会发现有大量铁锈存在。
据此回答:
(1)热敷袋使用时,放出热量的原因是___________________