人教版化学高二选修6第二单元实验22海水的蒸馏同步练习II卷Word文件下载.docx
《人教版化学高二选修6第二单元实验22海水的蒸馏同步练习II卷Word文件下载.docx》由会员分享,可在线阅读,更多相关《人教版化学高二选修6第二单元实验22海水的蒸馏同步练习II卷Word文件下载.docx(12页珍藏版)》请在冰豆网上搜索。
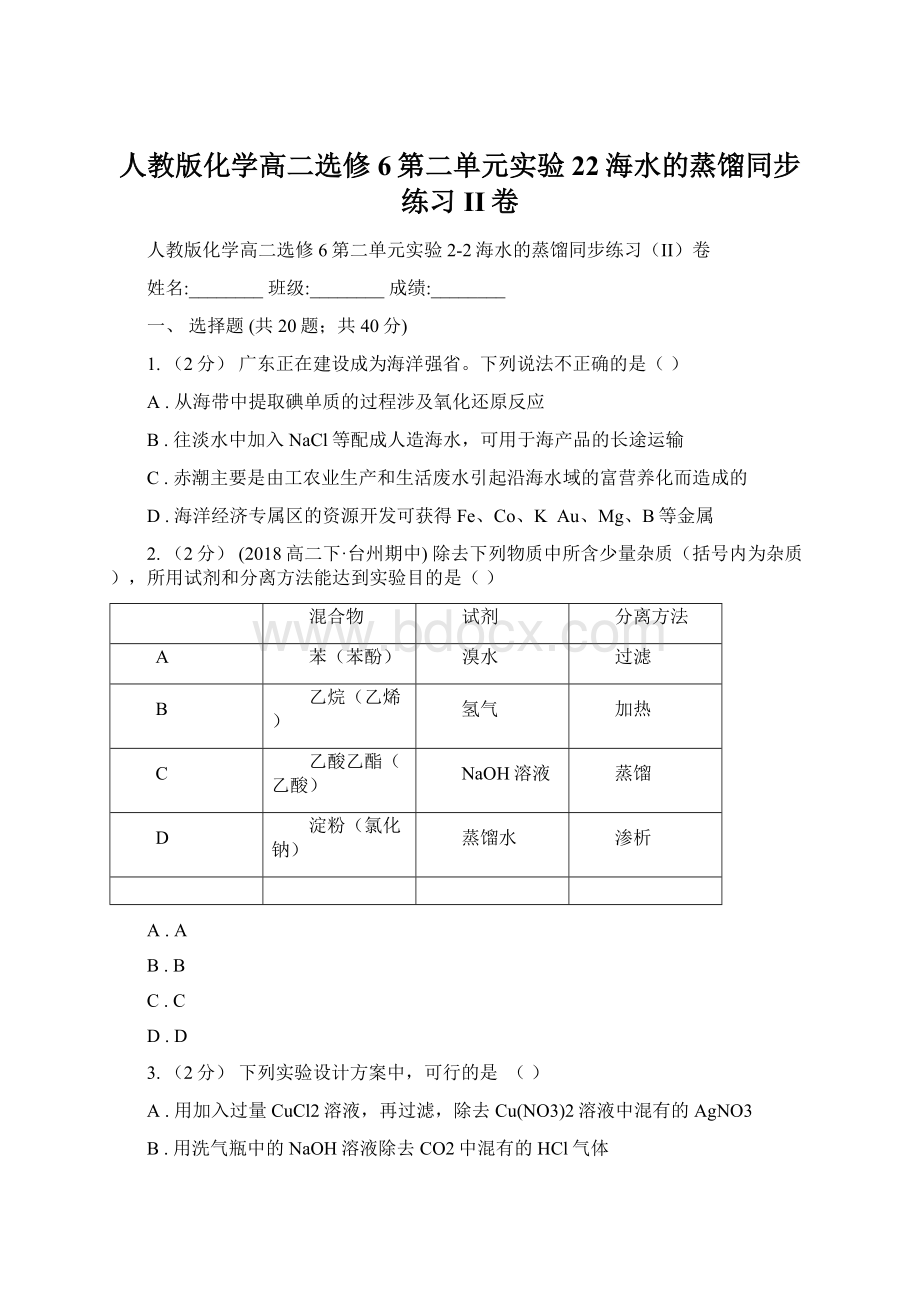
NaOH溶液
蒸馏
D
淀粉(氯化钠)
蒸馏水
渗析
A.A
B.B
C.C
D.D
3.(2分)下列实验设计方案中,可行的是
()
A.用加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3
B.用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
C.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42-
D.先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开
4.(2分)(2015高一上·
焦作月考)提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法是()
A.加入过量的碳酸钠溶液,过滤、除去沉淀,溶液中补加适量硝酸
B.加入过量的碳酸钾溶液,过滤、除去沉淀,溶液中补加适量硝酸
C.加入过量的硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量的硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
5.(2分)(2015高一上·
北京月考)要除去KNO3溶液中混有的少量Ba(NO3)2杂质,得到纯净的KNO3溶液,操作正确的是()
A.加入适量的Na2CO3溶液,过滤
B.加入足量的K2CO3溶液,过滤
C.先加入过量的K2CO3溶液,过滤,再向滤液中加入适量的稀HNO3
D.先加入过量的K2CO3溶液,过滤,再向滤液中加入适量的稀盐酸
6.(2分)(2016高一上·
大名期中)下列实验操作中正确的是()
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑的气体,证明该固体一定含有CO32﹣
C.取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
7.(2分)下列实验能达到预期目的的是
A.检验溶液中是否含有CO32-:
滴加稀盐酸,将产生的气体通入澄清石灰水
B.从含I-的溶液中提取碘:
加入适量稀硫酸与3%的H2O2溶液,再用酒精萃取
C.检验蔗糖水解产物:
向蔗糖溶液中加入适量稀硫酸水浴加热后,再加入新制的Cu(OH)2悬浊液,加热至沸腾
D.除去Mg(OH)2中的少量Ca(OH)2:
加入足量的MgCl2溶液,充分反应后过滤洗涤
8.(2分)甲烷中混有乙烯,欲除去乙烯得到纯净干燥的甲烷,最好依次通过盛有哪项试剂的洗气瓶()
A.溴水,浓H2SO4
B.酸性KMnO4溶液,浓H2SO4
C.澄清石灰水,浓H2SO4
D.浓H2SO4,溴水
9.(2分)(2015高一上·
衡水月考)下列分离、提纯、鉴别物质的方法不正确的是()
A.用渗析的方法除去NaCl溶液中含有的少量淀粉胶体
B.用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2杂质
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
10.(2分)在使用下列玻璃仪器前,不需要检验其是否漏液的是()
A.分液漏斗
B.滴定管
C.容量瓶
D.量筒
11.(2分)(2016高二上·
巴彦期中)可以用分液漏斗分离的一组液体混合物是()
A.溴和四氯化碳
B.苯和溴苯
C.汽油和苯
D.硝基苯和水
12.(2分)下列除去杂质的实验方法正确的是()
A.除去CO中少量O2:
通过灼热的Cu网后收集气体
B.除去K2CO3中少量NaHCO3:
置于坩埚中加热
C.除去N2中少量NH3,可依次通过水、浓H2SO4洗后收集气体
D.可用铁粉除去FeCl3溶液中的少量的CuCl2
13.(2分)(2017高二下·
红桥期末)下列各组中除去M中混有的杂质N,所使用的试剂及方法正确的是()
选项
M
N
除杂试剂
除杂方法
苯
溴
分液
CH4
CH2=CH2
酸性KMnO4溶液
洗气
CH3COOCH2CH3
CH3COOH、C2H5OH
苯酚
三溴苯酚
水
14.(2分)下列物质的分离方法正确的是()
①用升华法分离碘和氯化铵的混合物
②用结晶法分离硝酸钾和氯化钠的混合物
③用分液法分离水和硝基苯的混合物
④用蒸馏法分离乙醇(沸点为78.5℃)和乙酸乙酯(沸点为77.5℃)的混合物
A.①②
B.②③
C.③④
D.②④
15.(2分)(2020高一下·
浙江开学考)下列说法不正确的是()
A.用药匙取用少量二氧化锰粉末
B.蒸馏实验中忘记加沸石,应先停止加热,待溶液冷却后加入沸石,继续蒸馏
C.用干燥洁净的玻璃棒蘸取84消毒液(主成分NaClO),点滴到干的pH试纸上测pH
D.油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度,从而增大与氢氧化钠溶液的接触面积,加快油脂皂化反应速率
16.(2分)已知溶质粒子能透过半透膜,胶体粒子不能透过半透膜,但能透过滤纸.淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征.现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是()
A.加BaCl2溶液有白色沉淀
B.加入碘水不变蓝
C.加入BaCl2溶液无白色沉淀
D.加入碘水变蓝
17.(2分)(2020高二上·
安庆期末)下列有机物分离提纯方法正确的是()
A.除去乙醇中的水:
加入少量金属钠
B.除去苯中的溴苯:
采用分液法
C.除去乙烯中的甲烷:
通入氢氧化钠溶液
D.提纯苯甲酸:
利用重结晶法
18.(2分)下列有关混合物的分离与提纯的说法正确的是()
A.由于碘在乙醇中的溶解度较大,所以可用乙醇把碘水中的碘萃取出来
B.水的沸点为100℃,乙醇的沸点为78.5℃,所以用加热蒸馏的方法使含水乙醇变为无水乙醇
C.由于汽油和水不互溶,因此可用分液的方法将二者分离
D.NaCl溶液度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl浓溶液中分离得到纯净的NaCl
19.(2分)下列说法正确的是()
A.仅用AgNO3溶液便可鉴别亚硝酸钠和食盐
B.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
C.乙酸与乙醇的混合液可用分液漏斗进行分离
D.用标准盐酸滴定待测NaOH溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
20.(2分)(2017高二上·
怀柔期末)如表中所采取的分离方法与对应原理都正确的是()
目的
原理
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
分离乙酸乙酯和乙醇
乙酸乙酯和乙醇的密度不同
除去KNO3中混杂的NaCl
重结晶
氯化钠在水中的溶解度很大
除去丁醇中的乙醚
丁醇与乙醚的沸点相差较大
二、非选择题(共5题;
21.(8分)(2017高二上·
海南期末)除去括号内的杂质,写出所加试剂的化学式和相关反应的离子方程式.
(1)Cl﹣(SO42﹣)________,________;
(2)SO42﹣(CO32﹣)________,________;
(3)NaCl(NaOH)________,________;
(4)Fe2+(Cu2+)________,________.
22.(7分)溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等.制备CaBr2•2H2O的主要流程如下:
(1)
与液溴的反应温度不能超过40℃的原因是________
(2)
滤渣的成分可能是________
(3)
试剂M是________
,加入M的目的是________
(4)
操作Ⅱ的步骤为蒸发浓缩,________
、洗涤、干燥.
(5)
将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式________
.
(6)
制得的CaBr2•2H2O可以通过以下方法测定纯度:
称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,得到2.00g固体.则CaBr2•2H2O的质量分数为 ________
.(相对原子质量:
Ca﹣40Br﹣80H﹣1O﹣16)
23.(10分)根据问题填空:
(1)写出下图中序号①~④仪器的名称:
①________;
②________;
③________;
④________;
(填仪器序号)
(2)分离碘水中的碘应先选择装置________(填名称)
(3)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸100mL.
①所需仪器除烧杯、玻璃棒外还需________、________、________.
②所取浓硫酸的体积为________mL.
③下列操作引起所配溶液浓度偏高的是________
A.取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D定容时俯视
E颠倒摇匀后发现液面低于刻度线,但未加水至刻度线.
24.(7分)(2019·
上高模拟)研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
PbO2的氧化性大于MnO2。
PbSO4是一种微溶物质。
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
(1)浸出过程中生成Mn2+反应的化学方程式为________,
(2)Fe2+被氧化的过程中主要反应的离子方程式________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。
请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有________等(写二点)。
(5)吸附步骤除去的主要离子为________。
(6)电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式________。
(7)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×
10—6。
现将cmol·
L—1CaCl2溶液与2.00×
10—2
mol·
L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是________。
25.(8分)(2018高二上·
烟台期中)氮和磷为周期表中的第VA族元素,它们的元素及其化合物在性质上既有相似性又有不同性。
回答下列问题:
(1)N2分子中两个N原子都达到8电子稳定状态,则两个N原子之间共有电子的数目为________;
白磷的分子式为P4,4个P原子相互之间共形成6个共价单键,且每个P原子都达到8电子稳定状态,则白磷分子的空间构型为________。
(2)N、P两种元素都能形成多种气态氢化物。
联氨(N2H4)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离方程式________,联氨与磷酸(H3PO4)形成的磷酸二氢盐的化学方程式为________。
(3)P2O5是一种干燥剂,下列气体不能用P2O5干燥的是________(填字母序号)。
A.SO2
B.NH3
C.CO
D.H2
E.H2S
F.O2
(4)次磷酸(H3PO2)是一元中强酸,它的工业制法是将白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。
写出白磷与Ba(OH)2溶液反应的化学方程式________,Ba(H2PO2)2为________(填“正盐”或“酸式盐”)。
参考答案
1-1、
2-1、
3-1、
4-1、
5-1、
6-1、
7-1、
8-1、
9-1、
10-1、
11-1、
12-1、
13-1、
14-1、
15-1、
16-1、
17-1、
18-1、
19-1、
20-1、
21-1、
21-2、
21-3、
21-4、
22-1、
22-2、
22-3、
22-4、
22-5、
22-6、
23-1、
23-2、
23-3、
24-1、
24-2、
24-3、
24-4、
24-5、
24-6、
24-7、
25-1、
25-2、
25-3、
25-4、