专题13 化学实验综合应用Word格式文档下载.docx
《专题13 化学实验综合应用Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《专题13 化学实验综合应用Word格式文档下载.docx(10页珍藏版)》请在冰豆网上搜索。
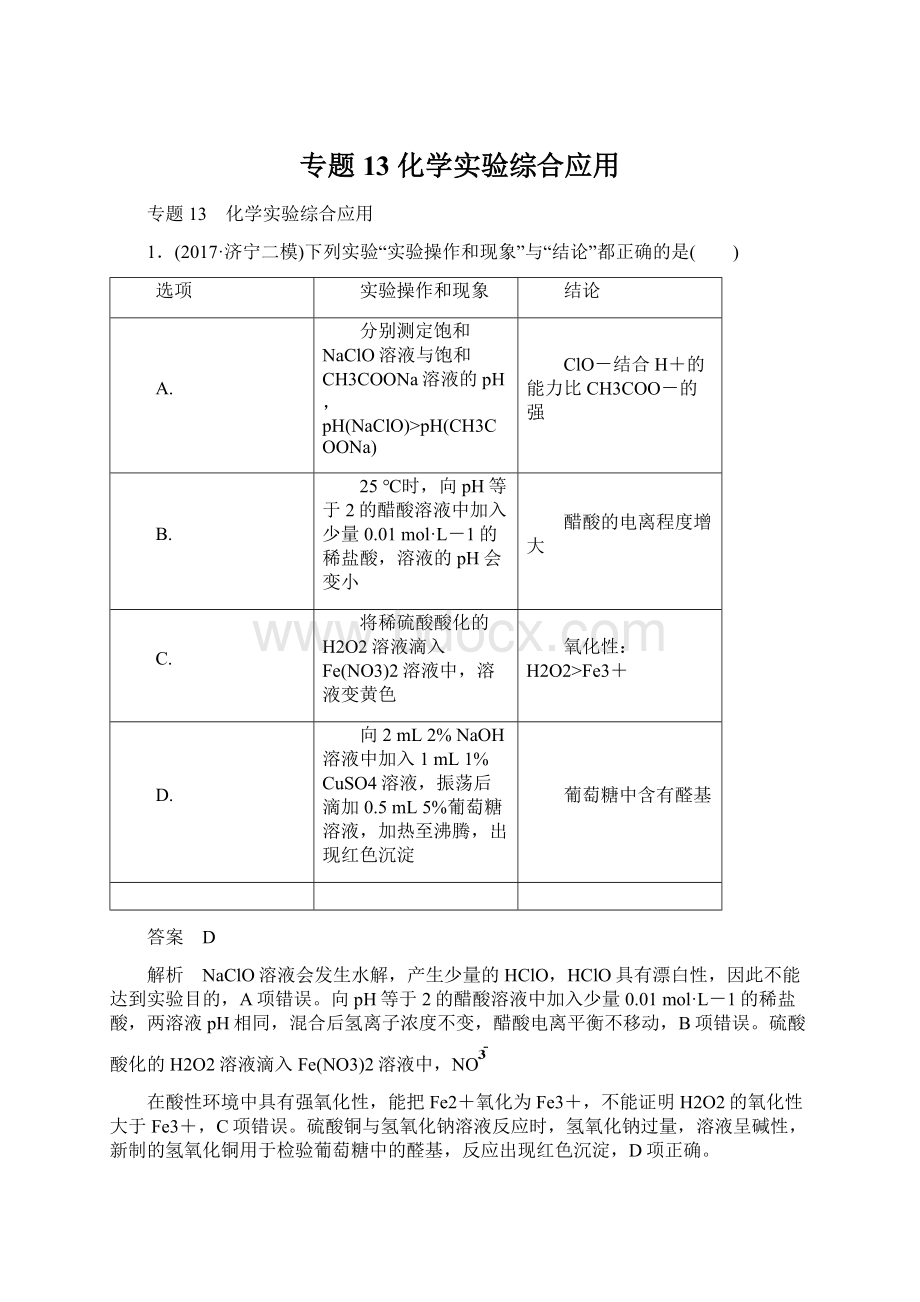
葡萄糖中含有醛基
答案 D
解析 NaClO溶液会发生水解,产生少量的HClO,HClO具有漂白性,因此不能达到实验目的,A项错误。
向pH等于2的醋酸溶液中加入少量0.01mol·
L-1的稀盐酸,两溶液pH相同,混合后氢离子浓度不变,醋酸电离平衡不移动,B项错误。
硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,NO
在酸性环境中具有强氧化性,能把Fe2+氧化为Fe3+,不能证明H2O2的氧化性大于Fe3+,C项错误。
硫酸铜与氢氧化钠溶液反应时,氢氧化钠过量,溶液呈碱性,新制的氢氧化铜用于检验葡萄糖中的醛基,反应出现红色沉淀,D项正确。
2.(2017·
太原二模)下列实验操作、现象和对应的实验结论均正确的是( )
实验结论
检验某溶液中是否含有SO
时,向溶液中滴加用盐酸酸化的BaCl2溶液,有白色沉淀生成
该溶液中一定含有SO
检验输送氯气的管道是否发生泄漏时,用一根玻璃棒蘸取浓氨水,然后靠近管道
有白色烟产生时说明管道发生泄漏
检验FeCl3溶液中是否含有Fe2+时,向溶液中滴加酸性KMnO4溶液,溶液变为无色
该溶液中一定含有Fe2+
向2mL0.1mol·
L-1硝酸银溶液中加入1mL0.1mol·
L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol·
L-1Na2S溶液,有黑色沉淀生成
该现象说明相同温度下,Ksp(Ag2S)<
Ksp(AgCl)
答案 B
解析 加入盐酸酸化的氯化钡溶液产生的沉淀也可能是氯化银,A项错误。
浓氨水能挥发出氨气,如果管道发生泄漏,则逸出的氯气与氨气反应生成氯化铵和氮气,能看到白烟,B项正确。
检验FeCl3溶液中是否含有Fe2+时,向溶液中滴加酸性KMnO4溶液,如果溶液红色褪去则可证明有亚铁离子,溶液变为无色是不可能的,因为氯化铁溶液本身就显黄色,C项错误。
硝酸银与氯化钠反应后还有剩余,硫化钠可与溶液中的银离子直接反应,无法证明哪种沉淀的溶度积更小,D项错误。
3.(2017·
青岛二模)下列所述实验中,现象和结论均正确的是( )
实验
现象
将硝酸亚铁加入稀硫酸中充分反应后滴加KSCN溶液
有气体生成,溶液呈红色
硫酸有强氧化性
NaAlO2溶液中滴入NaHCO3
产生白色沉淀
酸性:
HCO
>
Al(OH)3
Na2CO3溶液中滴入酚酞
溶液变红
能水解的盐溶液中的水的电离度一定比纯水的大
将少量氯水滴在淀粉-KI试纸上
试纸中间褪色,试纸边缘变蓝
氯气既有氧化性又有漂白性
解析 在酸性溶液中硝酸根具有强氧化性,把亚铁离子氧化为铁离子,A项错误。
产生白色沉淀说明偏铝酸根能结合碳酸氢根电离出的氢离子,因此酸性HCO
Al(OH)3,B项正确。
能水解的盐溶液中的水的电离度不一定比纯水的大,例如亚硫酸氢钠溶液,C项错误。
氯水滴在淀粉-KI试纸上,试纸变蓝但不能褪色,且氯气没有漂白性,溶于水生成的次氯酸具有漂白性,D项错误。
4.(2017·
洛阳三模)下列由实验现象得出的结论正确的是( )
实验及现象
向AgNO3和AgCl的浊液中滴入0.1mol/LNa2S溶液,生成黑色沉淀
Ag2S的溶度积比AgCl的小
将光亮镁条放入盛有NH4Cl溶液的试管中,产生大量气泡,同时将湿润的红色石蕊试纸靠近试管口,试纸变蓝
反应产生的气体一定是NH3
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀
溶液X中一定含有SO
将铜粉加入1.0mol/LFe2(SO4)3溶液中,溶液变蓝
说明氧化性Fe3+>
Cu2+
解析 AgNO3溶液中滴加Na2S溶液也能生成黑色Ag2S沉淀,A项错误。
NH4Cl溶液因NH
的水解显酸性,加入镁条生成的气体可能是氢气和氨气的混合气体,B项错误。
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,产生白色沉淀,溶液X中可能含SO
或SO
,或二者均有,C项错误。
将铜粉加入1.0mol/LFe2(SO4)3溶液中,溶液变蓝,说明溶液中Fe3+能氧化铜,生成Cu2+,即氧化性Fe3+>
Cu2+,D项正确。
5.(2017·
潍坊一模)某化学实验小组欲用下列装置制备纯净的氯气及含氯化合物,并探究其性质。
(1)欲制备并收集一瓶纯净的氯气,选择上图中合适的装置,其连接顺序为______________________(按气流方向,用小写字母表示)。
根据选择的装置,写出制备氯气的化学方程式:
__________________。
(2)取100mL氯气与NaOH溶液反应生成的“84”消毒液,持续通入过量的SO2,溶液中开始出现黄绿色,后黄绿色逐渐褪去。
溶液变为黄绿色的可能原因是:
①溶液中Cl-与ClO-反应所致,设计实验方案确认这种可能性:
____________________________。
②_____________________________________________________
所致(用离子方程式表示)。
向反应后的溶液中先加入足量稀盐酸,再加入足量氯化钡溶液,经过滤、洗涤、干燥、称量,所得沉淀的质量为wg,则溶液中NaClO的物质的量浓度为________mol·
L-1。
(3)在加热条件下,氯气与NaOH溶液反应生成NaClO3和NaCl等,写出反应的离子方程式:
______________________。
实验小组设计下图装置(加热装置略去)验证NaClO3的性质。
已知:
2NaClO3+Na2C2O4+2H2SO4(稀)===2ClO2↑+2CO2↑+2Na2SO4+2H2O;
ClO2与氯气的化学性质相似。
控制装置A中分液漏斗活塞,缓慢滴加稀硫酸,观察到B装置中的现象是______________________;
装置C吸收的物质是____________________。
答案
(1)a(或b)、g、h、e、f、i、j、d(或m) a对应:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O b对应:
2KMnO4+16HCl===2KCl+MnCl2+5Cl2↑+8H2O
(2)①取少量“84”消毒液于试管中,滴加稀硫酸,观察溶液颜色变为黄绿色 ②2ClO-+SO2===Cl2+SO
(3)3Cl2+6OH-===ClO
+5Cl-+3H2O 溶液变蓝 ClO2和CO2
解析
(1)欲制备并收集纯净的氯气,二氧化锰固体和浓盐酸在加热条件下生成氯气,该反应为固液反应,需要加热,选A制Cl2,KMnO4固体和浓盐酸在不加热条件下就能生成氯气,该反应为固液反应,不需要加热,选B制Cl2,E除HCl,D干燥,F收集Cl2,C或G除去尾气,故选用装置连接顺序为a(或b)、g、h、e、f、i、j、d(或m),a对应:
MnCl2+Cl2↑+2H2O,b对应:
2KMnO4+16HCl===2KCl+MnCl2+5Cl2↑+8H2O。
(2)①若为溶液中Cl-与ClO-反应使溶液为黄绿色,应取少量“84”消毒液于试管中,滴加稀硫酸,观察溶液颜色变化。
②反应的离子方程式为2ClO-+SO2===Cl2+SO
;
设NaClO的物质的量为xmol,则
2NaClO~SO
~BaSO4
2mol233g
xwg
x=2w/233mol
c(ClO-)=
mol/L=
mol/L。
(3)在加热条件下,氯气与NaOH溶液反应生成NaClO3,离子方程式为3Cl2+6OH-===ClO
+5Cl-+3H2O;
控制装置A中分液漏斗活塞,缓慢滴加稀硫酸,ClO2将I-氧化为I2,I2能使淀粉溶液呈蓝色,观察到B装置中的现象是溶液变蓝,装置C吸收的物质是ClO2和CO2。
6.(2017·
保定二模)碱式碳酸镁可用于牙膏、医药、化妆品等工业,化学式为4MgCO3·
Mg(OH)2·
5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度。
某兴趣小组设计了如下几个方案:
方案Ⅰ
取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度。
(1)乙中发生反应的方程式为__________________。
(2)仪器接口的连接顺序为(装置可以重复使用)a________,丁的作用是__________________。
(3)当样品充分反应完后,缓慢通入空气的目的是_______。
方案Ⅱ
①称取碱式碳酸镁样品mg;
②将样品充分高温煅烧,冷却后称量;
③重复操作②,测得剩余固体质量为m1g(用托盘天平称量)。
(4)下列仪器中,该方案不会用到的是__________。
(5)判断样品完全分解的方法是________________;
本实验至少需要称量________次。
(6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3+SiO2
MgSiO3+CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?
______
(填“正确”或“错误”),请说明自己的理由:
_______________
__________________________________________________________。
答案
(1)4MgCO3·
5H2O+5H2SO4===5MgSO4+11H2O+4CO2↑
(2)debcb 除去CO2中的水蒸气
(3)将装置中残留的CO2全部赶出被完全吸收
(4)E
(5)样品连续两次高温煅烧,冷却称量质量相差0.1g以内 4
(6)错误 该反应的发生不影响生成CO2和水蒸气的量
解析
(1)乙中发生反应的化学方程式为4MgCO3·
5H2O+5H2SO4===5MgSO4+11H2O+4CO2↑。
(2)通过浓硫酸除去水蒸气,通过干燥管吸收二氧化碳;
气体通过干燥管的方向是“粗进细出”;
为了防止空气中水蒸气、二氧化碳进入吸收二氧化碳的干燥管,需要再连接一个干燥管,故仪器接口的连接顺序为adebcb,丁的作用是除去CO2中的水蒸气。
(3)当样品充分反应完后,缓慢通入空气的目的是将装置中残留的CO2全部赶出被完全吸收。
(4)该方案不会用到的是E。
(5)判断样品完全分解的方法是样品连续两次高温煅烧,冷却称量质量相差0.1g以内;
本实验加热前需要称量坩埚的质量、坩埚与药品的质量和,加热至质量恒重,至少称量两次,一共至少需要称量4次。
(6)错误。
理由:
该反应的发生不影响生成CO2和水蒸气的量。
7.(2017·
汕头二模)实验室制取乙酸丁酯的装置有如图所示两种装置供选择:
有关物质的物理性质如下表:
乙酸
1-丁醇
乙酸丁酯
熔点(℃)
16.6
-89.5
-73.5
沸点(℃)
117.9
117
126.3
密度(g/cm3)
1.05
0.81
0.88
水溶性
互溶
可溶(9g/100g水)
微溶
(1)制取乙酸丁酯的装置应选用__________(填“甲”或“乙”)。
不选另一种装置的理由是____________________________。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式)______________________________、______________________。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是______________________。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是____________(填选项字母)。
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。
使用分液漏斗前必须________________;
某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能______________________________。
答案
(1)乙 由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发,降低了反应物的转化率,乙装置含有冷凝回流装置,可以冷凝回流反应物,提高反应物的转化率,所以选乙装置
(2)CH3CH2CH2CH2OCH2CH2CH2CH3
CH3CH2CH===CH2
(3)增加乙酸浓度、减小生成物浓度(或移走生成物)
(4)AB
(5)检查是否漏水或堵塞 分液漏斗上口玻璃塞未打开(或漏斗内部未与大气相通,或玻璃塞上的凹槽未与漏斗口上的小孔对准)
解析
(1)由于反应物乙酸、1-丁醇的沸点低于产物乙酸丁酯的沸点,若采用甲装置,会造成反应物的大量挥发,降低了反应物的转化率,乙装置含有冷凝回流装置,可以冷凝回流反应物,提高反应物的转化率,所以选乙装置。
(2)因为1-丁醇在浓硫酸、加热条件下可以发生消去反应和分子间脱水反应,所以可能生成的副产物有
CH3CH2CH2CH2OCH2CH2CH2CH3、CH3CH2CH===CH2。
(3)①增加乙酸浓度,②减小生成物浓度(或移走生成物)。
(4)反应后的混合物中,乙酸能和水互溶,1-丁醇能溶于水。
所以可加入饱和碳酸钠溶液振荡,进一步减少乙酸丁酯在水中的溶解度,然后分液可得乙酸丁酯,故肯定需要化学操作是AB。
(5)使用分液漏斗前必须应检查是否漏水或堵塞;
若液体流不下来,可能分液漏斗上口玻璃塞上的凹槽未与漏斗口上的小孔对准,或漏斗内部未与外界大气相通,液体滴下时,分液漏斗内的压强减小,液体逐渐难以滴下,或者玻璃塞未打开,液体不能滴下。