1011上期末化学北京各区汇编2实验题Word文档格式.docx
《1011上期末化学北京各区汇编2实验题Word文档格式.docx》由会员分享,可在线阅读,更多相关《1011上期末化学北京各区汇编2实验题Word文档格式.docx(35页珍藏版)》请在冰豆网上搜索。
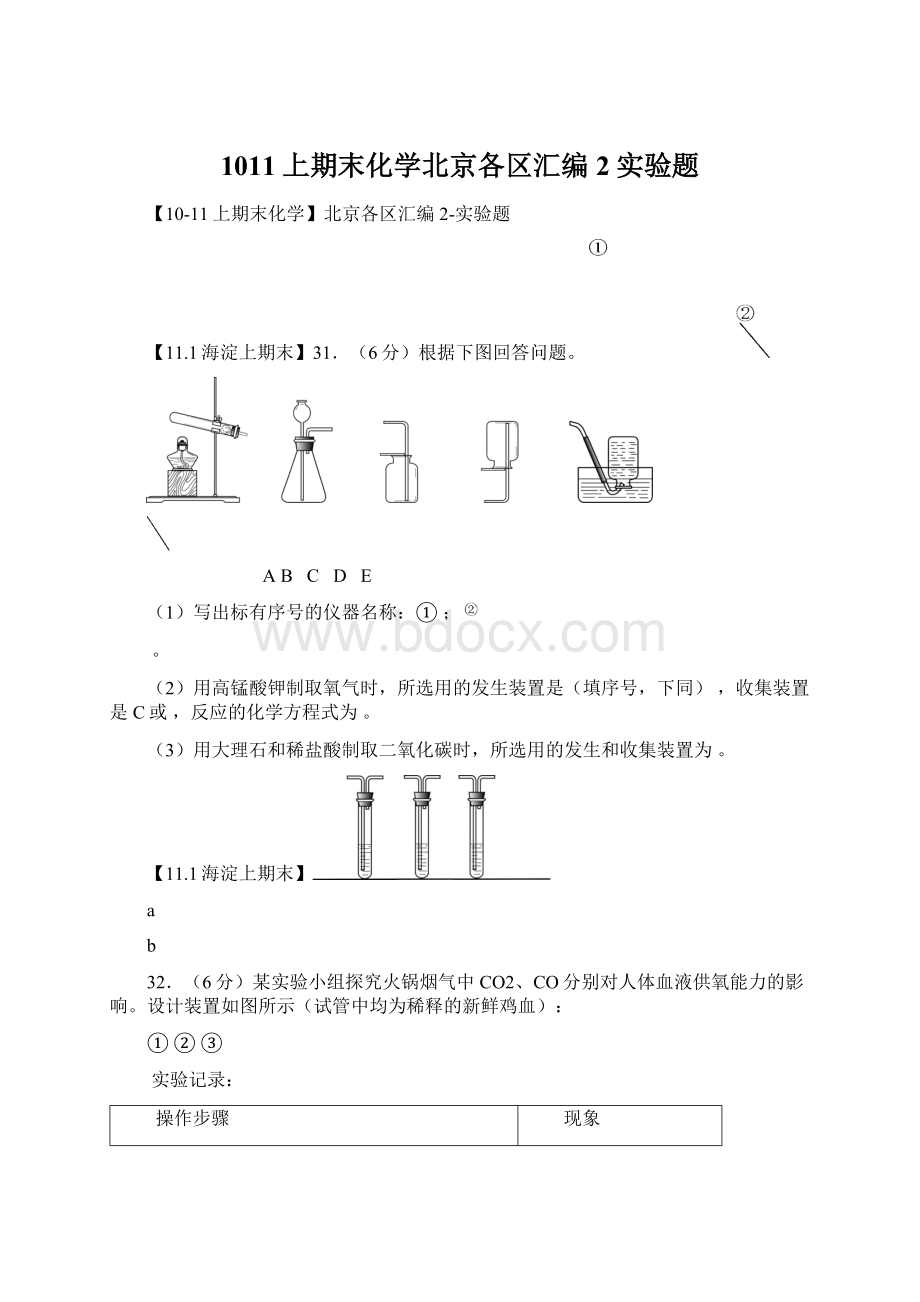
将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15gCa(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:
根据下图所示装置实验。
澄清石灰水
足量稀盐酸
钙片
(1)锥形瓶中发生反应的化学方程式为。
(2)长颈漏斗下部插入液面下的目的是。
(3)加入药品前,检验该装置气密性的方法是。
(4)记录数据如下:
钙片质量
空洗气瓶质量
澄清石灰水的质量
反应后洗气瓶及瓶内物质总质量
25g
100g
200g
300.4g
方案2:
将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。
记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
加入稀盐酸的质量
300g
400g
充分反应后烧杯及杯内物质总质量
222.8g
320.6g
418.4g
518.4g
【分析和评价】
(1)方案1和方案2中合理的是,原因是。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是。
(3)要使用【查阅资料】
(3)中介绍的方法,还需要学习的是。
【结论】经过计算,该钙片中碳酸钙的质量分数是。
【11.1朝阳上期末】31、(8分)请根据以下实验装置,回答问题:
(1)写出图中标号仪器的名称:
①
,
②
(2)写出实验室用A装置制取氧气的化学方程式
,
收集氧气可选用C装置或装置,若选用C装置收集较纯净氧气的适宜时间是(填字母)
A.当导管口刚有气泡冒出时B.当导管口停止冒出气泡时
C.当导管口有连续均匀气泡冒出时
(3)下列是有关二氧化碳制取的相关问题:
①鸡蛋壳的主要成分是碳酸钙,用鸡蛋壳与稀盐酸反应制取和收集二氧化碳气体,其反应的化学方程式是。
②如果用右图装置制取二氧化碳气体,反应进行一段时间后,将燃着的木条放在集气瓶口,火焰不熄灭的可能原因是:
③实验操作中将鸡蛋壳捣碎的目的是
【11.1朝阳上期末】
32.(7分)科技节活动中,化学实验小组做了如下实验,请回答以下问题。
(1)图A所示实验可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为色,该实验中没有涉及的性质是(填字母)。
A.氨分子是不断运动的B.氨分子有一定质量C.浓氨水具有挥发性
(2)图B所示实验,将注射器中浓石灰水注入瓶中,会看到鸡蛋被“吞”入瓶中,该实验中涉及的化学方程式为。
(3)图C所示实验,当通过导管向热水中通入氧气时,白磷在水下燃烧,该实验说明燃烧需要的条件为:
①可燃物;
②达到燃烧所需要的;
③,反应的化学方程式为。
(4)图D所示实验观察到紫色小花变为红色,小花变红的原因是
(用化学方程式表示)。
33.(4分)化学小组同学在加热二氧化锰样品时,发现有气泡产生(如图一所示),于是他们对这个异常现象进行了探究。
(1)对气体成分的探究:
加热二氧化锰样品,用燃着的木条靠近试管口,木条熄灭。
将气体通入澄清的石灰水,发现石灰水变浑浊,产生的气体是。
(2)对气体来源的探究:
【假设1】甲同学认为:
该气体来自于试管中的空气,请你设计实验证明该假设不成立
实验步骤及现象
结论
假设不成立。
【假设2】乙同学认为:
二氧化锰样品中可能混有炭粉,炭粉发生反应生成了该气体。
他设计了如图二所示的实验进行研究,其中B装置的作用是检验A中反应是否完全,B中的试剂是,实验中观察到D处澄清石灰水变浑浊。
他又用氮气代替空气(氮气不参与该实验中的任何反应),重复上述实验,发现D处澄清的石灰水也变浑浊。
【结论】通过乙同学的实验证明,二氧化锰中混有炭粉,炭粉与反应产生了这种气体。
【11.1西城上期末】31.(7分)请根据下图所示实验,回答问题。
甲乙丙
(1)甲中可观察到硫在氧气中燃烧,发出 火焰,此反应的化学方程式是 。
(2)乙中仪器a的名称是 ,玻璃管中的现象是 。
该装置的不足之处是 。
(3)丙中铜片上的现象是 ,由此得出可燃物燃烧的条件是 。
【11.1西城上期末】
32.(7分)同学们在课外活动中设计了有关气体的实验。
(1)气体的发生装置如右图所示。
①此装置若用于制备氧气,应在分液漏斗中盛放的药品是 ;
若用于制备二氧化碳,反应的化学方程式是 。
②此装置还可以验证某气体的化学性质,请完成下表中的内容。
仪器名称
分液漏斗
小试管
大试管
装置内的药品
大理石
用化学方程式表示相关性质
③在不改变此实验装置的基础上,同学们认为只要再增加一个操作,还可以验证该气体的其他化学性质。
增加的操作是 。
(2)同学们又设计以下实验研究某混合气体的组成。
①第一组:
取三支试管,在其容积的二分之一
处做标记。
分别充满气体(甲为CO2,乙为A
气体,丙为CO2和A的混合气)后倒扣在NaOH
溶液中。
最终观察到的实验现象如右图所示。
据此推测:
气体A的化学性质有 。
②第二组:
同学们利用右图所示的装置进行实验。
实验步骤:
关闭止水夹,向充满丙的集气瓶中注入
10mLNaOH溶液(足量),充分反应后,冷却至室
温,打开止水夹。
实验现象是 。
【11.1西城上期末】33.(5分)催化剂在科研、医药生产和电子工业等前沿领域有着广泛应用。
(1)为探究二氧化锰对氯酸钾分解的催化作用。
在相同条件下,同学们按下表进行实验并记录相关数据。
(其他影响实验的因素均相同)
编号
KClO3质量/g
其他物质质量/g
待测数据
实验1
2.0
实验2
MnO20.5
①表中a的数值应是 。
②表中的待测数据指 (填字母序号)。
A.氧气的质量B.反应后固体的质量
C.氧气的体积D.单位时间内产生氧气的体积
③设计“实验1”的目的是 。
(2)同学们继续探究二氧化锰是否参与了氯酸钾的分解反应。
氯酸钾和二氧化锰混合加热的化学方程式为:
2KClO3====2KCl+3O2↑。
已知氯酸钾与二氧化锰混合加热时连续发生如下反应,试分析后按要求填空。
(I)2KClO3+2MnO2===2KMnO4+Cl2↑+O2↑;
(II) (用化学方程式表示);
(III)K2MnO4+Cl2===2KCl+MnO2+O2↑。
通过以上分析,同学们得出结论:
二氧化锰参与了氯酸钾的分解反应。
【拓展】氟利昂释放出的氯原子参与了臭氧层的破坏,其微观示意图如下:
综合图中①②③的反应过程,写出臭氧层被破坏的化学方程式 。
【11.1东城上期末】
31.(7分)下图为实验室制取气体常用的装置,请回答有关问题。
⑴写出标有字母的仪器名称:
a、b。
⑵制取CO2应选择的发生装置是(填序号),其反应的化学方程式为
;
若用B装置制取O2,写出所发生反应的化学方程式_______。
⑶既可用于收集CO2,又可用于收集O2的装置是(填序号)。
收集时,二氧
化碳的验满方法是__________。
【11.1东城上期末】32.(6分)化学小组同学提取足量某火灾现场周围的空气,并探究该气体样品中是否含有CO。
实验装置如下所示。
向装置中通入气体样品一段时间后,高温加热D中的药品。
小资料:
1.二氧化碳气体能够被氢氧化钠溶液吸收。
2.干燥剂的作用为除去混合气体中的水蒸气。
请回答以下问题(提示:
请阅读小资料):
⑴装置B的作用是。
⑵根据实验中出现的或现象,能判断
出该气体样品中含有CO。
⑶D、E中发生反应的化学方程式分别为:
D、E。
⑷你认为该实验的设计是否存在缺陷?
如果有,应如何改进。
33.(7分)对实验装置的改进与创新,能够提高学习化学的兴趣和能力。
某兴趣小组同学进行了以下实验设计(注:
图中部分固定装置省略,a为活塞,b为支管口。
由分液漏斗滴
入内置试管的液体量如图所示)。
图1图2图3
⑴甲同学设计了如图1所示装置。
向内置试管中滴入足量浓氨水,一段时间后,观察到酚酞溶液变为红色,此现象说明分子具有的性质是。
⑵乙同学设计了如图2所示装置。
向内置试管中滴入足量稀硫酸,与碳酸钠充分反应,化学方程式为:
H2SO4+Na2CO3==Na2SO4+H2O+CO2↑。
①通过仔细观察,可看到两条试纸出现的相同现象是,不同现象是。
②将燃着的木条放在支管口处,可观察到的现象是。
③综合分析①和②现象,能够总结出二氧化碳的性质有。
⑶丙同学设计了如图3所示装置。
向内置试管中滴入足量溶液A,一段时间后,观察到水中锌粒表面有气泡,出现该现象的原因可能是。
【11.1丰台上期末】32.(6分)白磷、红磷都是可燃物,都可以在一定条件下燃烧。
以下是利用它们的可燃性进行的三个实验,请分别回答问题。
实
实验1实验2实验3
(1)通过实验1可以探究燃烧的条件。
烧杯中放有热水,a、b、c处分别放有药品,实验中只有a处的白磷燃烧。
a与c对比;
a与b对比,说明燃烧需要的条件是可燃物与氧气接触和,白磷燃烧的化学方程式为。
(2)通过实验2可以测定。
待集气瓶中的红磷熄灭,冷却后打开弹簧夹,当观察到的现象时,可达到该实验目的。
(3)通过实验3可以验证质量守恒定律。
实验前将白磷放入锥形瓶中,称量装置的总质量,引燃白磷,待反应后再称量装置总质量,发现托盘天平保持平衡。
整个实验过程中气球会出现的现象是。
综合分析上述三个实验,以下说法正确的是。
(填①~⑥序号)
①实验1中的热水只起隔绝空气的作用
②实验2中红磷可以换成木炭
③实验2若未达到实验目的,可能是由于装置气密性不好
④实验3中的气球起到了平衡瓶内外气体压强的作用
⑤实验3中的气球作用是收集产生的气体
⑥实验3锥形瓶内事先放少量细沙的作用是防止瓶底炸裂
【11.1丰台上期末】33.(7分)甲同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬的。
她想到在学过的金属活动性顺序中并没有金属铬,为比较铬与常见金属铁、铜的活动性强弱,她和同学们在应用所学知识进行分析的基础上,提出了以下猜想,并进行了实验探究。
【作出猜想】
猜想1.Cr>
Fe>
Cu;
猜想2.Fe>
Cu>
Cr;
猜想3.你的猜想是。
【查阅资料】
①铬(Cr)是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【实验药品】
铁片、铬片、铜片、稀硫酸、CuSO4溶液、CrSO4溶液、FeSO4溶液。
(溶液均为新制)
【甲同学实验】
甲同学取大小相等的三种金属片,用砂纸打磨光亮;
再取三支试管,分别放入等量的稀硫酸。
实验
实验操作
实验现象
结论与解释
试管1
铁片表面产生气泡较慢,溶液变为浅绿色。
(1)实验前用砂纸打磨金属片的目的是。
(2)甲同学得到的结论是猜想正确。
试管2
铬片表面产生气泡较快,溶液变为蓝色。
试管3
【乙同学实验】
乙同学为验证甲同学的结论,又设计了以下实验。
试管4
(1)甲同学的结论正确。
(2)请写出铬与硫酸铜反应的化学方程式。
试管5
【实验反思】
(1)你认为乙同学没有必要做的实验是。
(2)请你结合所给的实验药品再设计一个实验,验证甲同学的结论。
实验操作和实验现象
甲同学的结论正确。
【11.1石景山上期末】31.(5分)根据下图回答问题。
ABC
⑴仪器a的名称为▲。
⑵加热高锰酸钾制取氧气的装置是▲(填序号),反应的化学方程式为▲。
⑶根据CO2的性质分析,制备二氧化碳气体的装置选用A而不选用C的原因是▲,检验二氧化碳已经收集满的方法是▲。
【11.1石景山上期末】32.(5分)过氧化钠(化学式为Na2O2)能与CO2反应,化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑,可用在呼吸面具中作为氧气来源。
某实验小组欲用干燥的二氧化碳与过氧化钠反应收集一瓶氧气,实验装置如下图所示,请回答问题。
⑴实验室制取二氧化碳的化学方程式为▲。
⑵浓硫酸的作用是▲。
⑶若实验过程中发现澄清的石灰水变浑浊,其原因可能为▲,发生反应的化学方程式为▲。
⑷氧气可用E装置收集,并用带火星的木条检验,这是利用了氧气的▲性质。
【11.1石景山上期末】33.(9分)已知某金属粉末中可能含有铁、铝、铜三种金属中的两种或三种,化学小组的同学对该粉末进行探究。
【提出猜想】
猜想一:
该粉末由铜、铝组成;
猜想二:
该粉末由铁、铝组成;
猜想三:
该粉末由铁、铝、铜组成;
猜想四:
该粉末由▲组成。
【查阅资料】铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气,反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑,铁和铜与氢氧化钠溶液均不发生反应。
【供选药品】稀盐酸、稀硫酸、氢氧化钠溶液、硫酸铜溶液、澄清石灰水、蒸馏水。
【进行实验】
实验目的
实验结论
证明粉末中是否含有▲
取一个小烧杯,加入适量的粉末,再向其中加入足量的▲
▲
猜想四成立;
实验中发生反应
的化学方程式为
过滤,将得到的固体洗涤后放入小烧杯,再向其中加入足量的稀盐酸
【反思与评价】若将原粉末中的铜全部回收,请写出实验过程▲。
【11.1大兴上期末】31.(7分)在实验课上,老师要同学们配制15%的氯化钠溶液50g。
(1)计算:
配制15%的氯化钠溶液50g,需氯化钠的质量为g,水的体积为
mL。
(2)甲同学按下图所示步骤依次操作。
其错误的操作步骤有和(填字母序号);
B中仪器名称为;
E中玻璃棒的作用是。
(3)乙同学在将称量好的氯化钠倒入烧杯中时,不小心有一部分氯化钠固体撒出,则其所配溶液溶质质量分数与15%相比(答“偏低”、“偏高”、或“相等”)。
【11.1大兴上期末】32.(6分)下图所示是气体制取与性质验证的组合实验。
打开A中分液漏斗活塞后,A、B、C、D、E中均可观察到明显现象。
(1)A中发生反应的化学方程式为。
(2)B中的现象是,发生反应的化学方程式为。
(3)E中的现象是,发生反应的化学方程式为。
(4)用F装置收集气体的依据是。
【11.1大兴上期末】33.(6分)亚硝酸钠(NaNO2)是一种外观极像食盐,且具有与食盐一样咸味的有毒物质,因此,这种工业盐常被冒充食盐掺假或被误作食盐使用,导致多起中毒事故发生。
某校化学实验室有一瓶标签破损的试剂瓶,盛放的药品可能是氯化钠固体,也可能是亚硝酸钠固体,该校化学小组同学通过实验手段确定该瓶盛放的药品的成分。
其主要探究过程如下:
【提出假设】该药品的成分是NaCl。
亚硝酸钠
氯化钠
溶解性
15℃时溶解度为81.5g
15℃时溶解度为35.8g
熔点
271℃
801℃
沸点
320℃时发生分解有氧气等气体产生
1413℃
【实验过程】化学小组同学根据自己的假设,设计实验验证。
请你帮助他们完成实验报告。
(1)小华同学设计的实验如下:
实验装置
实验主要过程
①检查装置气密性。
操作如下:
先将导管伸入液面下,用手紧握试管,观察到,松开手后,导管口有液面上升。
②加入药品,加热,导管口有大量气泡生成。
③收集气体。
④停止加热。
熄灭酒精灯前,应,目的是。
(2)小明同学根据小华的实验判断该药品的成分是。
他又结合两物质的溶解性知识,设计了另一种实验方案,得到了同样的结论。
其实验方案是。
【11.1昌平上期末】31.(5分)请看图回答问题:
(1)图中仪器a的名称是。
(2)用B与C相连可以制备,该反应的化学方程式为。
(3)实验室制取二氧化碳应选用的发生装置和收集装置为_______(填序号),选用此收集方法的依据是。
【11.1昌平上期末】32.(8分)请根据下图A、B所示的化学实验(装置B铁架台已略去),回答以下问题。
AB
(1)装置A中,对比现象①②说明物质燃烧需要;
对比现象①③说明两种可燃物的
不同;
实验中水在其中的主要作用是。
(2)装置B是二氧化碳的制备和性质实验。
实验进行一段时间后,“人”字管左端发生反应的化学方程式为,右端可以观察到的现象是。
(3)装置B的干燥管中被石蕊溶液浸湿的纸质小花的颜色变化为;
请你设计实验证明小花颜色发生变化的原因,写出主要操作过程、实验现象和结论。
【11.1昌平上期末】33.(6分)根据初中化学知识,探究空气中氧气含量实验。
小明根据所学内容,红磷、白磷、木炭、镁条都可以和氧气发生反应,但是哪种物质更适用于测定空气中氧气含量,小明进行如下探究。
【探究问题】红磷、白磷、木炭、镁条几种物质,哪种更适用于测定空气中氧气含量?
1红磷、白磷对比情况
红磷
白磷
状态
暗红色固体
蜡状固体有毒
燃烧温度
240°
C
40°
2镁条可以与空气中多种物质反应,如N2、CO2等
【探究过程】如下图所示,按照实验装置进行实验,探究几种物质测定空气中O2含量的可行性。
(1)红磷、白磷探究实验
小明认为选用红磷进行实验,其原因是。
实验步骤
结论和化学方程式
如图所示,将足量红磷放到燃烧匙中,点燃红磷,进行实验
空气中氧气约占
化学方程式
(2)若将实验药品改为木炭,反应结束后降至室温,打开止水夹,水不倒吸入集气瓶的原因是。
(3)若将实验药品改为镁条,反应结束后降至室温,观察到水倒吸入集气瓶大于1/5。
根据资料信息,小明知道镁条可以与空气中的氮气、二氧化碳发生反应,进而影响反应结果。
镁条与氮气反应可以生成氮化镁(Mg3N2)和碳,请写出相应的化学方程式。
【探究结论】几种物质中,红磷是最适用于测定空气中氧气含量。
【11.1房山上期末】31.(8分)化学是一门以实验为基础的科学。
(1)根据下图所示实验,回答以下问题。
①A为测定空气中氧气含量的实验装置,有关反应的化学方程式为;
通过该实验可得出氧气约占空气总体积的的结论。
②集气瓶B中的现象:
铁丝在氧气中剧烈燃烧,,放出大量的热,有黑色固体生成。
该反应的化学方程式为。
取一朵用石蕊溶液染成紫色的干燥小花,将小花的一半用水喷湿,放入集气瓶C中,观察到的现象是。
(2)某实验小组模拟高炉炼铁的化学反应原理实验,其装置如下图所示。
①A处的现象是;
发生反应的化学方程式为。
②C处酒精灯的作用是。
【11.1房山上期末】32.(5分)右图所示,小试管中装有石灰石,滴管内装有稀盐酸,U形管内盛有食用菜籽油。
反应前U形管两侧的液面持平。
把滴管内的稀盐酸滴入小试管中,石灰石和稀盐酸发生反应。
请回答下列问题:
(1)小试管中发生反应的化学方程式为
(2)U形管内食用菜籽油的液面发生的变化是。
(3)若U形管内盛的不是菜籽油,而是氢氧化钠溶液,氢氧化钠溶液能吸收二氧化碳生成碳酸钠的水溶液,该反应的化学方程式为;
U形管内的现象是。
【11.1房山上期末】
33.(6分)燃烧是一种发光、放热的剧烈的化学反应。
认识燃烧,科学地利用和控制燃烧,使燃烧为人类服务是十分重要的。
[查阅资料]物质燃烧一般需要同时满足三个条件,物质具有可燃性是燃烧的首要条件,发生燃烧的另外两个条件分别是__________________;
______________。
[实验目的]验证木炭发生燃烧的另外两个条件中,缺少任何一个条件都不能燃烧(两个条件须分别验证)。
[实验设计与操作]下面是验证燃烧条件的实验装置图(可通过开启、关闭活塞控制液体)。
在完成气密性检查后加入药品,并已设法在整个装置中充满了氮气。
若要求实验过程中不得拆、装仪器,请设计后续的实验步骤,并按要求填表。
步骤
操作
预计现象及得出的结论
①
在活塞关闭的状态下,点燃酒精灯加热
②
盖灭酒精灯,待仪器恢复到常温
③
④
[反思评价]实验过程中,装置B的作用可能是。
【11.1延庆上期末】
31.(8分)下图是