甘肃省平凉市崆峒区平凉市第七中学学年九年级上学期第二次月考化学试题Word文档格式.docx
《甘肃省平凉市崆峒区平凉市第七中学学年九年级上学期第二次月考化学试题Word文档格式.docx》由会员分享,可在线阅读,更多相关《甘肃省平凉市崆峒区平凉市第七中学学年九年级上学期第二次月考化学试题Word文档格式.docx(14页珍藏版)》请在冰豆网上搜索。
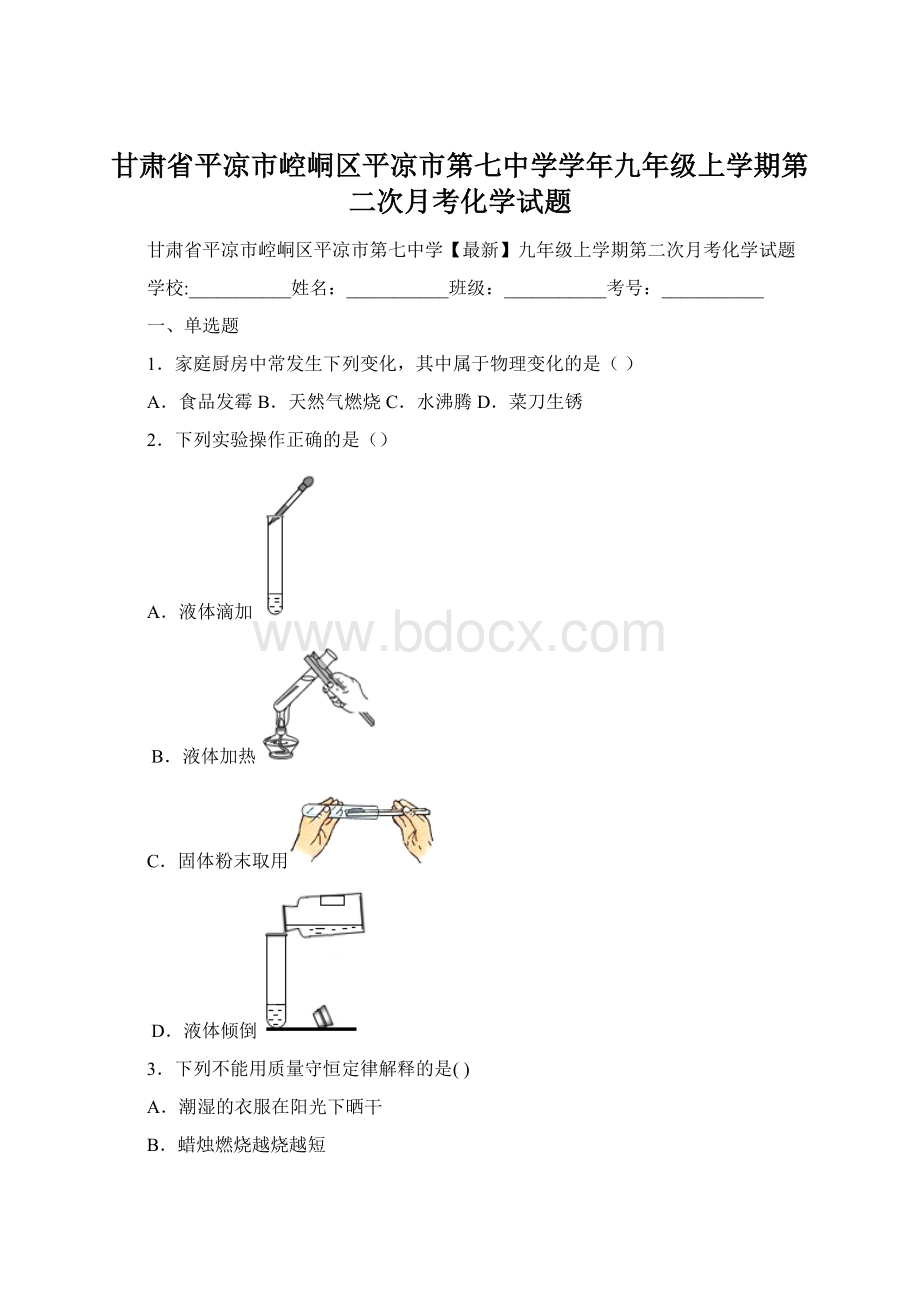
我国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3中的Se(硒)元素的化合价是
A.+2B.+4C.+6D.-2
7.执行探月工程嫦娥三号任务的长征三号乙遥二十三火箭,使用的推进剂是(C2H8N2)与(N2O4),反应的化学方程式为:
,X的化学式为()
A.CO
B.CO2
C.CH2O
D.H2
8.在化学反应A+2B=C+3D中,已知24gA与6gB恰好完全反应生成12gC,若反应后要生成9gD,则参加反应的A的质量为( )
A.16gB.12gC.8gD.24g
9.下列图中的
和
分别表示不同元素的原子,其中可能表示氧化物的是( )
A.
B.
C.
D.
10.在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法不正确的是
物质
X
Y
Z
W
反应前质量/g
10
3
90
反应后质量/g
3.2
待测
A.W可能是单质
B.Y可能是催化剂
C.该反应是分解反应
D.反应后Z物质的质量为86.4g
二、填空题
11.按下列要求写出化学式或化学符号。
(1)2个氢原子_______;
(2)4个二氧化碳分子_______;
(3)氖气_______;
(4)地壳中含量最多的金属元素与含量最多的非金属元素形成化合物的化学式_______;
(5)五氧化二磷中磷元素的化合价为+5价_______;
(6)3个亚铁离子_______。
12.镁是一种化学性质比较活泼的金属,点燃后既能在氧气中燃烧,还能在氮气中燃烧,其生成物氮化镁中氮元素的化合价为-3价;
①写出氮化镁的化学式_______;
②写出镁在氧气中燃烧的化学反应方程式_______;
此外镁在二氧化碳中也能燃烧,生成一种白色的金属氧化物和一种黑色炭粒。
③试写出镁在二氧化碳中燃烧的化学方程式:
_______。
三、流程题
13.城市的生活用水是经自来水厂净化处理过的。
如图是自来水厂净化水的过程示意图。
(1)在自来水厂净化自来水的过程中,a池的作用主要是_______。
(填序号)
A沉淀
B过滤
C吸附
D蒸馏
(2)在处理过的水样中加入一定量的肥皂水并振荡,观察到泡沫较少,浮渣较多。
说明该水样属于_______(填“硬水”或“软水”)。
(3)在投药消毒步骤中所发生的变化是_______(填“物理变化”或“化学变化”)。
(4)水资源短缺会影响人民生活,制约经济发展。
请举出一种节水的措施_______。
四、推断题
14.有一种无色无味液体A,在通电的条件下分解产生两种气体B和C,已知铁丝可以在B中剧烈燃烧,火星四射,生成黑色固体物质D,C是自然界中最轻的气体,它在空气中燃烧生成A。
(1)写出C、D两种物质的化学式:
C_______;
D_______。
(2)写出下列反应的化学方程式,并指出它的基本反应类型。
①A反应生成B和C:
_______;
(______)
②铁丝和B反应生成D:
五、实验题
15.几位同学根据下列各实验装置图,设计和讨论了以下问题:
(1)上图中仪器名称:
①_______;
②_______;
(2)小超同学说:
“选择A与E或A与_______组合成装置并在试管口加一团棉花可制取氧气,其反应的化学方程式为_______;
(3)小文同学说:
若用过氧化氢制取氧气,则反应装置应选_______(填字母);
反应的化学方程式为_______,氧气可以用E装置收集,原因是_______,用该方法收集到的氧气不纯,可能的原因有_______(写出一条即可)。
(4)小东同学说:
“我看到课外资料上介绍“实验室可用块状硫化亚铁(FeS)与稀硫酸反应制取硫化氢气体(H2S),硫化氢气体密度比空气大,能溶于水形成氢硫酸”根据以上知识:
实验室制取硫化氢气体应选用的发生装置是_______,收集装置是_______。
(填字母)
六、科学探究题
16.小龙、小刚和小洁以“化学反应中,反应物和生成物的质量关系”为课题进行科学探究,请填写以下探究过程中的空格:
实验前,三人各自称出了装置的质量,实验前,小龙将锌和稀硫酸混合(会产生气体):
小刚点燃蜡烛后立即塞上瓶塞:
小洁将装置放入热水中一会儿拿出,实验后,他们都进行了准确的称量和细致的观察。
(实验结论)小龙认为:
在化学反应中生成物和反应物的质量总和不相等,小刚和小洁认为在化学反应中,生成物的总质量与反应物的总质量相等,以上三位同学只有_______的结论正确。
(结论分析)①请从微观角度解释,化学反应中质量守恒的原因是反应前后_______的种类和数目不变。
②请你分别谈谈导致其他两位同学结论错误的原因_______;
_______
(实验设计修改)请你帮忙完善实验装置的设计,使其中一位同学能得出正确的结论_______;
(反思与评价)在化学反应中还有两个一定改变,_______改变,_______改变。
七、计算题
17.【最新】4月6日,漳州PX项目发生爆炸并引起大火,PX项目又一次引起人们的热议。
己知PX是二甲苯(化学式为C8H10)的别称,请根据其化学式计算:
①PX中碳元素和氢元素的质量比是_______;
②PX中碳元素的质量分数_______(精确到0.1%);
18.用氯酸钾和二氧化锰的混合物50.0g加热制取氧气,待完全反应,冷却后称量得到30.8g固体。
试计算:
(1)完全反应后生成氧气的质量;
(2)原混合物中氯酸钾的质量。
参考答案
1.C
【分析】
没有新物质生成的变化是物理变化,有新物质生成的变化是化学变化。
【详解】
A、食品发霉的过程中生成了新物质,属于化学变化,故A不正确;
B、天然气燃烧产生蓝色火焰的变化过程中生成了水和二氧化碳等物质,属于化学变化,故B不正确;
C、水沸腾的变化过程中只是水的状态发生了改变,没有新物质生成,属于物理变化,故C正确;
D、菜刀生锈的变化过程中生成了新物质铁锈,属于化学变化,故D不正确。
故选C。
2.C
A.使用胶头滴管滴加少量液体的操作,注意胶头滴管的位置是否伸入到试管内或接触试管内壁;
应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误;
B.根据加热液体的量不能超过试管容积的1/3、加热时用酒精灯的外焰,图中所示操作错误;
C.用纸槽取用粉末状药品,试管要横放,操作正确;
D.取用液体时:
①试剂瓶瓶口要紧挨试管口,防止液体流出;
②标签向着手心,防止液体流出腐蚀标签;
③瓶塞倒放桌面上,防止污染瓶塞,从而污染药品,故错误;
3.A
A、质量守恒定律是化学反应普遍遵守的规律。
潮湿的衣服在阳光下晒干,是物理变化,不能用质量守恒定律解释,此选项符合题意;
B、蜡烛燃烧是化学变化,蜡烛越烧越短,原因是蜡烛是反应物,随着反应的进行,反应物的质量越来越少,此选项不符合题意;
C、铁丝燃烧是化学变化,铁丝燃烧后质量增加是因为铁丝与氧气发生了化学反应,参加反应的铁丝的质量加参加反应的氧气的质量等于生成物的质量,所以铁丝燃烧后质量增加,此选项不符合题意;
D、高锰酸钾受热发生分解反应,高锰酸钾是反应物,所以随着反应的进行,高锰酸钾的质量逐渐减少,此选项不符合题意。
故选A。
4.C
金刚石和石墨都是碳元素组成的单质,金刚石是天然产物中最硬的物质,石墨很软,它们的物理性质有很大的差异的原因是两种物质中碳原子的排列不同,故选C。
5.C
A.花青素中碳、氢、氧三种元素质量比为(12×
15):
(1×
11):
(16×
6),由元素质量比可知,花青素中氢元素质量最小,因此花青素中氢元素的质量分数最小,故A说法正确;
B.一个花青素分子由15个碳原子、11个氢原子和6个氧原子构成,则一个花青素分子中共有32个原子,故B说法正确;
C.花青素是由碳、氢、氧元素组成的有机化合物,而氧化物是由2种元素组成的化合物,其中有一种是氧元素,故C说法错误;
D.一个花青素分子由15个碳原子、11个氢原子和6个氧原子构成,花青素分子中碳、氢、氧原子个数比为15:
6,故D说法正确。
故选:
C。
6.B
【解析】
设亚硒酸钠中硒元素的化合价为x.
(+1)×
2+x+(-2)×
3=0
x=+4
故选B.
7.B
反应前有2C、8H、6N、8O,反应后(X除外)有8H、6N、4O,则2X中有2C、4O,X的化学式为CO2,故选B。
8.B
解:
24gA与6gB恰好完全反应生成12gC,则同时生成D的质量为:
24g+6g-12g=18g,即A与D的质量比为:
24g:
18g,若反应后要生成9gD,则参加反应的A的质量为12g。
故选B。
9.D
A、由同种元素组成的纯净物叫单质,图A中,一个分子是由2个相同原子构成,是同种分子,属于单质;
故选项错误;
B、由同种元素组成的纯净物叫单质,图B中,一个分子是由2个相同原子构成,是同种分子,属于单质;
C、混合物是由两种或两种以上的物质组成,图C是两种双原子分子,属于混合物;
D、图D是由两种元素组成的化合物,其中一种元素可能是氧元素,因此可能是氧化物;
故选项正确;
D。
10.D
由表中的数据可知,X的质量减少是反应物,参加反应的质量为:
10g-3.2g=6.8g;
W的质量增加是生成物,生成W的质量为3.2g。
由于Y的质量不变,6.8g>
3.2g,由质量守恒定律可知,Z是生成物,生成Z的质量为:
6.8g-3.2g=3.6g。
反应后Z的质量为90g+3.6g=93.6g。
该反应由一种物质生成了两种物质,属于分解反应。
由以上分析可知:
A、W是由X分解的产物,可能是单质,故A正确;
B、由于Y的值不变,可能是催化剂,故B正确;
C、该反应是分解反应,故C正确;
D、反应后Z物质的质量93.6g,故D错误。
11.2H4CO2NeAl2O3
(1)原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,2个氢原子可表示为:
2H;
(2)分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,4个二氧化碳分子表示为:
;
(3)氖气属于稀有气体单质,直接用元素符号表示其化学式Ne;
(4)地壳中含量最多的金属元素是铝元素,含量最多的非金属元素是氧元素,组成的化合物为氧化铝,化学式为:
(5)元素化合价的表示方法:
确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,五氧化二磷中磷元素的化合价为+5价,故表示为:
(3)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,3个亚铁离子表示为:
。
12.Mg3N2
本题为化学式和化学方程式的书写。
化学式书写依据是在化合物中元素化合价正负代数和为0。
书写化学方程式要分清反应物、反应条件、生成物;
要以科学实验事实和质量守恒定律为依据。
①氮化镁中氮元素显-3价,镁元素显+2价,则氮化镁的化学式为:
Mg3N2;
②镁在氧气中燃烧,生成氧化镁,化学反应方程式为:
③镁在二氧化碳中燃烧生成氧化镁和炭粒,反应方程式为:
13.B硬水化学变化淘米水浇花(合理即可给分)
(1)在自来水净化过程中,将絮凝剂沉淀后,应过滤,除去难溶性杂质,故a池的主要作用是过滤,故选B;
(2)通常用肥皂水来鉴别硬水和软水,肥皂水在硬水中易起浮渣,在软水中泡沫较多,在处理过的水样中加入一定量的肥皂水并振荡,观察到泡沫较少,浮渣较多,说明该水样属于硬水;
(3)在投药消毒步骤中,蛋白质发生了变性,有新物质生成,属于化学变化;
(4)节约用水,可采用“一水多用”的方法,如淘米水浇花,洗衣服水冲厕所等。
14.H2
分解反应
化合反应
由题目给出的信息可知:
无色无味液体A,在通电条件下分解产生两种气体B和C,则可知A是水,B和C是氢气与氧气,已知铁丝可以在B中剧烈燃烧,火星四射,生成一种黑色固体D可知,B为氧气;
D为四氧化三铁;
C是自然界中最轻的气体C则C为氢气。
铁丝可以在B中剧烈燃烧,火星四射,生成一种黑色固体D可知,B为氧气;
D为
C是自然界中最轻的气体,C为
无色无味液体A,在一定条件下可分解生成两种气体B和C,A为水。
(1)由以上分析可知C、D四种物质的化学式为
(2)A反应生成B和C的文字表达式为①水通电氢气+氧气,化学方程式为:
属于“一变多”特征的分解反应;
故答案为:
分解反应;
②铁丝和B反应生成D的文字表达式为:
铁+氧气点燃四氧化三铁,化学方程式为:
属于“多变一”特征的化合反应;
故答案为:
化合反应。
15.酒精灯试管G
BG/BE(写正确一个即可得分)
O2不易溶于水未等连续且均匀的气泡冒出时就开始收集(合理即可给分)BG
(1)根据常见仪器的名称进行解答;
(2)从氧气不易溶于水,所以可以用排水法收集,由于氧气的密度比空气大,所以可用向上排空气法收集;
选择A装置,是加热固体制取气体的装置,并在试管口加一团棉花可制取氧气,说明选择的药品是高锰酸钾去分析;
(3)从过氧化氢溶液和二氧化锰制取氧气,不需加热进行分析解答;
(4)从实验室可用块状硫化亚铁与稀硫酸反应制取硫化氢气体,由于反应是固体和液体反应且不需加热制取气体,硫化氢气体密度比空气大,能溶于水形成氢硫酸去分析。
(1)酒精灯是常用的加热仪器,试管常用作反应容器,故答案为:
酒精灯;
试管;
(2)由于氧气不易溶于水,所以可以用排水法收集,由于氧气的密度比空气大,所以可用向上排空气法收集;
选择A与G或E装置装置,并在试管口加一团棉花可制取氧气,说明选择的药品是高锰酸钾;
用加热高锰酸钾的方法制取氧气,在生成氧气的同时,还有锰酸钾和二氧化锰生成,其反应的化学方程式为:
,故答案为:
G;
(3)过氧化氢溶液和二氧化锰制取氧气,不需加热,,又因为氧气不易溶于水,可以用排水法收集,由于氧气的密度比空气大,可用向上排空气法收集,故选BG或BE;
化学方程式为:
因为氧气不易溶于水,可以用排水法收集,故选E装置;
一有气泡冒出时就开始收集或开始时集气瓶未装满水会导致收集的氧气不纯;
BG或BE;
氧气不易溶于水;
未等连续且均匀的气泡冒出时就开始收集;
(4)实验室可用块状硫化亚铁(
)与稀硫酸反应制取硫化氢气体(
),由于反应是固体和液体反应且不需加热制取气体,所以可选装置B;
硫化氢气体密度比空气大,所以可用向上排空气法收集,能溶于水形成氢硫酸,所以不能用排水法;
B;
G。
16.小刚原子该反应生成物中有气体,气体逸散到空气中,生成物的质量减少冰融化为水是物理变化,不适用于质量守恒定律。
将小龙设计的装置密封即可物质种类分子种类
本题考查的是有关质量守恒定律探究的问题,包括实验设计、分析、结论、评价等方面。
实验结论:
小龙的在实验在敞口容器内进行,产生的气体逸散,不能得出正确的结论;
小洁的实验是物理变化,质量守恒定律反应的是化学变化;
小刚的在密闭容器内进行,设计实验正确,故答案填:
小刚;
结论分析:
①化学反应的微观实质是分子分裂为原子,原子又重新组合,因此化学反应中质量守恒的原因是:
原子的生类和数目都不变,原子质量也不变,故答案填:
原子。
②小龙得出了错误结论的原因是:
实验在敞口容器内进行,镁和稀硫酸反应生成的氢气逸散到空气中,造成容器内物质质量减小;
小洁得出了错误结论的原因是:
质量守恒定律适用的是化学变化,小洁的实验中,冰融化是物理变化,不适用于质量守恒定律;
实验设计修改:
小龙的实验改在锥形瓶中进行,锥形瓶用单孔胶塞塞好,单孔胶塞上插入玻璃管,玻璃在空气中一端扎一气球,形成密闭装置。
但药品用量不易过多,过多产生氢气过多,气球膨胀太大,产生的浮力过大,会干扰实验。
反思与评价:
化学变化有新物质生成,所以物质种类肯定改变;
化学的变化的微观特征是分子分裂为原子,原子又重新组合成新分子,或直接构成新物质,因此,化学反应前后,一定改变的还有分子。
故答案填:
物质种类和分子种类。
【点睛】
在探究质量守恒定律时,为了保证实验的成功,在涉及到有气体参与或生成的反应时,一定要在密闭的容器内进行。
17.
(1)48:
5
(2)90.6%
①根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答;
②根据化合物中元素的质量分数的公式进行分析解答。
①PX中碳元素和氢元素的质量比=各原子的相对原子质量÷
原子个数之比
=(12×
8):
10)=48:
5
②根据相对分子质量为构成分子的各原子的相对原子质量之和,PX的相对分子质量为=12×
8+1×
10=106。
PX中碳元素的质量分数为=
答:
①PX中碳元素和氢元素的质量比是48:
5;
②PX中碳元素的质量分数90.6%。
18.
(1)19.2;
(2)解:
设原混合物中氯酸钾的质量为x
x=49g
原混合物中氯酸钾的质量为49g。
(1)根据质量守恒定律,化学反应前后,物质的总质量不变,故完全反应后,生成氧气的质量为50.0g-30.8g=19.2g;
(2)见答案。