普通化学第五版浙江大学课后习题答案docWord文档下载推荐.docx
《普通化学第五版浙江大学课后习题答案docWord文档下载推荐.docx》由会员分享,可在线阅读,更多相关《普通化学第五版浙江大学课后习题答案docWord文档下载推荐.docx(46页珍藏版)》请在冰豆网上搜索。
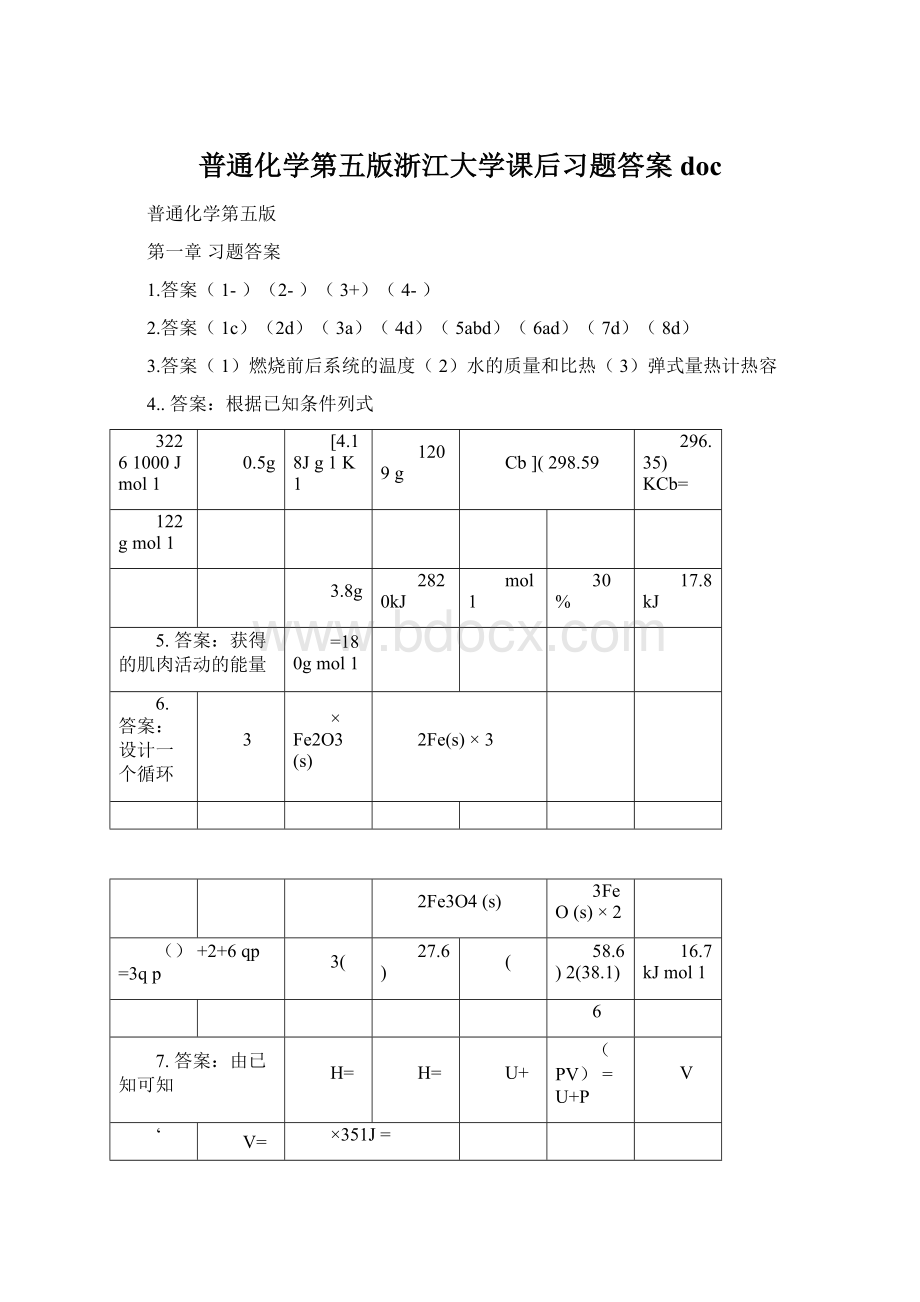
T=
351J=
w=-P
U=H-P
V=下列以应(或过程)的
qp与qv有区别吗简单说明。
(1)NH4HS的分解
25℃
NH4HS(s)NH3(g)+H2S(g)
(2)生成的HCl
H2(g)+Cl2(g)252HCl(g)℃
(3)molCO2(s)(干冰)的升华
-78℃
CO2(s)CO2(g)
(4)沉淀出AgCl(s)
+NaNO(aq)
AgNO(aq)+NaCl(aq)AgCl(s)
9.答案:
U-H=-(PV)=-ngRT(
ng为反应发生变化时气体物质的量的变化)
(1)U-H=-2×
(2-0)×
1000=-
(2)U-H=-2×
(2-2)×
R×
T=0
(3)U-H=-5×
(1-0)×
/1000=
(4)U-H=-2×
(0-0)×
10.
(1)4NH(g)+3O
2
(g)=2N
(g)+6HO(l)
答案
(2)C2H2(g)+H2(g)=C2H4(g)
(3)NH3(g)+稀盐酸
写出离子反应式。
产
+
物是NH(aq)
4
(4)Fe(s)+CuSO
4(aq)答案
答案查表
fHm(298.15K)/
rHm(298.15K)=+4×
-(=rUm(298.15K)
rHm(298.15K))=+)
=体积功w=-P
V=-(4-5)RT=
12.答案
正辛烷的M=114.224g.mol-1
=114.224g.mol
-1=.
正辛烷完全燃烧的反应式
CH(l)+(g)=8CO
(g)+9H
O(l)(注意燃烧反应方程式的计量系数
要求CH
前是1,
这样
△rHθ
818
m与才
能对应起来)
△rHθm≈=+RT
=
-5459+×
×
10-3
=-5470kJ.mol
-1
13.答案CaCO3的煅烧反应为
CaCO3(s)=CaO(s)+CO
2(g)
△fHθm/
估算1mol反应的△H=
-+(+(=
煅烧1000kg石灰石△H=[
]
1000×
103g=×
104kJ
标准煤的热值为
消耗标准煤
104kJ/[
]=60.8kg
14.答案燃烧反应
C
H
+5/2O
=2CO
+H
O(l)
△fHθm/
(1)
反应热Q=
(2)
反应热Q=26
2H4
+3O2=2CO2+2H2O(l)
28
反应热Q=28
根据计算结果乙烯
(CH)完全燃烧会放出热量更多
15.
答
rHm(298.15K)
=-2×
()-16×
0-3×
()+4×
+11×
+3×
(注意数据抄写要正确
符号不要丢)
16.答:
1mol反应进度qp与qV之差别qp-qV=
B(g)RT=(1-3)×
1000
q=
定压条件下放热更多些
.原因是该反应是气体分子数减小的反应
在温度一定时,定压条件下环境对反应
p
系统做功,这部分能量转化成反应系统的燃烧热.
17.答:
(要明确已知燃烧热数据和要求的值各对应的是哪个反应的焓变
再根据盖斯定律运算求解)C+O
=CO
+1/2O=HO
CH4(g)+2O(g)=CO2(g)+2H20
CH=
根据反应焓变和标准生成焓的关系
(或根据已知条件设计一个循环
)存在以下关系
=+2-
(CH4)
(CH4)=
fHm
18.答:
(有机化学中
一个定域C=C上的加氢反应焓变即氢化焓
离域焓是指当分子中存在多个
C=C其氢化焓的
观测值与一个定域
C=C氢化焓乘以双键个数的差值
.共轭双键的离域作用是分子变的稳定)
苯的离域焓=(-120)
3-(-208)=-152
(苯中共轭作用使其能量比三个定域
C=C降低了152
第2章化学反应的基本原理与大气污染
1.答案(1-)(2-)(3-)(4-)(5-)(6+)(7+)(8+)
2.答案1b2b3b4c5bcd6a
3.
(1)答案:
基本不变,基本不变,增大
减小,增大增大
k(正)
k(逆)
v(正)
v(逆)
K
平衡移动方向
增加总压力
不变
增大
逆向移动
升高温度
正向移动
加催化剂
不移动
(3)答案:
氟里昂,NOX、HCl;
CO2;
NOX和SO2
3.答案:
(d)>
(c)>
(e)>
(a)>
(b)原因是气体熵>
液体>
固体分子量大的熵大
5.
(1)溶解少量食盐于水中。
答案:
正
(2)活性炭表面吸附氧气。
负
(1)碳与氧气反应生成一氧化碳。
由定义可知Fe2O3的fGm(298.15K)742.2kJ.mol1
rGm(298.15K)77.7kJ.mol1=3fGm(298.15K,Fe3O4)-4fGm(298.15K,Fe2O3)
fGm(298.15K,Fe3O4)=1[+4]=答案:
查表水的fGm(298.15K)237.129kJ.mol1
过程的rGm(298.15K)(236.7)(237.129)0.429kJ.mol1>
所以在的标准态时不能自发进行.
8.(查表时注意状态,计算时注意乘系数)
(1)
()4
O
)
s
)4
2(
g
Fes
l
Fe
(2)
()
aq
Zn
H2
Zns
(3)CaO(s)
H2O(l)
Ca2
(aq)
2OH(aq)
(4)AgBr(s)
Ag(s)
1
Br2(l)
(1)SnO
=Sn+O
(2)SnO
Sm(298.15K)
2×
J.mol1.K1
fHm(298.15K)
kJ.mol
rSm(298.15K)
(3)
J.mol
1.K
rHm(298.15K)
kJ.mol1
Tc>
rHm(298.15K)
(1)2841K
903K
rSm(298.15K)
rGm(298.15K)
J.mol1.K1
+C=Sn+CO
(3)SnO
+2H
=Sn+2H
O(g)
2×
(3)840K(温度最低,合适)
rSm(298.15K)
10.答案:
C12H22O11(s)+12O2(g)=12CO2(g)+11H2O(l)rSm(298.15K)
Sm(298.15K)=11×
+12
fHm(298.15K)
rGm(273.1537K)
rGm(298.15K)温度对反应的标准吉布斯函数变有影响
但由于该反应的
熵变相对于焓变小(绝对值),故变化不大)
做的非体积功=kJ
11.答案:
查表Sm(298.15K)
rSm(298.15K)=
fHm(298.15K)
rGm(523K)
rHm(298.15K)
rSm(298.15K)()-523K×
(÷
1000)=
lnK
(523K)
rGm(523K)
93.85)
1000
21.58
R
523K
8.314523
e21,58
1021.58/2.303
109.37
2.35
109
12.答案:
设平衡时有
2Xmol的SO转化
2SO
(g)+O(g)=2SO(g)
起始n/mol
8
n
(始)=12mol
平衡时n/mol
8-2x
4-x
2x
(平衡)=(12-x)mol
根据PV=nRTTV一定时
n(始)
P(始)
12
300
2x=
n(平衡)
P(平衡)
x
220
(peq(SO3))2
(6.4220)2
SO2的转化率
=8=80%
8.8
100
eq
1.6
0.8
(p(SO2))2
(p(O2))
(6.4)2
80
注意在计算时可不用先计算分压
列综合算式更方便计算)
13.答案:
该反应是可逆反应,需要
H2的量包括反应需要的量
1mol和为维持平衡需要xmol(最少量)
peq(H2S)
peq(H2S)
neq(H2S)
1.0
x=
(p(H2))
p(H2)
n(H
2)
需要H2的量=1+=(注:
该反应是反应前后气体分子数不变的
在标准平衡常数表达式中系统的总压和标准压力
在计算时可以在分式中消去
否则在计算时必须知道平衡时总压才能根据平衡常数计算
.)
14.在不同温度时反应的标准平衡常数值如下:
T/K
K1
K2
973
1073
1173
1273
答:
反应3的标准平衡常数
K3
K1
(如上)
(因为随温度的升高平衡常数增大
故是吸热反应)
15.答案:
利用公式lnK2
rHm(298,15K)(T2
T1)求K2
RT1
T2
92.31
1000(500
298.15)
K2=e
15.03
4.9
10
16
代入数据ln
1016
8.314
298.15
500
=×
16.答案:
查数据计算
CO2(g)
H2(g)
CO(g)
H2O(g)
rGm(873K)
(873K)
4.434
RT
873
e0.61
0.54
(p(CO)/p)(p(H2O)/p
76
Q
(p(CO2)/p
)(p(H2)/p
)=127
127=
(Q<
所以反应正向进行)
rGm
rGm(873K)
RTlnQ
873ln=
因为rGm<
所以此条件下反应正向进行
17.答案:
吕·
查德里原理判断是正确的。
判断反应的方向或平衡移动的方向的依据是
rGm(TK)<
温度对平衡常数的影响有两个公式
:
Hm
rSm
T
R
(1)
适用于某一给定反应温度对
K0的影响。
lnK(TK)
rGm(TK)
(2)适用于温度一定的前提下不同反应比较,
18.研究指出下列反应在一定温度范围内为元反应:
2NO(g)+Cl2(g)
G(TK)0
rm越正K越小。
(1)写出该反应的速率方程。
(因为是元反应,可根据反应式直接写出)
kc(2NO)c(Cl2)
(2)该反应的总级数是多少
(n=2+1=3
级)
(3)其他条件不变,如果将容器的体积增大到原来的
2倍,反应速率如何变化
(体积增大后浓度各变为原来的
'
k(1c
(NO))2(1c(Cl2))
速率变为原来的1/8
1/2
(4)如果容器体积不变而将NO的浓度增大到原来的
k(3c(NO))2(c(Cl2))9
3倍,反应速率又将怎样变化(
速率变为原来的9倍)
ln
c0
kt