初三化学必背基础知识Word下载.docx
《初三化学必背基础知识Word下载.docx》由会员分享,可在线阅读,更多相关《初三化学必背基础知识Word下载.docx(10页珍藏版)》请在冰豆网上搜索。
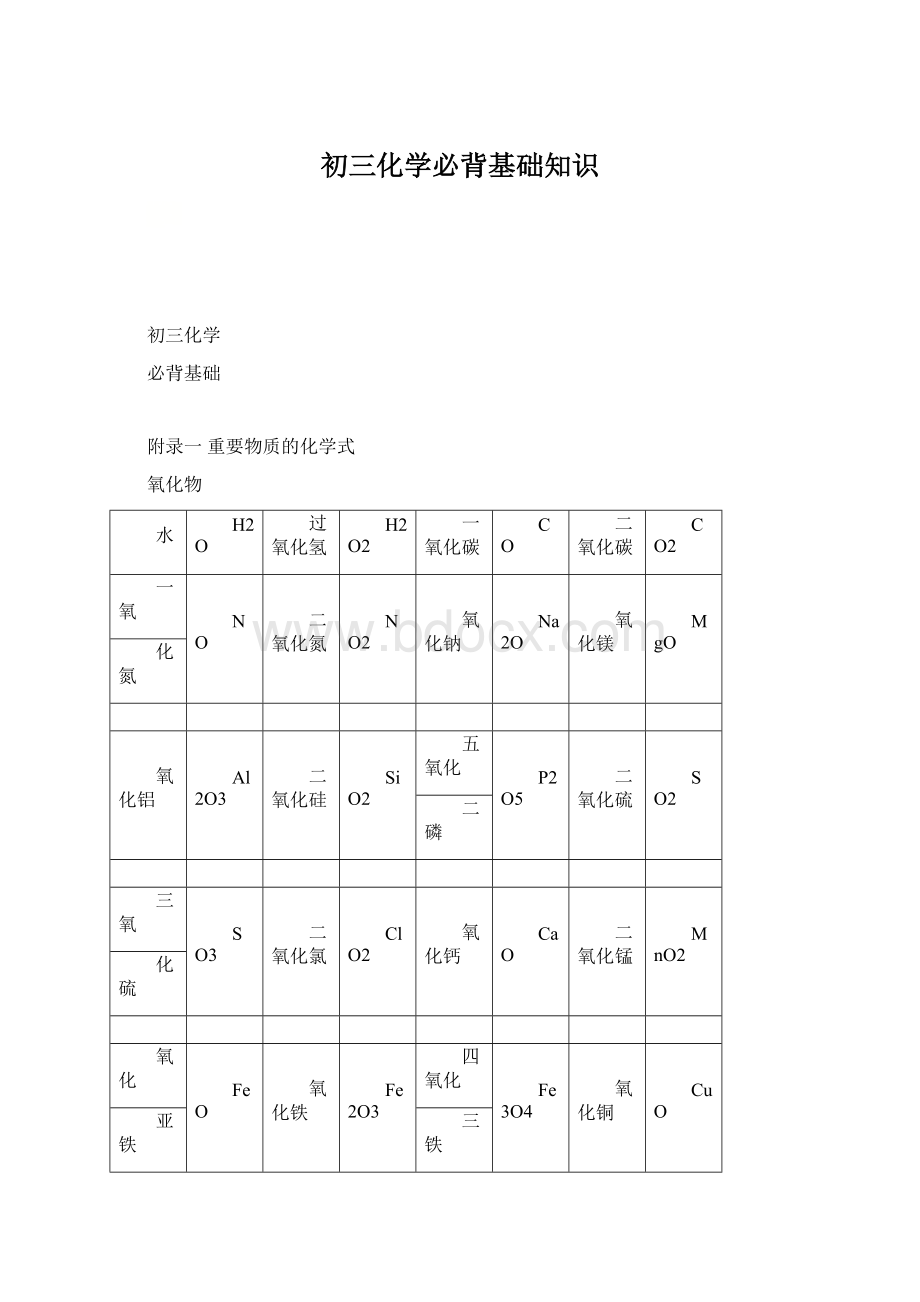
CaO
二氧化锰
MnO2
化硫
氧化
FeO
氧化铁
Fe2O3
四氧化
Fe3O4
氧化铜
CuO
亚铁
三铁
氧化银
Ag2O
氧化汞
HgO
一氧化
N2O
二氮
有机物
甲烷
CH4
乙醇
C2H5OH
乙酸
CH3COOH
淀粉
(酒精)
(醋酸)
葡萄糖
蔗糖
尿素
CO(NH2)2
(C6H10O5)n
其他:
氨气NH3
附录二常见物质的俗名
名称
俗名
化学式
碳酸钠
苏打、纯
Na2CO3
生石
碱
灰
天然碱—石
Na2CO3·
固体二氧
干冰
晶体
碱—口碱
10H2O
化碳
碳酸氢钠
小苏打
NaHCO3
水煤
CO和H2
和氢气
气
烧碱、火
硫酸铜晶
胆矾、
CuSO4·
5H2O
氢氧化钠
碱、苛性
NaOH
体
蓝矾
钠
氢氧化钙
熟石灰
Ca(OH)2
沼气
附录三重要的化学方程式
化合反应:
☞铁丝在氧气中燃烧:
3Fe+2O2
Fe3O4用生石灰制取熟石灰:
CaO+H2O===Ca(OH)2
☞铝在氧气中燃烧:
4Al+3O2
2Al2O3一氧化碳燃烧:
2CO+O2
2CO2
☞铝不易生锈的原因:
4Al+3O2===2Al2O3变浑浊的石灰水又变澄清:
CaCO3+CO2+H2O===Ca(HCO3)2
☞镁在空气中燃烧:
2Mg+O2
2MgO
☞铜在空气中加热:
2Cu+O2
2CuO
☞氢气在氧气中燃烧:
2H2+O2
2H2O
☞将CO2变成CO:
C+CO2
2CO
分解反应:
☞电解水生成氢气和氧气:
2H2↑+O2↑
☞工业制取生石灰和CO2的反应原理:
CaCO3
CaO+CO2↑
☞干粉灭火器的反应原理(碳酸氢钠受热分解):
2NaHCO3
Na2CO3+H2O+CO2↑
☞碱式碳酸铜受热分解:
Cu2(OH)2CO3
2CuO+H2O+CO2↑
☞过氧化氢溶液不稳定,发生分解:
2H2O2===2H2O+O2↑
☞碳酸不稳定,分解成水和二氧化碳:
H2CO3===H2O+CO2↑
☞碳铵(碳酸氢铵)“消失”并发出刺激性气味:
NH4HCO3===NH3↑+CO2↑+H2O
☞石笋、钟乳石的形成过程:
CaCO3+CO2+H2O===Ca(HCO3)2Ca(HCO3)2===CaCO3↓+CO2↑+H2O
置换反应:
☞氢气还原氧化铜:
H2+CuO
Cu+H2O
☞木炭还原氧化铜:
C+2CuO
2Cu+CO2↑
☞木炭还原氧化铁:
3C+2Fe2O3
4Fe+3CO2↑
☞水煤气的形成:
C+H2O
H2+CO(注意没有气体生成符号↑)
☞实验室制取氢气的反应原理:
Zn+H2SO4===ZnSO4+H2↑
☞金属与稀盐酸的反应:
2X+2HCl===2XCl+H2↑(X是+1价的金属,包括K、Na)
X+2HCl===XCl2+H2↑(X是+2价的金属,包括Ca、Mg、Zn、Fe)
2Al+6HCl===AlCl3+3H2↑
☞金属与稀硫酸的反应:
2X+H2SO4===X2SO4+H2↑(X是+1价的金属,包括K、Na)
X+H2SO4===XSO4+H2↑(X是+2价的金属,包括Ca、Mg、Zn、Fe)
2Al+3H2SO4===Al2(SO4)3+3H2↑
☞金属与盐溶液的反应:
(1)镁
3Mg+2AlCl3===3MgCl2+2Al 3Mg+Al2(SO4)3===3MgSO4+2Al 3Mg+2Al(NO3)3===3Mg(NO3)2+2Al
Mg+XCl2===MgCl2+X(X是+2价的金属,包括Zn、Fe、Cu)
Mg+XSO4===MgSO4+X(X是+2价的金属,包括Zn、Fe、Cu)
Mg+X(NO3)2===Mg(NO3)2+X(X是+2价的金属,包括Zn、Fe、Cu)
Mg+2AgNO3===Mg(NO3)2+2Ag
(2)铝
2Al+3XCl2===2AlCl3+3X(X是+2价的金属,包括Zn、Fe、Cu)
2Al+3XSO4===Al2(SO4)3+3X(X是+2价的金属,包括Zn、Fe、Cu)
2Al+3X(NO3)2===2Al(NO3)3+3X(X是+2价的金属,包括Zn、Fe、Cu)
Al+3AgNO3===Al(NO3)3+3Ag
(3)锌
Zn+XCl2===ZnCl2+X(X是+2价的金属,包括Fe、Cu)
Zn+XSO4===ZnSO4+X(X是+2价的金属,包括Fe、Cu)
Zn+X(NO3)2===Zn(NO3)2+X(X是+2价的金属,包括Fe、Cu)
Zn+2AgNO3===Zn(NO3)2+2Ag
(4)铁
Fe+CuCl2===FeCl2+CuFe+CuSO4===FeSO4+Cu
Fe+Cu(NO3)3===Fe(NO3)3+CuFe+2AgNO3===Fe(NO3)2+2Ag
(5)铜:
Cu+2AgNO3===Cu(NO3)2+2Ag
复分解反应:
☞NaOH溶液与稀盐酸反应:
NaOH+HCl===NaCl+H2O
☞NaOH溶液与稀硫酸反应:
2NaOH+H2SO4===Na2SO4+2H2O
☞Ba(OH)2溶液与稀硫酸反应:
Ba(OH)2+H2SO4===BaSO4↓+2H2O
☞用胃舒平(氢氧化铝)中和过多的胃酸:
Al(OH)3+3HCl===AlCl3+3H2O
☞用氢氧化镁中和过多的胃酸:
Mg(OH)2+2HCl===MgCl2+2H2O
☞用熟石灰中和含有硫酸的污水:
Ca(OH)2+H2SO4===CaSO4+2H2O
☞稀盐酸除铁锈:
Fe2O3+6HCl===2FeCl3+3H2O
☞稀盐酸与氧化铜反应:
CuO+2HCl===CuCl2+H2O
☞稀硫酸与氧化铜反应(制取CuSO4):
CuO+H2SO4===CuSO4+H2O(注意:
CaO、Na2O、K2O、BaO可以都直接和酸反应。
)
☞实验室制取CO2的反应原理:
CaCO3+2HCl===CaCl2+H2O+CO2↑
☞盐酸与水垢中的主要成分发生反应:
☞实验室不用大理石和稀硫酸制CO2的原因:
CaCO3+H2SO4===CaSO4+H2O+CO2↑(CaSO4微溶)
☞泡沫灭火器的反应原理:
Na2CO3+2HCl===2NaCl+H2O+CO2↑
☞误食碳酸钡后发生中毒的原因:
BaCO3+2HCl===BaCl2+H2O+CO2↑
☞用小苏打治疗胃酸过多:
NaHCO3+HCl===NaCl+H2O+CO2↑
☞硝酸银溶液与稀盐酸:
AgNO3+HCl===HNO3+AgCl↓
☞钡盐与稀硫酸:
Ba(NO3)2+H2SO4===2HNO3+BaSO4↓
BaCl2+H2SO4===2HCl+BaSO4↓
BaCO3+H2SO4===BaSO4↓+H2O+CO2↑
☞工业制取烧碱:
Ca(OH)2+Na2CO3===2NaOH+CaCO3↓
☞氯化铵与氢氧化钠溶液反应:
NH4Cl+NaOH===NaCl+NH3↑+H2O
☞硫酸铵与氢氧化钠溶液反应:
(NH4)2SO4+2NaOH===Na2SO4+2NH3↑+2H2O
☞将熟石灰与氯化铵两种固体一起研磨,闻到刺激性气味:
2NH4Cl+Ca(OH)2===CaCl2+2NH3↑+2H2O
☞将熟石灰与硫酸铵两种固体一起研磨,闻到刺激性气味:
(NH4)2SO4+Ca(OH)2===CaSO4+2NH3↑+2H2O
☞生成蓝色沉淀的反应:
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4(参加反应的碱只能是四大强碱:
☞配制波尔多液时发生的反应:
CuSO4+Ca(OH)2===CaSO4+Cu(OH)2↓
☞误食BaCO3或BaCl2发生中毒之后,服用泻盐(MgSO4)解毒:
BaCl2+MgSO4===MgCl2+BaSO4↓
☞其他常见的反应:
NaCl+AgNO3===NaNO3+AgCl↓
CaCl2+Na2CO3===2NaCl+CaCO3↓[CaCl2可以换成Ca(NO3)2,Na2CO3可以换成K2CO3]
BaCl2+Na2CO3===2NaCl+BaCO3↓[BaCl2可以换成Ba(NO3)2,Na2CO3可以换成K2CO3]
BaCl2+Na2SO4===2NaCl+BaSO4↓[BaCl2可以换成Ba(NO3)2,Na2SO4可以换成K2SO4]
探究拓展:
☞证明NaOH变质的三种方法:
Na2CO3+2HCl===2NaCl+H2O+CO2↑ Na2CO3+Ca(OH)2===2NaOH+CaCO3↓
Na2CO3+CaCl2===2NaCl+CaCO3↓ Na2CO3+Ca(NO3)2===2NaNO3+CaCO3↓
☞证明NaOH部分变质
方法:
(先用下面的方法除去Na2CO3,然后向溶液中滴加酚酞,如果溶液变红说明NaOH部分变质):
☞证明Ca(OH)2变质的方法:
CaCO3+2HCl===CaCl2+H2O+CO2↑
☞证明Ca(OH)2部分变质的方法(取两份相同的样品,分别按以下方法做):
证明Ca(OH)2变质:
证明还有Ca(OH)2存在:
Ca(OH)2+2NH4Cl===CaCl2+2H2O+2NH3↑
☞证明CaO部分编制的方法(取三份相同的样品,分别按以下方法做):
证明CaO仍然存在:
证明CaCO3的存在:
CaCO3+2HCl===CaCl2+H2O+CO2↑
证明Ca(OH)2的存在:
Ca(OH)2+2NH4Cl===CaCl2+2H2O+2NH3↑
非基本类型;
☞一氧化碳还原氧化铜(检验一氧化碳):
CO+CuO
Cu+CO2
☞一氧化碳还原氧化铁(用赤铁矿炼铁、高炉炼铁的反应原理):
3CO+Fe2O3
2Fe+3CO2
☞一氧化碳还原氧化亚铁:
CO+FeO
Fe+CO2
☞一氧化碳还原四氧化三铁(用磁铁矿炼铁):
4CO+Fe3O4
3Fe+4CO2
☞甲烷充分燃烧:
CH4+2O2
CO2+2H2O
☞乙醇充分燃烧:
C2H5OH+3O2
2CO2+3H2O
☞二氧化碳使澄清的石灰水变浑浊[Ca(OH)2固体变质的原因]:
Ca(OH)2+CO2===CaCO3↓+H2O
☞用NaOH溶液吸收CO2(NaOH固体变质的原因):
2NaOH+CO2===Na2CO3+H2O
☞用NaOH溶液吸收SO2:
2NaOH+SO2===Na2SO3+H2O
☞NaOH溶液与SO3反应:
2NaOH+SO3===Na2SO4+H2O
☞葡萄糖的缓慢氧化:
附录四常见物质的颜色、气味
固体
☞红色:
红磷(P)、铜(Cu)、氧化铁(Fe2O3)、氧化汞(HgO)
☞红褐色:
氢氧化铁[Fe(OH)3]
☞黄色:
金(Au)、硫(S)
☞绿色:
碱式碳酸铜[Cu2(OH)2CO3]
☞紫黑色:
高锰酸钾晶体(KMnO4)
☞淡蓝色:
固态氧(O2)
☞蓝色:
氢氧化铜[Cu(OH)2]、硫酸铜晶体[CuSO4·
5H2O]
☞银白色:
大多数金属[铁(Fe)、银(Ag)、铝(Al)、锌(Zn)、镁(Mg)……]
☞黑色:
木炭(C)、铁粉(Fe)、氧化铜(CuO)、二氧化锰(MnO2)、四氧化三铁(Fe3O4)、氧化亚铁(FeO)等
☞深灰色:
石墨(C)
☞灰白色:
大多数磷肥
☞无色:
金刚石(C)、干冰(CO2)、冰(H2O)
☞白色:
除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的。
☞有刺激性气味的固体:
碳酸氢铵(NH4HCO3)
液体
液态氧(O2)
含有Cu2+的溶液
☞浅绿色:
含有Fe2+的溶液
含有Fe3+的溶液
汞Hg
☞我们学过的大多数液体都是无色的。
☞有特殊气味的液体:
乙醇(C2H5OH)
☞有刺激性气味的液体:
醋酸(CH3COOH)
气体
☞红棕色气体:
二氧化氮(NO2)
☞有毒的气体:
一氧化碳(CO)、氯化氢(HCl)、氨气(NH3)、二氧化硫(SO2)、二氧化氮(NO2)等
☞有刺激性气味的气体:
氯化氢(HCl)、氨气(NH3)、二氧化硫(SO2)、二氧化氮(NO2)等
☞我们学过的大多数气体都是无色无味的。
☞计入空气污染指数的项目:
二氧化硫(SO2)、一氧化碳(CO)、二氧化氮(NO2)、可吸入颗粒物和臭氧(O3)等
☞能产生温室效应的气体:
二氧化碳(CO2)、臭氧(O3)、甲烷(CH4)、氟氯代烷
附录五化合价口诀
一价氢氯钾钠银,二价氧钙钡镁锌
三铝四硅五氮磷,二三铁,二四碳,
二四六硫都齐全,铜汞二价最常见,
单质为零要记清。
负一氢氧硝酸根,负二碳酸硫酸根,
正一价的是铵根。
附录六金属活动性口诀
钾钙钠镁铝(捡个大美女)
锌铁锡铅氢(身体细纤轻)
铜汞银铂金(总共一百斤)
附录七溶解性口诀
钾钠铵硝皆易溶,氯化物不溶银亚汞
硫酸盐不溶钡和铅,碳磷酸盐多不溶
多数酸溶碱少溶,只有钾钠铵钡溶