学年北京高三化学一轮复习 物质的分离与提纯检验与鉴别分类训练Word文档格式.docx
《学年北京高三化学一轮复习 物质的分离与提纯检验与鉴别分类训练Word文档格式.docx》由会员分享,可在线阅读,更多相关《学年北京高三化学一轮复习 物质的分离与提纯检验与鉴别分类训练Word文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
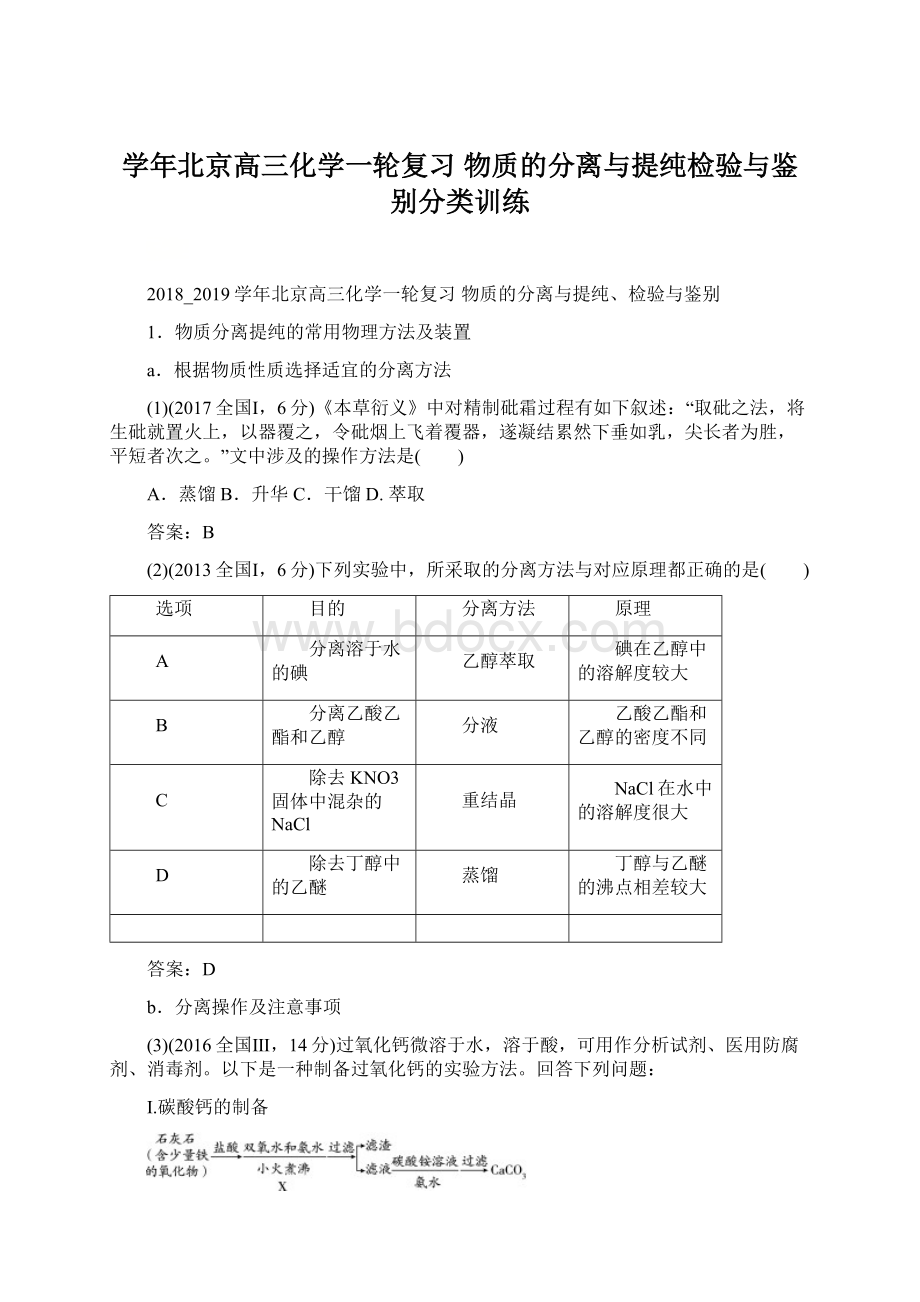
NaCl在水中的溶解度很大
D
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
b.分离操作及注意事项
(3)(2016全国Ⅲ,14分)过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。
以下是一种制备过氧化钙的实验方法。
回答下列问题:
Ⅰ.碳酸钙的制备
①步骤X加入氨水的目的是____________________________________________________。
小火煮沸的作用是使沉淀颗粒长大,有利于____________。
②如图是某学生的过滤操作示意图,其操作不规范的是__________(填标号)。
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
Ⅱ.过氧化钙的制备
CaCO3
滤液
白色晶体
③步骤Y的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈__________性(填“酸”、“碱”或“中”)。
将溶液煮沸,趁热过滤。
将溶液煮沸的作用是________
_________________________________。
④步骤Z中反应的化学方程式为___________________________________________________,
该反应需要在冰浴下进行,原因是________________________________________________。
⑤将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是________________________________________________________________________。
⑥制备过氧化钙的另一种方法是:
将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。
该工艺方法的优点是______________________,产品的缺点是________________。
①调节溶液pH使Fe(OH)3沉淀(1分) 过滤分离(1分) ②ade(3分) ③酸(1分) 除去溶液中的CO2(1分)④CaCl2+2NH3·
H2O+H2O2+6H2O
CaO2·
8H2O↓+2NH4Cl(或CaCl2+2NH3·
H2O+H2O2
CaO2↓+2NH4Cl+2H2O)(2分) 温度过高时双氧水易分解(1分) ⑤去除结晶表面水分(2分) ⑥工艺简单、操作方便(1分) 纯度较低(1分)
c.分离提纯装置图的判断
(4)(2016北京理综,6分)下列中草药煎制步骤中,属于过滤操作的是( )
A.冷水浸泡 B.加热煎制 C.箅渣取液 D.灌装保存
解析:
冷水浸泡属于物质的溶解,故A项错误。
加热煎制属于加热操作,故B项错误。
箅渣取液属于过滤操作,故C项正确。
灌装保存属于液体的转移,故D项错误。
(5)(经典题,6分)下列实验中,所选装置不合理的是( )
A.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤
D.粗盐提纯,选①和②
d.结晶法从溶液中分离溶质的几种情况
(6)(2018汇编,9分)①从含有少量KNO3杂质的氯化钠溶液中分离出氯化钠的操作:
_________________________________________________________________、洗涤、干燥。
②从MgSO4溶液中得到MgSO4固体的实验操作包括__________、冷却结晶、__________、洗涤、干燥等一系列操作。
③能不能直接蒸发CuCl2溶液结晶得到CuCl2·
2H2O晶体?
_________(填“能”与“不能”)。
若能,不用回答;
若不能,回答该如何操作?
__________________________________________。
④硫酸铝和硫酸铵的混合液经蒸发浓缩至溶液表面刚出现薄层晶体时即停止加热,然后冷却结晶,得到铵明矾晶体,其化学式为NH4Al(SO4)2·
12H2O。
溶液不能蒸干的原因是________________________________________________________________________。
①加热至有大量晶体析出时,趁热过滤(2分)②蒸发浓缩(1分) 过滤(1分) ③不能(1分) 在氯化氢气流中加热、蒸发、结晶(2分) ④防止晶体失去结晶水,也防止可溶物杂质析出(2分)
2.分离提纯装置的创新与拓展
(7)(2016浙江理综,15分)无水MgBr2可用作催化剂。
实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示,主要步骤如下:
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;
装置B中加入15mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:
ⅰ.Mg和Br2反应剧烈放热;
MgBr2具有强吸水性。
ⅱ.MgBr2+3C2H5OC2H5
MgBr2·
3C2H5OC2H5
请回答:
①仪器A的名称是__________。
实验中不能用干燥空气代替干燥N2,原因是________________________________________________________________________。
②如将装置B改为装置C,可能会导致的后果是______________________________________
________________________________________________________________________。
③步骤3中,第一次过滤除去的物质是__________。
④有关步骤4的说法,正确的是__________。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
⑤为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++Y4-===MgY2-
a.滴定前润洗滴定管的操作方法是________________________________________________。
b.测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·
L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是__________(以质量分数表示)。
①干燥管(2分) 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应(2分) ②会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患(2分) ③镁屑(2分) ④BD(2分) ⑤a.从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2~3次(2分) b.97.5%(3分)
3.物质分离提纯的化学方法的选择
(8)(经典题,6分)用如图所示的实验装置,选择适当的试剂B并进行如下实验,可以达到目的的是( )
A.试剂B为浓硫酸,除去CO2中混有的少量SO2气体
B.试剂B为饱和食盐水,除去氯气中混有的少量氯化氢气体
C.试剂B为水,收集NO、CO等难溶于水的气体
D.试剂B为澄清石灰水,除去氯化氢中少量的二氧化碳气体
b.物质分离提纯实验方案的设计
(9)(2017天津理综,6分)以下实验设计能达到实验目的的是( )
实验目的
实验设计
除去NaHCO3固体中的Na2CO3
将固体加热至恒重
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
鉴别NaBr和KI溶液
分别加新制氯水后,用CCl4萃取
4.利用特殊现象和典型反应进行物质鉴别和推断
a.溶液中离子的检验
(10)(经典题,9分)某无色透明溶液中可能含有下列离子中的若干种:
K+、Mg2+、Al3+、Fe2+、Ba2+、NH
、NO
、SO
、I-、Cl-、H+。
分别取一定量该溶液进行如下实验:
(ⅰ)将溶液滴在pH纸上,试纸呈红色。
(ⅱ)取100mL溶液加入足量铜片,收集到22.4mL(标准状况下)无色气体,该无色气体遇到空气后立即变成红棕色,最终测得溶液pH=7。
若再向该反应混合物中加稀硫酸,无气体产生。
(ⅲ)取100mL溶液滴入足量氯化钡溶液,产生0.233g白色沉淀。
(ⅳ)取实验(ⅲ)中溶液过滤,得到澄清溶液,向其中滴入足量硝酸银溶液,生成不溶于稀硝酸的白色沉淀。
(ⅴ)取100mL溶液逐滴滴入0.1mol·
L-1的氢氧化钠溶液,滴入氢氧化钠溶液过程中生成沉淀的物质的量与氢氧化钠溶液体积的关系如图所示:
(ⅵ)取100mL溶液进行焰色反应,透过蓝色钴玻璃观察不到紫色火焰。
①溶液中一定不含的离子有_________________________________。
②溶液中一定含有的离子物质的量浓度分别为_________________________。
③写出实验(ⅱ)中生成无色气体的离子方程式:
______________________________________。
①K+、Fe2+、Ba2+、I-(3分) ②c(NH
)=0.02mol/L;
c(H+)=0.04mol/L;
c(Al3+)=0.01mol/L;
c(Mg2+)=0.01mol/L;
c(NO
)=0.01mol/L;
c(SO
)=0.01mol/L;
c(Cl-)=0.08mol/L(4分) ③3Cu+2NO
+8H+===3Cu2++2NO↑+4H2O(2分)
b.气体的检验
(11)(经典题,12分)某研究性学习小组对过量碳粉与氧化铁反应的气体产物成分进行研究。
【提出假设】
①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是____________。
【设计方案】
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量碳粉完全反应,测定参加反应的碳元素与氧元素的质量比。
【查阅资料】
氮气不与碳、氧化铁发生反应。
实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式:
______________________________
_________________。
【实验步骤】
①按如图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。
冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为_________________________________________
【数据处理】
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
【实验优化】
学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:
应将澄清石灰水换成Ba(OH)2溶液,其理由是______________________
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善________________________________________________________________________。
【提出假设】③CO2、CO的混合物(2分)
【查阅资料】NH
+NO
N2↑+2H2O(2分)
【实验步骤】步骤②中是为了排尽空气;
步骤④是为了赶出所有的CO2,确保CO2被完全吸收(2分)
【数据处理】2C+Fe2O3
2Fe+CO↑+CO2↑(2分)
【实验优化】①氢氧化钡的溶解度大,浓度大,使二氧化碳被吸收的更完全,且M(BaCO3)>M(CaCO3),称量时相对误差小(2分) ②在尾气出口处加一燃着的酒精灯(或增加一尾气处理装置)(2分)
【提出假设】根据极端假设可知还有一种情况就是两者的混合物,即CO2、CO的混合物。
【查阅资料】用氯化铵饱和溶液与亚硝酸钠(NaNO2)饱和溶液制氮气,反应的离子方程式为NH
N2↑+2H2O。
【实验步骤】步骤②通入氮气的目的是排除装置中的CO2。
步骤④通入氮气的目的是将生成的CO2全部通入澄清石灰水中。
【数据处理】由题意可知n(CO2)=n(CaCO3)=
=0.02mol,剩余的固体为52.24g-48.48g=3.76g,且固体中有还原所得的单质铁2.24g,则剩余的碳粉为3.76g-2.24g=1.52g,所以参加反应的碳粉为2g-1.52g=0.48g=0.04mol,可以确定生成CO为0.02mol,因此方程式为2C+Fe2O3
2Fe+CO↑+CO2↑。
【实验优化】①将澄清石灰水换成Ba(OH)2溶液的原因是Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全,且M(BaCO3)>M(CaCO3),称量时相对误差小。
②从环保的角度来看生成的CO也要进行处理,因此应该在尾气出口处加一燃着的酒精灯或增加一尾气处理装置。
5.特定条件下进行的物质鉴别和推断
a.不利用其他试剂进行物质鉴别和推断
(12)(经典题,6分)下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3②NaHCO3 Ba(OH)2 H2SO4③HCl NaAlO2 NaHSO4④Ca(OH)2 Na2CO3 BaCl2
A.①②B.②③C.①③④D.①②④
b.限用一种试剂进行的物质鉴别和推断
(13)(经典题,6分)有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸B.烧碱溶液C.氨水D.KSCN溶液
c.多种试剂进行的物质鉴别和推断
(14)(经典题,6分)某钠盐溶液中可能含有NO
、CO
、Cl-、I-等阴离子。
某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中含NO
、Cl-三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论( )
A.①②④⑤B.③④C.③④⑤D.②③⑤
d.任选试剂进行的物质鉴别和推断
(15)(2013全国大纲卷,4分)制备氮化镁的装置示意图如图所示:
回答问题:
请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象_______________________________________________________________________________
_______________________________________________________________________________
_______________________________________________________________________________。
取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁(4分)
根据Mg3N2和H2O反应的方程式:
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑,可知检验方法为取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁。