酵母操作手册Leader in Biomedicine RD OutsourcingWord文件下载.docx
《酵母操作手册Leader in Biomedicine RD OutsourcingWord文件下载.docx》由会员分享,可在线阅读,更多相关《酵母操作手册Leader in Biomedicine RD OutsourcingWord文件下载.docx(14页珍藏版)》请在冰豆网上搜索。
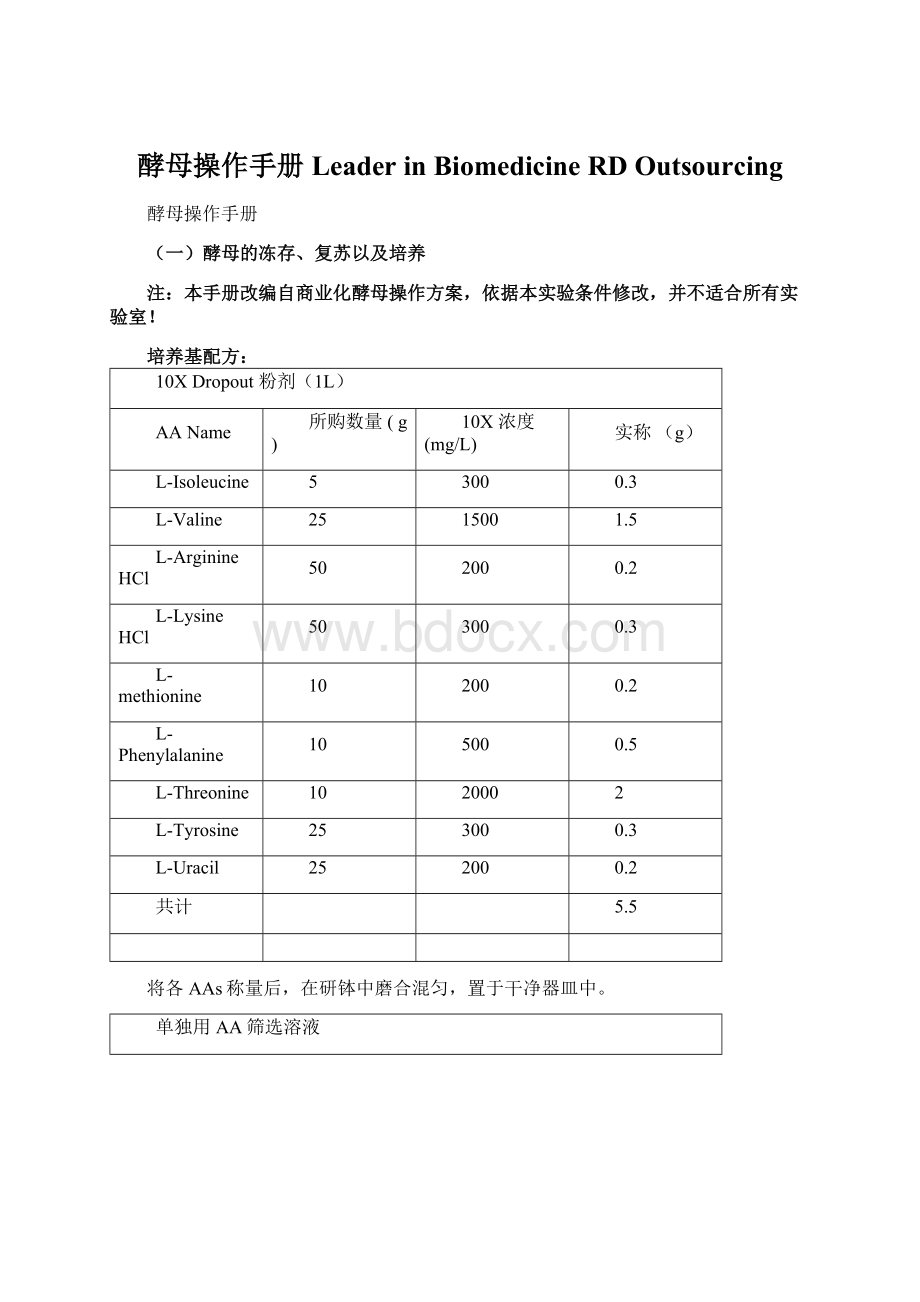
AA名称
体积(ml)
浓度(mg/ml)
L-Adeninehemisulfatesalt
100
100X
L-HistidineHClmonohydrate
L-Leucine
1
L-Tryptophan
过滤除菌
YPDA(1L)
浓度
Difcopeptone
20g/L
20
Yeastextract
10g/L
Agar(forplatesonly)
Glucose
2%
Adeninehemisulfate
0.003%
15ml0.2%Ade
SDMedia(1L)
实称(g/ml)
加H2O至1000ml,114℃,20min。
YNB
6.7g
Agar(forplatesonly)
20g
10X基本DO粉剂
0.55g
100X单独用AA
10ml
1.长期冻存:
无营养缺陷型的酵母株存在含25%甘油的YPDA中,然后冻存于-70℃冰箱中,若要保存大于一年,务必使温度不要低于-55℃。
转染质粒的营养缺陷型酵母株存在含25%甘油的相应的缺陷型培养基(SD)中,以避免质粒丢失。
制备方法:
用无菌牙签从琼脂板上将一个单克隆挑出,置于含200-500μlYPDA或SD的1.5ml离心管中,注意尽量使牙签上的菌落都涮在溶液中,然后盖好盖,在旋涡器上剧烈振荡混匀,再加入无菌甘油,使其终浓度为25%,再次振荡混匀,存于-70℃冰箱中。
2.复苏:
准备一无菌1.5ml离心管,加入100-200μlYPDA或SD,用无菌牙签挑取些许冻存菌置于离心管中,稍微涮洗一下牙签(让挑取的冰屑融化),混匀后吸取100μl涂平板,30℃培养2-3天。
刚长出克隆的平板用封口膜密封后,在4℃可保存1-2个月。
注意:
有时冻存的酵母可能沉到离心管底部,所以在复苏时,将其全部融化,然后振荡混匀,再复苏。
3.酵母的液体培养:
用无菌牙签挑取一个两个月以内的酵母克隆,每5ml液体培养基所需的克隆大小为2-3mm,所以,如果单个克隆不够,可以多挑几个。
剧烈振荡,使酵母细胞分散到液体中,30℃,200rpm振荡培养16-18hr,但通常好像需要24hr,甚至更长才能达到稳定期(OD600>
1.5),所以一般在上午开始摇,第二天下午收。
如果需要中期培养物,则将上面的稳定期培养物稀释到OD600=0.2-0.3之间,然后30℃,200rpm振荡培养3-5hr,此时的培养物OD600=0.4-0.6之间。
可见酵母的细胞周期约为3-5hr。
(二)质粒转化酵母细胞手册
试剂配方:
单链CarrierDNA(SS-DNA)(2mg/ml)
你不需要将CarrierDNA超声切割,因为实验证明CarrierDNA越大效果越好!
只要如下操作即可。
1.称取200mg高分子量DNA(III型脱氧核糖核酸钠盐,鲑鱼精DNA,SigmaD1626),溶于100mlTE(10mMTris.HCl,PH8.0,1.0mMEDTA)。
先用10ml枪头吹吸使DNA湿化,然后用磁性转子于4℃缓慢搅拌过夜使其完全溶解;
如果紧急,也可于室温剧烈搅拌2–3hr使其完全溶解。
2.将其直接分装成1ml/管,储存在-20℃。
3.使用之前,先取出一管沸水浴至少5分钟,然后迅速放置于冰上骤冷。
要点:
I:
CarrierDNA沸水浴后可以用3至4次而不需要再次沸水浴。
如果转化效率开始降低,请再将其沸水浴或重新换一管。
II:
本手册中使用这种低浓度的CarrierDNA(2mg/ml)便于操作,并且重复性高。
III:
我们原来曾用酚:
仿抽提来纯化这些CarrierDNA,以保证达到最好的转化效率。
如果你购买的鲑鱼精DNA已是非常纯的,可以不用抽提。
所以购买后先检测一下你的DNA的纯度。
CarrierDNA无菌性要求:
我们用灭过菌的TE缓冲液溶解DNA,所以在经过5分钟的沸水浴后,可以基本上认为它是无菌的。
实验也证明了这一点。
1.0MLithiumAcetate储液
lithiumacetate用去离子水溶解成1.0M,然后过滤除菌。
没必要调节该溶液的pH值,该溶液配好后pH在8.4至8.9之间。
LithiumAcetate也可以通过高压20分钟来达到灭菌效果,但最好还是过滤除菌。
PEG3350(50%w/v)
PEG3350购自Sigma公司,产品号为P3640。
将其用双蒸水或去离子水按W/V=50%溶解,然后过滤除菌。
为了得到您满意的转化效率,务必注意PEG的浓度是否准确。
另外,请将PEG溶液储存在密封性很好的器皿中,以防水分蒸发而导致PEG浓度上升。
在正常手册中,PEG在转化体系中浓度为33%(W/V),其浓度微弱的变化都可能导致转化效率达降低。
1.取一150ml烧杯,加入50gPEG3350,然后加入35mlddH2O。
2.磁子搅拌直至其溶解,这大约得花30分钟。
3.将溶液转至100ml容量瓶或量筒中,注意用少量水清洗烧杯数次,将清洗液加入到容量瓶中,然后定容至100ml混匀。
4.用0.45µ
m滤器过滤除菌,储存在灭过菌的器皿中。
质粒DNA:
质粒DNA可以用常规方法制备,,转化酵母时没必要对其进行进一步的纯化。
因为RNA在LiAc/SS-DNA/PEG转化过程中,RNA本身就是一个很好的载体(Carrier),所以不需要在制备DNA时除去RNA。
我们在实验中常用碱裂解法大提质粒,但LiCl处理可以免去,TE中也不加RNase。
常规转化酵母细胞手册
1.将酵母接种在2–5mlYPDA或10ml极限培养基中,于30℃、200rpm培养18至20h。
2.取少许在显微镜下计数,使酵母浓度在108/ml左右。
计数时注意:
1.取少许酵母用水稀释10倍或100倍(假设为10倍)
2.小心地取10µ
l置于计数板和盖玻片之间,使其虹吸进入两者中间的带格空隙中,静置几分钟。
格子区域为1平方毫米,它被分为25个正方形,计数板和盖玻片之间的体积相当于10-4ml。
3.计5个正方形方格中酵母的数量(假设为239个)
4.按如下方法计数:
5个方格中的酵母数X稀释倍数X1/25个正方形方格所占的体积。
所以按3中所计之数,应该为239X5X10X1/10-4=1.2x108个酵母/ml。
5.芽殖酵母(Saccharomycescerevisiae)通过芽殖来进行繁殖,计数时出芽的酵母只能算是一个细胞,如果出的芽与原来的细胞等大,可以算作两个。
有些酵母系会形成团块,导致铺平板时克隆数减少,因为一团细胞只能长成一个克隆,这使得下一步的分析变得困难。
6.我们也可以用OD600来确定酵母的浓度,但不同的酵母株中,这种细胞数与OD600之间的关系也不同。
3.取已在30℃预热的YPDA(50ml),加入2中的酵母细胞,使酵母浓度在5x106/ml。
4.30℃,200rpm振荡培养,使酵母细胞浓度到2x107/ml。
这大约得花3至5小时。
这些培养物足可以做10个转化。
务必使细胞至少分裂两次
转化效率(转化子/µ
g质粒/108酵母细胞)在第3至第4个分裂期之间保持稳定。
5.用50ml离心管于4℃,3000g(约5000rpm)离心5分钟。
6.倒去上清,用25ml无菌水重悬,再次离心。
7.倒去水,用1ml100mMLiAc重悬,转移到1.5ml离心管中。
8.在微量离心机上,以最高速度(14,000rpm)离心15秒,用枪头小心将上清LiAc去除。
9.加入大约400µ
l100mMLiAc重悬细胞,使酵母细胞终浓度在2x109/ml。
如果在步骤4中,酵母细胞浓度大于107/ml,那就多加入一些LiAc,使步骤9中细胞终浓度保持在2x109/ml。
10.取出一管CarrierDNA,沸水浴5分钟,迅速置于冰上骤冷。
*****没必要每次都将CarrierDNA沸水浴,沸水浴后的DNA可以冻-化3至4次,但记住每次拿出来的时候都要将其置于冰上*****
11.将步骤9中重悬的细胞剧烈振荡,然后取出新的离心管,在每管中加入50µ
l(注意离心管上做好标记,以防混淆)。
微量离心机上最高转速离心15秒,然后用200µ
l枪头将LiAc吸出。
12.按以下“转化混合物体系”,依次加入相应试剂:
240µ
lPEG(50%W/V)
36µ
l1MLiAc
50µ
lCarrierDNA(2.0mg/ml)
Xµ
l质粒DNA(0.1–10µ
g)
34–Xµ
l无菌水
总体积为360µ
l
此处的加入顺序非常重要,PEG必须得首先加入,它可以将酵母细胞与高浓度的LiAc分开,使酵母免受高浓度之害。
另外,也可将以上试剂(除了质粒DNA之外)预先混匀,然后在每管酵母沉淀上加入355µ
l这种预混物(TRAFO),最后加入5µ
l质粒DNA混匀。
注意,TRAFO非常粘稠,所以一定要小心加入正确的体积数。
13.剧烈振荡,使酵母细胞与溶液完全混匀,这通常需要花1分钟。
14.置于30℃,于200rpm振荡培养30分钟。
15.42℃水浴中,热激30分钟。
不同的酵母细胞株,热激时间也可能存在不同。
如果你需要高转化率,请先检测一下热激时间。
16.在微量离心机上,6-8000rpm离心15秒,用200µ
l枪头小心去除上清。
17.小心、柔和地加入1ml无菌水,柔和地将沉淀细胞悬浮。
如果需要高转化效率,请尽可能地柔和。
另外,清洗次数不宜再多,因为容易损失转化细胞。
18.取2至200µ
l铺于极限培养基平板上,如果所取体积少于200µ
l,另外再加一些无菌水使终体积至200µ
l。
涂平板时,也尽可能柔和,用最少的划数使溶液平铺在整个平板上。
19.等溶液被完全吸收后,置于30℃培养2至4天。
转染两个质粒时,如含诱饵蛋白的质粒和文库质粒,可以同时将它们转入酵母中,但这样的转化效率会降低,因为只有大约30-40%的转化细胞可以同时含有两种质粒。
所以,这种情况下,最好先将诱饵质粒转入酵母中(用本方法或快速转染的方法),然后再制备含该质粒的酵母感受态,来转化文库质粒。
也可用高压灭菌的方法来使PEG溶液无菌!
!
但是,高压灭菌时,PEG溶液中水分蒸发容易导致PEG浓度上升,使得转化效率下降很多。
快速转染酵母细胞手册
本手册适用于任何酵母细胞株
目的:
如果你只需要有转入质粒的细胞即可,如转入一个测试质粒或GAL4BD融合质粒,那你可以用该手册来进行你的实验。
本手册易于操作,步骤简单,适用于多种来源的酵母细胞,但你最好还是用刚在平板上长好的新鲜酵母。
1.每一个转化,用无菌牙签从平板上刮下大约25µ
l新鲜酵母,悬浮在1ml无菌水中。
(每个转化需要25µ
l酵母细胞,所以,如果你刮下100µ
l,这些细胞便可以做4个转化反应)
平板可以用1周以前的,但最好还是用新鲜的。
许多种类的培养基上长出来的酵母都可以用该方法进行转化,而YPDA平板上长出来的效果最好。
将细胞团块或克隆周边的一些细胞刮去,以收获状态良好的细胞。
2.在微量离心机上以最高转速离心5秒钟。
3.去除上清,将细胞沉淀悬浮在1ml100mMLiAc中,置于30℃温育5分钟。
4.估计细胞的体积,按25µ
l细胞沉淀/管,将悬浮液分装至1.5ml离心管中,在微量离心机上以最高转速离心5秒钟,用200µ
l枪头吸出上清。
5.按如下顺序加入以下试剂(注意顺序不要错):
lofPEG(50%w/v)
l1.0M.LiAc
lSS-DNA(2.0mg/ml)
5.0µ
lofplasmidDNA(100ngto5µ
20µ
lofsddwater.
CarrierDNA的量加倍,这些溶液的配方与“常规转染”中的一样。
6.剧烈振荡1分钟以上,是细胞沉淀完全悬浮,然后置于42℃温育20分钟。
7.在微量离心机上以最高转速离心10秒钟,用200µ
l枪头小心移去上清。
8.加入200-400µ
l无菌水,柔和悬浮。
9.将悬浮物铺在1至2个相应极限培养基平板上,置于30℃培养。
克隆应该在2至4天内长出。
长出的克隆可以从几百到几千个。
将文库质粒DNA转入酵母中进行酵母双杂交筛选
酵母的高效转化需要先前酵母中质粒的稳定
酵母双杂交系统以及酵母中其他类似的遗传学筛选过程都需要在同一酵母细胞中转入两种不同的质粒。
其中一个质粒通常含有一段所需基因或片断,而另一种质粒则是包含cDNA文库。
将两者混在一起进行转染的效率通常不高,所以通常先将一种质粒转入酵母,然后再将另一种质粒转入。
含有第一种质粒的酵母必须先在极限培养基中培养到1-2x107cells/ml,使其中的质粒在这一段生长过程中保持稳定,然后才可开始制备感受态,以转入第二种质粒。
在极限培养基中生长到对数期后,可以置换到YPDA中使其扩增一倍,这段扩增时间中,质粒丢失很少,但酵母的生长状态却很佳(前提是质粒对酵母生长没有影响)。
本实验手册可以获得高质量的酵母感受态细胞。
其中分有几种不同级别的转化(指所需转化子的数量),所以,在选择时,最好先检测一下文库DNA的转化效率,以便确定所需级别。
(表1&
讨论)
所有溶液与前同
1.上午,将含有第一种质粒的酵母接种至以下体积的极限培养基中,置于三角瓶中,200rpm、30oC培养24hr。
不同级别的转染数量使用不同的培养体积。
TRAFOSCALE,级别
10X
30X
60X
CultureSize,体积
25mls
50mls
100mls
2.第二天上午,检测细胞浓度,确定细胞数量在1.0x107/ml左右,同时准备以下体积的YPDA,并温育至30oC。
TRAFOSCALE
YPADcultureSize
50mls
150mls
300mls
#ofCellsneeded
2.5x108
7.5x108
1.5x109
3.将培养好的酵母转入相应的灭菌离心管中,3000xg离心5min。
用事先温育至30oC的YPDA重悬细胞,(先加入2mlYPDA,将细胞吹吸混匀,然后将其他YPDA加入),置于另一灭菌三角瓶中。
4.30oC、200rpm培养,使细胞浓度达到2x107cells/ml,这大约需要3-4hr。
5.将细胞转入灭菌离心管中,3000xg离心5min,收集细胞。
6.加入1/2YPDA体积的无菌水重悬细胞,按步骤5收集细胞。
7.配备100mM无菌LiAC,按以下给出的量加入,重悬细胞,然后转入相应体积的离心管中(一般用10ml离心管就够了),在30oC温育15min,再次按步骤5离心,除去上清。
100mMLiAc
3mls
6mls
8.取一灭菌的10mlTube,按下表由上至下的顺序,依次加入相应的溶液,在漩涡器上振荡,使其彻底混匀;
然后将混匀液加至步骤7中的细胞沉淀上,漩涡器上剧烈振荡使其混匀。
另外也可先不加文库DNA,在将转化液加入细胞沉淀上之后,再加文库DNA混匀,这样可以避免在转移溶液时DNA的损失。
50%PEG
2.4ml
7.20ml
14.40ml
1.0MLiAc
360µ
1.08ml
2.16ml
SS-DNA(2mg/ml)
500µ
1.50ml
3.00ml
LibraryplasmidDNA
Aµ
Bµ
Cµ
sddWater
340-Aµ
1.02-Bml
2.04-Cml
不同级别的溶液数量其实都是单个反应(1X)所需溶液量的倍数。
i.我们可以将常规转化(1X)累加至120X的级别,但通常我们不需要这样做,因为60X已经足够了。
ii.在转移PEG溶液时,不要使用玻璃管,用塑料的。
因为玻璃管会吸附PEG溶液,不容易吹出所有的溶液。
iii.无菌水和质粒DNA的量是可调的,但他们的总体积是不变的。
9.剧烈振荡,务必使沉淀完全悬起,这大约需要花1min。
如果重悬困难的话,可以先静置5min,然后再振荡混匀。
10.置于30oC温育30min.
11.按下表在42oC热激相应时间,每5min颠倒混匀15sec。
HeatshockTime
30min
40min
45-60min
大量转化,如60X,热激时则需要每5min颠倒混匀几次,以使溶液中的温度均一。
12.按步骤5离心收集细胞,加入下表相应体积的无菌水重悬,然后铺于相应的极限培养基平板中。
通常30X和60X的转化要使用100块15cm板,这样可以使转化效率升高,并且使文库中的各种DNA损失很少。
(实验中我们一般只用30-40块15cm板来转化30-60X)
ResuspensionVolume
10mls
40mls
我们实际所用体积
5ml
15ml
含有HIS3筛选基因的酵母双杂交转化可以将转化酵母直接涂在三缺极限培养基平板上(Trp、Leu、His)。
而转化效率可以按如下测量:
取1-2µ
l转化物涂在一块Trp――Leu-平板上检测。
将平板置于30oC培养3–5天。
有人最长曾培养过14天才长出(应该是在三缺板上)。
讨论:
规划好每个常规转化所需DNA的量是非常必要的。
表1所示是常规转化中文库质粒DNA的转化效率。
由该表可见,用来转化时,做10个1µ
g质粒DNA常规转化的效率要高于用10µ
g来做一个10X的转化。
这不但可以节省DNA的量,同时也可减少单个酵母克隆中含多个文库质粒的概率(这会使后续检测工作复杂化)。
PlasmidDNA
amount
Efficiency
Transformants/µ
g
Yield
TotalTransformants
0.1µ
1.35x106
1.35x105
0.5µ
6.88x105
3.44x105
1.0µ
5.67x105
2.0µ
3.89x105
7.78x105
2.19x105
1.10x106
10.0µ
1.53x105
1.53x106
Table-1:
Transformationefficiencyversusyieldofaplasmidlibrary
将文库质粒与诱饵质粒GAL4BD共转化的效率低于逐步转化。
所以,用快速转染的方法先将诱饵质粒转入酵母,再用本方法将文库质粒转入。
当然,在诱饵质粒对酵母细胞生长有影响的情况下,还是用共转染为好,这时,仔细操作两种质粒的比例和量才能得到高转化效率。
酵母蛋白提取物的制备
实际上,我认为如果样品不是很多的话,直接培养20ml以上的酵母,至一定OD值后,离心重悬于5mlPBS中,超声破碎,然后加入2XLoadingBuffer,煮后离心上样。
当然,如果超声头小到可以用来直接操作1ml的培养物,那就不用离心重悬了。
超声破碎对蛋白虽然有些影响,但具体的结果差别几乎没有。
现总结一下Clontech公司提取酵母蛋白的方法,共有两种:
Urea/SDS法&
TCA法。
我们先介绍一下酵母的获得,然后分别介绍提取蛋白的这两种方法:
酵母的获得:
所需试剂:
YPDA或相应的SD培养基(可以在50ml三角瓶中配置,然后灭菌,需要几个就配置几个)
50ml的三角瓶
冰预冷的纯水
干冰或液氮
步骤:
1.第一天早晨,挑取克隆或冻存液,置于装有1ml培养基的试管中,另外,挑取含空质粒或不含质粒的酵母置于相应的培养基中,作为对照,30,200rpm培养约24hr。
2.第二天早晨,测量大致的OD600后,将0.5-1.0ml过夜培养物转移至装有20mlYPDA培养基的三角瓶中,使其OD600在0.2-0.3左右,30℃,200rpm培养约4-8hr,使OD600在0.4-0.6之间。
3.测量总OD600T,公式为:
OD600T=OD600Xml数
4.预先将70ml离心管(或其他相应离心机的离心管)半插在冰内,将培养物迅速置于冰上,冷后将其倒入离心管中。
5.5000rpm(相当于1000g)离心5min
6.弃去上清,用50ml冰预冷的纯水洗涤一次,5000rpm离心5min。
7.弃去上清,倒置控干,液氮速冻后,置于-70℃冰箱中。
酵母的裂解和蛋白提取物的制备:
Urea/SDS法:
酵母中质粒的纯化
1.挑取酵母置于1-3ml相应培养基中,30℃,200rpm培养约24hr
2.取1.5ml,微量离心机