化学小高考反应方程式考题归纳文档格式.docx
《化学小高考反应方程式考题归纳文档格式.docx》由会员分享,可在线阅读,更多相关《化学小高考反应方程式考题归纳文档格式.docx(19页珍藏版)》请在冰豆网上搜索。
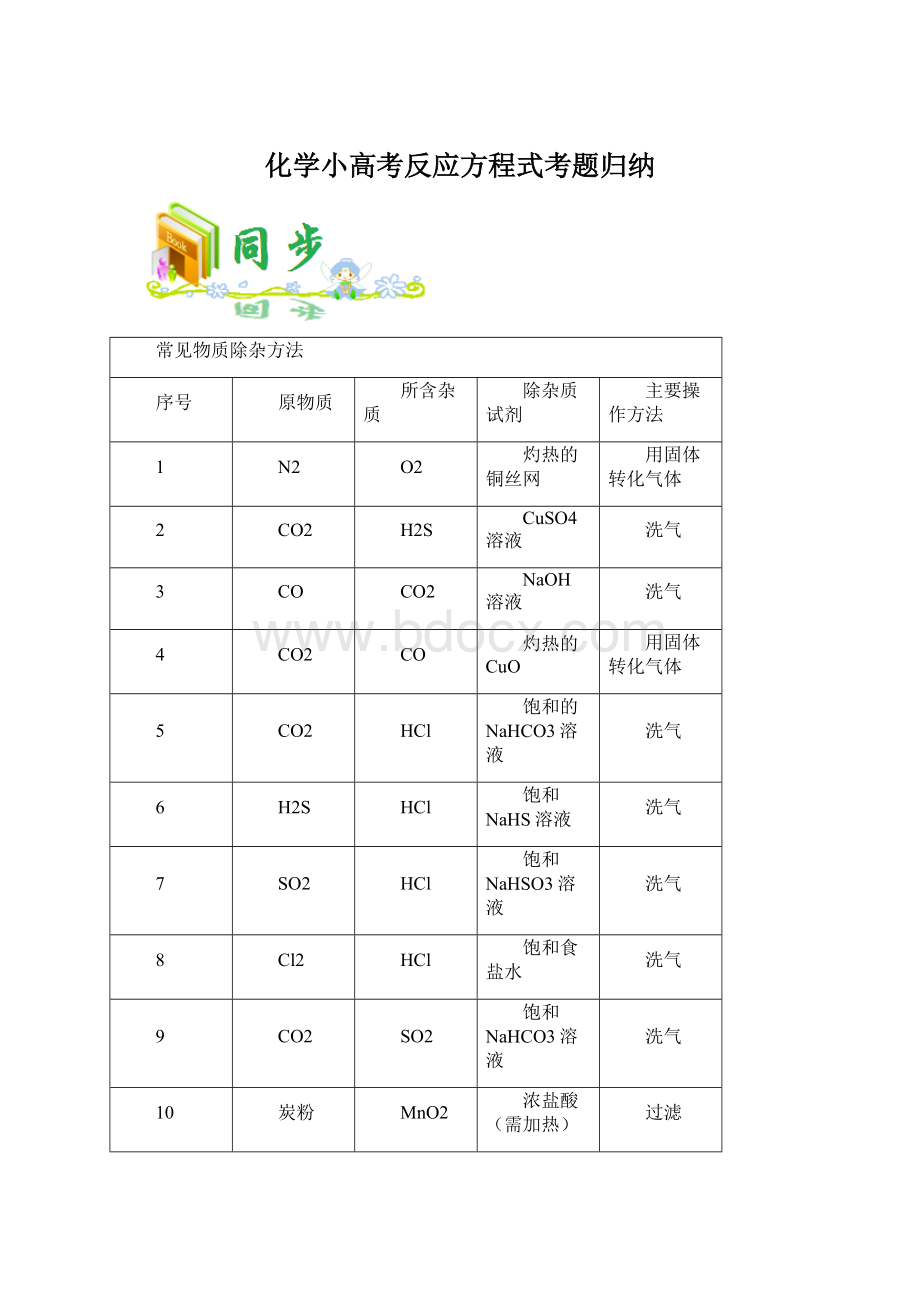
稀酸(如稀盐酸)
13
Al2O3
Fe2O3
NaOH(过量),CO2
过滤,加热分解
14
15
SiO2
盐酸,氨水
16
ZnO
HCl溶液
17
18
BaSO4
BaCO3
稀盐酸溶液或稀硫酸溶液
19
Na2CO3
Ca(OH)2(适量)
20
Na2CO3溶液
NaOH
NaHCO3(适量)
加盐转化法
21
NaHCO3溶液
加酸转化法
22
NaHCO3
NaOH(适量)
加碱转化法
23
NaCl溶液
盐酸
24
NH4Cl溶液
(NH4)2SO4
BaCl2(适量)
25
FeCl3溶液
FeCl2
加氧化剂转化法
26
CuCl2
Fe,Cl2
27
FeCl2溶液
FeCl3
Fe
加还原剂转化法
28
磁铁
吸附
29
Fe(OH)3胶体
蒸馏水
渗析
30
CuS
FeS
稀盐酸
31
I2晶体
NaCl
加热升华
32
NaCl晶体
NH4Cl
加热分解
33
KNO3晶体
重结晶,过滤
34
乙烯
SO2,H2O
碱石灰
35
乙烷
Br2水溶液
36
溴苯
溴
NaOH稀溶液
分液
37
硝基苯
NO2
蒸馏水或NaOH稀溶液
38
甲苯
苯酚
39
乙醛
乙酸
饱和Na2CO3溶液
蒸馏
40
乙醇
水(少量)
新制CaO
41
苯
NaOH溶液,CO2
42
乙酸乙酯
43
溴乙烷
44
皂化液
甘油
食盐水
45
葡萄糖
淀粉
渗析结晶
离子检验与推断
离子
检验方法
H+
能使紫色石蕊试液或橙色的甲基橙试液变为红色。
Na+K+
用焰色反应来检验时,它们的火焰分别呈黄色,浅紫色(通过钴玻璃片)
Ba2+
能使稀硫酸或可溶性硫酸盐溶液产生BaSO4沉淀,且溶液不溶于稀硝酸
Mg2+
能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液
Al3+
能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液
Ag+
能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀硝酸,但溶于氨水,生成[Ag(NH3)2]+
NH4+
铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出是湿润的红色石蕊试纸变蓝的有刺激性气味NH3气体
Fe2+
能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。
或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制氨水后立即显红色2Fe2++Cl2=2Fe3++2Cl-
Fe3+
能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀
Cu2+
蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的CuO沉淀,含Cu2+溶液能与Fe,Zn等反应,在金属上有红色的铜生成。
OH-
能使无色酚酞,紫色石蕊,橙色的甲基橙等指示剂分别变为红色,蓝色,黄色。
Cl-
能与硝酸银反应,生成白色的AgCl沉淀沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+
Br-
能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸
I-
能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;
也能与氯水反应,生成I2,使淀粉溶液变蓝。
SO42-
能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于稀硝酸
SO32-
浓溶液能与强酸反应,产生无色有刺激性气味气体的SO2气体,该气体能使品红溶液褪色。
能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味SO2气体
S2-
能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀
CO32-
能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味,能使澄清石灰水变浑浊的CO2
HCO3-
取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊,或向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀MgCO3生成,同时放出CO2气体。
PO43-
含磷酸根的中性溶液,能与AgNO3反应,生成黄色的Ag3PO4沉淀,该沉淀溶于硝酸。
NO3-
浓溶液或晶体中加入铜片,浓硫酸加热,放出红棕色气体
离子共存
离子共存一:
所谓离子共存,实质上就是看离子间是否发生反应的问题。
若在溶液中发生反应,就不能共存。
看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
一般注意以下几点:
①在强酸性溶液中,不能大量存在弱酸根离子:
如CO32-、HCO3-、S2-、HS-、SO32-、SiO32-、AlO2-、F-等,也不能有大量的OH-。
②强碱性溶液中,不能大量存在弱碱金属离子。
如:
Mg2+、Fe2+、Al3+、Cu2+及NH4+等,也不能大量存在H+及酸式根离子:
HCO3-、HSO3-、HS-、H2PO4-等。
③能发生氧化还原反应的离子也不能共存:
如Fe3+与I-、Cu2+与I2,H+、Fe2+与NO3-、ClO-与S2-,ClO-与Fe2+。
H+、I-与NO3-,H+、I-与SO32-或S2-等。
④能形成络离子的也不能共存:
Fe2+与SCN-,Fe3+与C6H5O-等。
离子共存之二
所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;
若离子之间能发生反应,则不能大量共存。
1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。
(1)生成难溶物或微溶物:
Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等不能大量共存。
(2)生成气体或挥发性物质:
如NH4+与OH-,H+与CO32-、HCO3-、S2-、HS-、SO32-等不能大量共存。
(3)生成难电离的物质:
如H+与CO32-、S2-、SO32-等生成弱酸;
OH-与NH4+、Cu2+、Fe3+等生成弱碱;
H+与OH-生成水,这些离子不能大量共存。
(4)发生氧化还原反应:
氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
注意Fe2+与Fe3+可以共存。
(5)形成配合物:
如Fe3+与SCN-反应生成配合物而不能大量共存。
2.附加隐含条件的应用规律:
(1)溶液无色透明时,则溶液中肯定没有有色离子。
常见的有色离子是Cu2+、Fe3+、Fe2+、MnO4-等。
(2)强碱性溶液中肯定不存在与OH-起反应的离子。
(3)强酸性溶液中肯定不存在与H+起反应的离子。
限制酸性溶液的条件
1.PH=1的溶液
2.使紫色石蕊溶液呈红色
3.使甲基橙呈红色
4.加镁粉放氢气
隐含有H-
限制碱性的条件
1.PH=14
的溶液
2.使pH变蓝
3.使红色石蕊变蓝
4.酚酞呈红色
可酸可碱的条件
1.加入铝粉有氢气产生
2.HCO3-离子不能稳定存在的溶液
离子共存之三
在溶液中离子共存问题的实质是哪些离子之间不能发生反应。
能够发生反应的离子就不能共存,不能够发生反应的离子才可以共存。
(1)离子间能直接结合生成难溶性物质时,则这些离子不能大量共存SO42-与Ba2+、Ag+和Cl-,OH-与Cu2+、Fe3+、Mg2+、Al3+;
Ag+与Br-、I-、CO32-、SO32-、S2-;
Mg2+、Ba2+、Ca2+与CO32-、SO32-;
S2-与Cu2+等不能大量共存。
(2)离子间能结合生成难电离物质时,则这些离子不能大量共存。
如OH-、ClO-、CH3COO-、HPO42-、H2PO4-与H+;
HCO3-、HS-、H2PO4-。
H+与OH-等不能大量共存。
(3)离子间能结合生成挥发性物质时,则这些离子不能大量共存。
如CO32-、SO32-、HCO3-、S2-、HS-与H+;
NH4+与OH-等不能大量共存。
(4)离子之间能发生氧化还原反应时,则这些离子不能大量共存。
一般说来,有氧化性的离子(如MnO4-、ClO-、Fe3+、NO3-等)与有还原性的离子(如S2-、Br-、I-、SO32-、Fe2+等)不能大量共存。
注意以下几种情况:
①在有H+存在时,MnO4-、ClO-、NO3-的氧化性会增强。
②Fe3+与Fe2+可以共存,因为它们之间不存在中间价态。
Fe3+不能氧化Cl-。
③NO3-(有H+时)不能氧化Cl-。
④还应注意题目是否给出溶液的酸碱性,是否给定是在无色溶液中。
在酸性溶液中除题给离子外,还应有大量H+;
在碱性溶液中除题给离子外,还应有大量OH-。
若给定溶液为无色时,则应排除Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-(紫色)。
1.强酸(HClO4、HI、HBr、HCl、H2SO4、HNO3、H+)可以和强酸的酸根离子共存;
但不能与弱酸根离子共存(F-、CO32-、ClO-、S2-、SiO32-等)
2强碱(KOH、NaOH、Ba(OH)2等)OH-与弱碱的阳离子(如Cu2+、NH4+、Al3+等)不能共存。
3弱酸的酸式根离子与H+、OH-都不能共存,如HCO3-、HS-、HSO3-、HPO42-等。
但强酸的酸式根离子只与碱不能共存,如HSO4-。
4.相关离子的颜色:
MnO4-为紫色;
Fe3+为棕黄色;
Fe2+为浅绿色;
Cu2+为蓝色。
5.电解质溶液中至少有一种阳离子和一种阴离子。
复分解反应是有难溶物(微溶物)生成、难电离物质生成、易挥发物质生成。
由于难溶物、难电离物微粒之间有比较强的相互作用,分子难以电离成离子;
挥发性物质生成并从溶液中分离,都导致溶液中离子浓度降低,使离子不能大量共存。
如Cl-与Ag+;
Ba2+与SO42-;
CO32-、H+;
H+、OH-;
OH-与NH4+;
H+、CH3COO-等。
2.强氧化剂和强还原剂不能共存(但Fe3+、Fe2+因没有中间价态可以共存)
常见强氧化剂:
硝酸;
浓硫酸;
MnO4-(H+)溶液;
高铁离子(Fe3+);
NO3-(H+)溶液;
含有ClO-在酸、碱性的溶液中都有强氧化性。
常见强还原剂:
I-;
Fe2+;
+2价硫(如S2-、HS-、H2S);
+4价硫(SO2、SO32-、HSO3-)等。
3.发生双水解反应使离子浓度降低。
盐溶液中,弱酸的阴离子和弱碱的阳离子容易发生水解,某些离子相遇形成弱酸弱碱盐时,阴阳离子相互促进水解,使平衡向水解方向移动而水解完全,使溶液中的离子浓度迅速降低。
常见易发生双水解的阳离子有(Fe3+或Al3+)与(CO32-、HCO3-、AlO2-)的组合。
Al3++3HCO3-=Al(OH)3↓+3CO2↑
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
Al3++3AlO2-+6H2O=4Al(OH)3↓
4.发生络合反应使离子浓度降低。
如Fe3+与SCN-等。
三、离子共存问题常见的典型问题
1.Al(OH)3有酸式电离和碱式电离:
,增加或OH-、Al3+浓度;
或者增加H+、AlO2-离子浓度,都可以使平衡朝生成沉淀的方向移动。
因此OH-、Al3+;
H+、AlO2-不能共存,但OH-、AlO2-;
Al3+、H+可以共存。
2.Fe2+、NO3-可以共存,但有H+时不能共存,因为HNO3具有强氧化性。
3.某溶液与铝反应可以生成氢气,在该溶液中不一定存在与H+或者OH-可以共存的离子。
4.常温下,某溶液中由水电离出的H+为0.01mol/L,则该溶液可能是pH=2或者pH=12的溶液。
该溶液为酸性或碱性,有H+或者OH-。
5.某种溶液中有多种阳离子,则阴离子一般有NO3-某种溶液中有多种阴离子,一般阳离子有K+、Na+、NH4+中的一种或几种。
6.酸性条件下ClO—与Cl—不共存
专题一、
1.在含有大量K+、OH-、CO32-的溶液中还可能大量存在的离子是
A.NH4+B.Al3+C.Ca2+D.SO42-
2.下列反应的离子方程式的书写正确的是
A.盐酸与氢氧化钠溶液反应:
H++OH-=H2O
B.锌粒与稀醋酸反应:
Zn+2H+=Zn2++H2↑
C.氯化镁溶液与氨水反应:
Mg2++2OH-=Mg(OH)2↓
D.氯气与氢氧化钠溶液反应:
Cl2+OH-=Cl-+ClO-+H2O
3.下列反应的离子方程式的书写正确的是
4.在溶液中能大量共存的离子组是()
A.
、
B.
C.
D.
下列离子方程式书写正确的是
一、复分解反应的离子方程式1.含有难电离物质的离子方程式
⑴稀硫酸和烧碱溶液反应H++OH-=H2O对
CH3COOH溶液与NaOH溶液反应H++OHH2O稀醋酸和稀氨水反应H++OH-=H2O
⑵甲酸钠溶液和盐酸反应HCOO-+H+=HCOOH对醋酸钠溶液与盐酸混合CH3COONa+H+=CH3COOH+Na+
⑶苯酚钠溶于醋酸溶液C6H5O-+CH3COOH→C6H5OH+CH3COO-对
向苯酚钠溶液中通入二氧化碳CO2+H2O+2C6H5O-→2C6H5OH+CO32-
2.含有难溶物质的离子方程式
⑴稀盐酸和氢氧化铜反应H++OH-=H2O氢氧化镁与稀硫酸反应H++OH—=H2O
⑵氢氧化钡溶液中滴加入盐酸2H++2Cl-+Ba2++2OH=2H2O+BaCl2
稀硫酸和氢氧化钡溶液反应H++OH-=H2O
H2SO4与Ba(OH)2溶液反应Ba2++2OH+2H++SO42BaSO4+2H2O对
⑶硫酸铜溶液氢氧化钡溶液反应Cu2++SO42+Ba2++2OHBaSO4+Cu(OH)2对
醋酸钡溶液和硫酸反应Ba2++SO
=BaSO4↓氯化钡溶液与硫酸反应Ba2++SO42—==BaSO4↓对
⑷碳酸钙溶于醋酸CaCO3+2H+Ca2++CO2↑+H2O
碳酸镁中滴加入盐酸CO32-+2H+CO2↑+H2O
⑸澄清石灰水中加入盐酸Ca(OH)2+2H+=Ca2++2H2O
澄清石灰水中通入过量CO2Ca2++2OH—+CO2=CaCO3↓+H2O
⑹硫化亚铁与盐酸反应S2-+2H+H2S↑
3.有气体生成的离子方程式⑴碳酸氢钠溶液中加入盐酸CO32-+2H+CO2↑+H2O
用小苏打治疗胃酸过多HCO3+H+=CO2↑+H2O对
向小苏打溶液中加入醋酸溶液HCO3-+H+=CO2↑+H2O
⑵碳酸钠溶液与盐酸反应,有气泡逸出Na2CO3+2H+==2Na++H2O+CO2↑
碳酸氢钙溶液与醋酸混合Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
⑶氯化铵与氢氧化钠两种浓溶液混合加热OH—+NH
△H2O+NH3↑对
⑷碳酸氢铵溶液加入过量的NaOH溶液OH—+NH
NH3↑+H2O
二、水解反应的离子方程式⑴醋酸钠的水解反应CH3COO—+H3O+=CH3COOH+H2O
⑵硫化钠的水解S2-+2H2O
H2S+2OH-
⑶向沸水中滴加FeCl3溶液制备Fe(OH)3胶体Fe3++3H2O
Fe(OH)3↓+3H+
三、定量反应的离子方程式⑴NaOH溶液中通入少量SO2SO2+OH-HSO3
过量的SO2通入NaOH溶液中SO2+2OH-=SO32-+H2O
⑶Na2CO3溶液中通入少量CO2CO32+CO2+H2O2HCO3对
Na2CO3溶液中通入少量SO22CO32+SO2+H2O2HCO3+SO32-对
⑷碳酸氢钠溶液与少量石灰水反应HCO
+Ca2++OH—=CaCO3↓+H2O
澄清石灰水与少量小苏打溶液混合Ca2++OH-+HCO3-CaCO3↓+H2O对
NaHCO3溶液中加入过量的Ba(OH)2溶液2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
⑸碳酸氢钙溶液与NaOH溶液混合HCO3—+OH—=CO32—+H2O
碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3—+2OH—=CaCO3↓+2H2O+CO32—对
⑹氢氧化钙溶液和碳酸氢镁反应Ca2++OH-+HCO
=CaCO3↓+H2O
Ca(HCO3)2与过量Ca(OH)2溶液反应Ca2++2HCO3+2OHCaCO3↓+CO32+2H2O
饱和Ca(HCO3)2溶液加入饱和Ca(OH)2溶液反应Ca2++OH-+HCO
=CaCO3↓+H2O对
⑺硫酸氢钠溶液与足量氢氧化钡溶液混合2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
⑻向氯化铝溶液中加入过量氢氧化钠溶液Al3++4OH-=Al(OH)4-对
氯化铝溶液中加入过量氨水Al3++4NH3•H2OAl(OH)4-+4NH4+
⑼AgNO3溶液中加入过量氨水Ag++2NH3·
H2O=
+2H2O对
四、氧化还原反应的离子方程式1.金属与酸反应的离子方程式
⑴钠与水的反应Na+2H2O=Na++2OH—+H2↑
⑵金属镁与稀盐酸反应,有氢气产生Mg+2H++2Cl—==MgCl2+H2↑
⑶浓烧减溶液中加入铝片Al+2OH-=AlO2-+H2↑
⑷单质铜与稀硝酸反应Cu+2H++2NO
=Cu2++2NO↑+H2O
⑸稀硝酸与过量的铁屑反应3Fe+8H++2NO3—=3Fe3++2NO↑+4H2O
2.Fe2+、Fe3+的转化⑴过量铁粉与氯化铁溶液反应,溶液变浅绿色Fe+Fe3+==2Fe2+
FeCl3溶液加入Cu粉(腐蚀印刷电路板)Fe3++Cu=Fe2++Cu2+
⑵氯化亚铁溶液中通入氯气2Fe2++Cl22Fe3++2Cl-对
氯化亚铁溶液中通入少量氯气Fe2++Cl2Fe3++2Cl-
硫酸亚铁溶液与稀硫酸、双氧水混合2Fe2++H2O2+2H+=2Fe3++2H2O对
⑶向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2=Fe3++Br2+4Cl-
⑷Fe(NO3)3溶液中加入过量的HI溶液:
2Fe3++2I-=2Fe2++I2
3.其他⑴实验室用浓盐酸与MnO2反应制Cl2MnO2+2H++2Cl-
Cl2↑+Mn2++H2O对
以石墨作电极电解氯化铝溶液2Cl+2H2O
2OH-+H2↑+Cl2↑
⑵Cl2与NaOH溶液反应Cl2+2OH=Cl+ClO+H2O对F2与NaOH溶液反应F2+4OH=2F+O2+2H2O
⑶Fe3O4与稀HNO3反应Fe3O4+8H+=Fe2++2Fe3++4H2O
⑷NaNO2溶液中加入酸性KMnO4溶液2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O对
课后提升
1、下列各组离子能大量共存的是
A.H+、Na+、HCO3-、Cl-B.Fe3+、SCN-、Cl-、NO3-
C.Mg2+、Fe2+、SO42-、NO3-D.Fe3+、SO42-、OH-、NO3-
2、硫酸亚铁溶液中含有杂质硫酸铜和硫酸铁,为除除去杂质,提纯硫酸亚铁,应该加入下列物质中的
A.锌粉B.镁粉C.铁粉D.铝粉
3、可用来分离Fe3+和Al3+两种离子的试剂是
A.盐酸B.氢氧化钠溶液C.氨水D.硫氰化钾溶液
4、要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序是
①加入足量氯水②加放足量高锰酸钾溶液③加入少量硫氰化钾溶液
A.①③B.③②C.③①D.①②③
5、元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化。
则X为
A.Fe
B.CuXXY2XY3
C.S
D.C
6、火星器发回的信息表明,火星上存在针铁矿[FeO(OH)]和黄钾铁矿,从而证明火星表面曾存在过水。
这一发现被《人民日报》评为2004世界十大新闻之首。
已知两种矿物中铁的价态相同,则黄钾铁矿[化学式记为:
Kfe3(SO4)2(OH)n]中n值为
A.4B.5C.6D.7
7、有0.4克铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入过量的澄清石灰水中,得到0.75克固体沉淀物,这种铁的氧化物质化学式是
A.FeOB.Fe2O3