届山东省日照市高考化学一模试题Word 解析版Word格式文档下载.docx
《届山东省日照市高考化学一模试题Word 解析版Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《届山东省日照市高考化学一模试题Word 解析版Word格式文档下载.docx(34页珍藏版)》请在冰豆网上搜索。
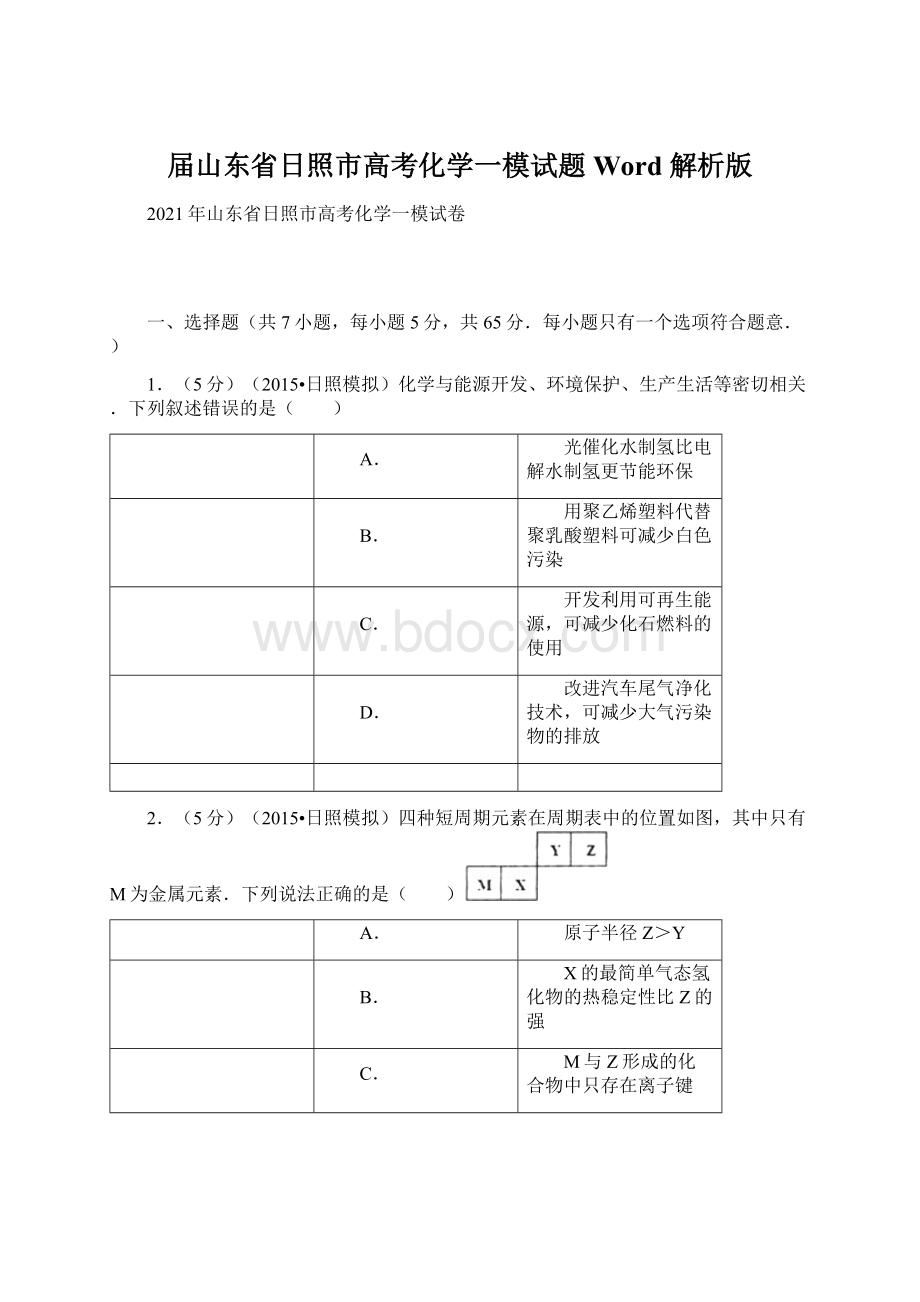
用稀硝酸洗涤试管内壁的银镜:
Ag+3H++NO3﹣═Ag++NO↑+H2O
4.(5分)(2015•日照模拟)镁铝合金5.4g溶于过量的热浓硝酸中,反应产生11.2LNO2(标准状况),若在反应后溶液中加入过量的氢氧化钠溶液,则生成沉淀质量为( )
4.5g
6g
8.7g
13.9g
5.(5分)(2015•日照模拟)阿魏酸在食品、医药等方面有着广泛用途.一种合成阿魏酸的反应可表示为:
下列说法正确的是( )
阿魏酸的分子式为C10H10O4
香兰素、阿魏酸均可与NaOH、NaHCO3溶液反应
可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
一定条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
6.(5分)(2015•日照模拟)某无色溶液中只可能含有Na+、Ba2+、Cl﹣、Br﹣、SO32﹣、SO42﹣离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )
步骤
操作
现象
①
用pH试纸检验
溶液的pH大于7
②
向溶液中滴加氯水,再加入CCl4震荡,静置
CCl4层呈橙色
③
向②所得溶液中加入Ba(NO3)2溶液和稀HNO3
有白色沉淀产生
④
过滤,向滤液中加入AgNO3溶液和稀HNO3
肯定含有离子的Na+、Br﹣、SO32﹣
肯定没有的离子是Ba2+、SO32﹣
可能含有的离子是Cl﹣、Br﹣、SO42﹣
不能确定的离子是Na+、Cl﹣、SO42﹣
7.(5分)(2015•日照模拟)常温下,向10mLbmol•L﹣1的CH3COOH溶液中滴加等体积的0.0lmol•L﹣1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO﹣),下列说法不正确的是( )
b>0.0l
混合后溶液呈中性
CH3COOH的电离常数Ka=
mol•L﹣1
向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
二、解答题(共3小题,满分53分)
8.(16分)(2015•日照模拟)氢气是一种理想的“绿色能源”,利用氢能需要选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等.
(1)已知:
Mg(s)+H2(g)═MgH2(s)△H=﹣74.5kJ.mol﹣1
MgNi(s)+H2(g)═MgH2NiH4(s)△H=﹣64.4kJ.mol﹣1
则Mg2Ni(s)+2MgH2(g)═2Mg(s)+Mg2NiH4(s)△H= kJ.mol﹣1
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:
Mg(AlH4)2═MgH2+2Al+3H2↑.反应中每转移3mol电子时,产生的H2在标准状况下的体积为 L.
(3)镧镍合金在一定条件下可吸收氢气形成氢化物:
LaNi5(s)+3H2(g)⇌LaNi5H6(s)△H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是 (填字母编号).
a.增加LaNi5H6(s)的量b.升高温度c.减小压强d.使用催化剂
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
(g)
(g)+3H2(g)
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为amol•L﹣1,平衡时苯的浓度为bmol•L﹣1,该反应的平衡常数K= (用含a、b的代数式表示).
②一定条件下,如图装置可实现有机物的电化学储氢(忽略其它有机物).
A是电源的 极(填“正”或“负”);
电解过程中产生的气体F为 (填化学式):
电极D上发生的电极反应为 .
9.(18分)(2015•日照模拟)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义.
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为 ,所得溶液中c(H+)﹣c(OH﹣)= (填字母编号).
A.c(SO32﹣)﹣c(H2SO3)
B.c(SO32﹣)+c(NH3.H2O)﹣c(H2SO3)
C.c(HSO3﹣)+c(SO32﹣)﹣c(NH4+)
D.c(HSO3﹣)+2c(SO32﹣)﹣c(NH4+)
(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物.
①乙电极上发生的是 反应(填“氧化”或“还原”);
②甲电极上的电极反应式为 .
(3)将不同物质的量的H2O(g)和CO分别通入体积为2L的恒容密闭容器中,发生反应:
H2O(g)+CO(g)⇌CO2(g)+H2(g)△H,得到如下数据:
实验
温度/℃
起始量/mol
平衡量/mol
达到平衡所需时间/min
H2O
CO
H2
Ⅰ
650
2
4
2.4
1.6
5
Ⅱ
900
1
0.4
3
Ⅲ
a
b
t
①由表中数据可知该反应的△H 0(填“>”或“<”).
②650℃时,若在此容器中开始充入2molH2O(g)、lmolCO、1molCO2和2molH2,则反应在开始时 进行(填“正向”或“逆向”).
③实验Ⅲ中a= ,达平衡时实验II和实验Ⅲ中H2O(g)的转化率的大小关系为:
a2(H2O) a3(H2O)(填“>”、“<”或“=”).
10.(19分)(2015•日照模拟)某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验.
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:
Na2O2氧化NO2;
假设2:
NO2氧化Na2O2.
(1)甲同学设计如图1装置进行实验:
①试管A中反应的离子方程式是 .
②待试管B中充满红棕色气体,关闭旋塞a和b;
取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;
再将带火星的木条迅速伸进试管内,木条复燃.
③仪器C兼有防倒吸的作用,仪器C的名称为 .
结论:
甲同学认为假设2正确.
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是 .乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;
带火星的木条未复燃,得出结论:
假设正确.则NO2和Na2O2反应的化学方程式是 .
II.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化.查阅资料:
2NO+Na2O2═2NaNO2;
2NaNO2+2HCl═2NaCl+NO2↑+NO↑+H2O:
酸性条件下,NO能与MnO4﹣反应生成NO3﹣和Mn2+.
(3)丙同学用下图2所示装置(部分夹持装置略)探究NO与Na2O2的反应.
①在反应前,打开弹簧夹,通入一段时间N2,目的是 .
②B中观察到的主要现象的是 (填字母编号).
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是 (填字母编号).
a.无水硫酸铜b.无水氯化钙c.碱石灰d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为 .
⑤充分反应后,检验D装置中产物的方法是:
取D装置中产物少许, ,则产物是NaNO2.
【化学一有机化学基础】
(共1小题,满分12分)
11.(12分)(2015•日照模拟)聚乙酸乙烯酯又名聚醋酸乙烯酯,主要用作涂料、胶黏剂、纸张、口香糖基料和织物整理剂,其合成路线如下,其中物质J与氯化铁溶液能发生显色反应.
已知:
①当羟基与双键碳原相连时,易发生如下转化RCH=CHOH→RCH2CHO;
②﹣ONa连在烃基上不易被氧化.
请回答下列问题:
(1)写出G的结构简式 ;
F与H中具有相同官能团的名称 .
(2)J在一定条件下能生成高聚物K,K的结构简式是 .
(3)同时符合下列要求的A的同分异构体有 种.
①含有苯环
②苯环上有2个取代基
③能发生银镜反应和水解反应
(4)写出B→C+D反应的化学方程式:
.
参考答案与试题解析
考点:
使用化石燃料的利弊及新能源的开发;
常见的生活环境的污染及治理.
分析:
A.光催化还原水制氢利用的是太阳能;
B.聚乙烯塑料很难降解,聚乳酸塑料易降解;
C.减少化石能源的利用,开发新能源,能减少污染源;
D.汽车尾气中含有氮的氧化物等有害气体,则改进汽车尾气净化技术,减少大气污染物的排放.
解答:
解:
A.电解消耗电能,而光催化还原水制氢可利用太阳能,更节约能源,故A正确;
B.聚乙烯塑料难降解,可造成白色污染,聚乳酸塑料易降解不会造成白色污染,故B错误;
C.开发利用可再生能源,减少化石燃料的使用,减少了二氧化碳、二氧化硫等物质的排放,符合社会可持续发展理念,故C正确;
D.汽车尾气中含有氮的氧化物等有害气体,则改进汽车尾气净化技术,减少大气污染物的排放,符合社会可持续发展理念,故D正确;
故选:
点评:
本题考查了环境保护、能源开发,与生产生活密切相关,有利于培养学生养成可持续发展、绿色生活的观念,题目难度不大.
原子结构与元素的性质.
由短周期元素在周期表中的位置,可知M、X处于第三周期,T.Z处于第二周期,四元素中M的金属性最强,只有M为金属元素,则M为Al,结合位置关系可知,X为Si,Y为N,Z为O,
A.同周期自左而右原子半径减小;
B.非金属性越强,气态氢化物越稳定;
C.M与Z形成的化合物为氧化铝;
D.M的最高价氧化物对应水化物为Al(OH)3,属于两性氢氧化物.
A.同周期自左而右核电荷数增大,原子半径减小,则原子半径为Y>Z,故A错误;
B.非金属性Z>X,则X的最简单气态氢化物的热稳定性比Z的小,故B错误;
C.M与Z形成的化合物为氧化铝,只存在离子键,故C正确;
D.M的最高价氧化物对应水化物为Al(OH)3,属于两性氢氧化物,能与NaOH溶液反应,故D错误;
故选C.
本题考查位置、结构及性质的综合应用,判断M为金属Al并推出各元素为解答的关键,注意对元素周期律的理解,难度不大.
离子方程式的书写.
A.氢氧化钠过量,氨根离子、碳酸氢根离子都反应;
B.KIO3氧化酸性溶液的KI生成碘和水;
C.离子个数配比不符合物质的构成;
D.原子个数不守恒、电荷数不守恒.
A.向NH4HCO3溶液中加过量NaOH溶液并加热:
HCO3﹣+NH4++2OH﹣
NH3↑+2H2O+CO32﹣,故A错误;
B.用KIO3氧化酸性溶液的KI,离子方程式:
5I﹣+IO3﹣+6H+═3I2+3H2O,故B正确;
C.向Ba(OH)2溶液中滴加稀硫酸:
Ba2++2OH﹣+2H++SO42﹣═BaSO4↓+2H2O,故C错误;
D.用稀硝酸洗涤试管内壁的银镜:
3Ag+4H++NO3﹣=3Ag++NO↑+2H2O,故D错误;
本题考查了离子方程式的正误判断和书写方法,明确反应实质是解题关键,注意原子个数、电荷数守恒规律.
有关混合物反应的计算.
标况下11.2L二氧化氮的物质的量为:
n(NO2)=
=0.5mol,根据氮元素的化合价变化计算转移电子物质的量;
氢氧化钠溶液过量,则最后沉淀为Mg(OH)2,利用金属总质量、电子守恒列式计算出镁的物质的量,再计算出生成氢氧化镁的质量.
=0.5mol,生成0.5mol二氧化氮转移电子的物质的量为:
0.5mol×
(5﹣4)=0.5mol,
设Al的物质的量为x、Mg的物质的量为y,则①3x+2y=0.5;
根据合金的总质量可得:
②27x+24y=5.4g,
根据①②解得:
x=
mol、y=0.15mol,
即:
合金中含有0.15mol镁;
加入过量氢氧化钠溶液后生成的沉淀只能为氢氧化镁,根据质量守恒可知生成氢氧化镁的物质的量为0.15mol,质量为:
58g/mol×
0.15mol=8.7g,
本题考查混合物反应的计算,题目难度中等,注意掌握质量守恒、电子守恒在化学计算中的应用方法,试题培养了学生的化学计算能力.
有机物的结构和性质.
A.阿魏酸的分子式为C10H10O4;
B.香兰素含有酚羟基,阿魏酸中的酚羟基、羧基均可与碳酸钠、氢氧化钠反应,但酚羟基不能和碳酸氢钠反应;
C.阿魏酸中含有碳碳双键,香兰素中含有醛基,酚羟基,都能使酸性高锰酸钾褪色;
D.不能发生消去反应.
A.阿魏酸的分子式为C10H10O4,故A正确;
B.香兰素中的酚羟基和阿魏酸中的酚羟基、羧基均可以与碳酸钠和氢氧化钠溶液反应,但酚羟基不能和碳酸氢钠反应、羧基能和碳酸氢钠反应,所以香兰素不能和碳酸氢钠溶液反应,故B错误;
C.阿魏酸中含有碳碳双键,香兰素中含有醛基,酚羟基,都能使酸性高锰酸钾褪色,不能鉴别,故C错误;
D.香兰素和阿魏酸可以发生取代和加成反应,不能发生消去反应,故D错误;
故选A.
本题考查有机物结构和性质,为高考高频点,明确物质中含有的官能团,再结合教材中官能团性质采用知识迁移的方法解答即可,注意酚羟基和碳酸钠反应但和碳酸氢钠不反应,为易错点.
常见阴离子的检验;
常见阳离子的检验.
①根据盐类水解分析溶液呈碱性,是含有弱酸阴离子,只有亚硫酸根离子;
根据离子共存,判断出不存在的离子;
②根据萃取现象确定所含溴离子;
③稀硝酸具有强氧化性,能氧化亚硫酸根离子,操作步骤中的现象只能说明可能含有硫酸根离子;
④操作步骤中的现象证明含氯离子,但由于②加入了氯离子,所以原溶液是否含氯离子不能确定;
最后根据电荷守恒确定电解质溶液中的阳离子的存在;
依据题干中的条件,用pH试纸检验,测得溶液pH大于7,溶液呈碱性,说明一定有弱酸根离子,则含有SO32﹣,无Ba2+;
溶液中滴加氯水后萃取,萃取层呈橙色证明原溶液含溴离子;
稀硝酸具有强氧化性,能氧化亚硫酸根离子,向②所得的水溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀生成,说明溶液中可能含硫酸根离子,过滤,向滤液中加入AgNO3溶液和稀HNO3,有白色沉淀生成,证明是氯离子,但②加入氯水加入了氯离子,不能确定是否含氯离子;
根据以上分析溶液中一定含有SO32﹣、Br﹣,无Ba2+;
依据电荷守恒,溶液中一定含Na+;
所以溶液中一定存在的离子是SO32﹣、Br﹣、Na+;
一定不存在的离子是Ba2+;
不能确定的离子是Cl﹣、SO42﹣,
本题考查了常见离子的检验方法和产生的现象,萃取操作,离子共存的判断,电荷守恒的应用,关键是先肯定离子存在,再否定不共存的离子,注意干扰离子对现象的影响,题目难度中等.
酸碱混合时的定性判断及有关ph的计算.
常温下,向10mLbmol•L﹣1的CH3COOH溶液中滴加等体积的0.0lmol•L﹣1的NaOH溶液,充分反应后溶液中c(Na+)=c(CH3COO﹣),依据溶液中电荷守恒分析可知溶液呈中性,醋酸略微过量,
A、恰好反应生成醋酸钠溶液呈碱性,若溶液呈中性,醋酸过量;
B、依据平衡常数概念计算;
C、醋酸弱电解质的电离平衡常数随温度变化,不随浓度变化,依据概念实质计算平衡常数分析判断正误;
D、随反应进行,水的抑制程度减弱,水电离程度增大;
A、恰好反应生成醋酸钠溶液呈碱性,若溶液呈中性,醋酸过量,b>0.01mol/L,故A正确;
B、充分反应后溶液中c(Na+)=c(CH3COO﹣),依据溶液中电荷守恒分析可知溶液呈中性,故B正确;
C、依据平衡常数概念计算,溶液呈中性,c(H+)=c(OH﹣)=10﹣7mol/L,c(Na+)=c(CH3COO﹣),电离平衡常数K=
=
,故B正确;
D、随反应进行,水的抑制程度减弱,水电离程度增大,故D错误;
故选D.
本题考查了酸碱和反应定量关系分析判断,溶液中电荷守恒的理解,弱电解质的电离平衡常数计算分析应用,电离平衡影响因素的判断,掌握基础是乎关键,题目难度中等.
则Mg2Ni(s)+2MgH2(g)═2Mg(s)+Mg2NiH4(s)△H= +84.6 kJ