广东省普宁市第一中学届高三上学期期末考试化学试Word下载.docx
《广东省普宁市第一中学届高三上学期期末考试化学试Word下载.docx》由会员分享,可在线阅读,更多相关《广东省普宁市第一中学届高三上学期期末考试化学试Word下载.docx(11页珍藏版)》请在冰豆网上搜索。
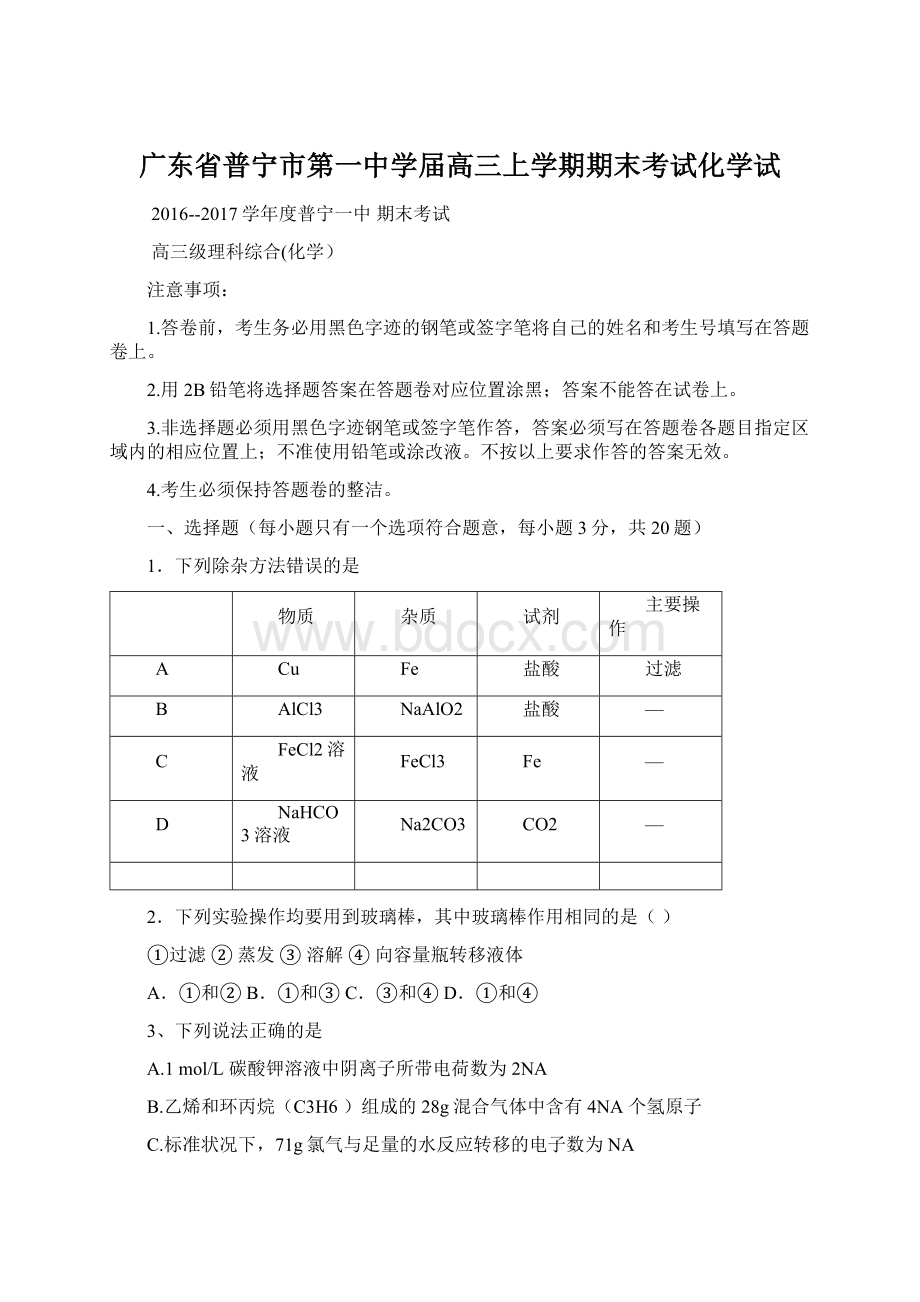
FeCl3
D
NaHCO3溶液
Na2CO3
CO2
2.下列实验操作均要用到玻璃棒,其中玻璃棒作用相同的是()
①过滤②蒸发③溶解④向容量瓶转移液体
A.①和②B.①和③C.③和④D.①和④
3、下列说法正确的是
A.1mol/L碳酸钾溶液中阴离子所带电荷数为2NA
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有4NA个氢原子
C.标准状况下,71g氯气与足量的水反应转移的电子数为NA
D.含0.1mol氯化铁的溶液滴入沸水,所得液体含有0.1NA个Fe(OH)3胶粒
4、据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。
撞击时发生的化学方程式为:
5KClO3+6P==3P2O5+5KCl,则下列有关叙述错误的是
A、上述反应中氧化剂和还原剂的物质的量之比为5:
6
B、产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C、上述反应中消耗3molP时,转移电子的物质的量为15mol
D、因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
5、碘化砹(AtI)可发生下列反应,①2AtI+2Mg==MgI2+MgAt2②AtI+2NH3(l)==NH4I+AtNH2。
对上述两个反应的有关说法正确的是
A、反应①MgAt2既是氧化产物,又是还原产物
B、这两个反应都是氧化还原反应
C、反应②中AtI既是氧化剂,又是还原剂
D、MgAt2的还原性弱于MgI2的还原性
6、据报道,科学家已经研制出固体氧化物燃料电池,该电池以固体氧化锆�氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示(多孔电极a、b均不参加电极反应).下列说法正确的是
A.有H2O放出的a极为电池的正极
B.b极对应的电极反应式为:
O2+4e-+2H2O―→4OH-
C.正极对应的电极反应式为:
O2+4H++4e-―→2H2O
D.该电池的总反应式为:
2H2+O2===2H2O
7、下列反应的离子方程式正确的是
①向氯化铝溶液中加入过量氨水 Al3++4NH3·
H2O=-+4NH4+
②铁屑溶于足量稀硝酸:
Fe+4H++NO3-=Fe3++NO↑+2H2O
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
④0.1molFeBr2中通入0.1molCl2:
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
20070309
⑤硫化钠溶液呈碱性:
S2-+2H2O
H2S+2OH-
⑥向苯酚钠溶液中通入少量CO2:
C6H5O-+CO2+H2O→C6H5OH+HCO3-
A.①②③B.②③⑥C.③④⑥D.④⑤⑥
8、某无色溶液中,由水电离出的c(H+)=1×
10
mo1·
L
,则该溶液中,一定能大量共存的离子组是
A.K+、Na+、MnO
、SO
B.K+、Cl
、Ba2+、HCO
C.K+、Na+、Cl
、Br
D.Na+、CO32一、A1O
、C1
9、工业上常将铬镀在其他金属表面,同铁.镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:
Cu-2e-===Cu2+
C.由实验现象可知:
金属活动性Cu>
Cr
D.两个装置中,电子均由Cr电极流向Cu电极
10、下列变化中,属于物理变化的是
A.熔融态的KCl导电
B.在Fe(OH)3胶体中加入MgSO4溶液析出红褐色沉淀
C.用加热方法分离沙子和NH4Cl晶体
D.蓝色CuSO4晶体,受热变为白色CuSO4粉末
11、下列指定微粒个数比为2∶1的是
A.Be2+离子中的质子和电子
B.
原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
12、如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍.下列说法正确的是( )
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
13、下列反应中,属于非氧化还原反应的是
A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O
B.Br2+2KOH=KBr+KBrO+H2O
C.3H2O2+2KCrO2+2KOH=2K2CrO4+4H2O
D.3CCl4+K2Cr2O7=2CrO2Cl2+3COCl2+2KCl
14、已知酸性条件下有反应:
2Cu+==Cu2++Cu。
氢气还原氧化铜试验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。
某同学对某次氢气还原氧化铜试验的红色固体产物作了如下实验,实验操作和实验现象列表如下:
加入试剂
稀硫酸
浓硫酸并加热
稀硝酸
浓硝酸
实验现象
红色固体
蓝色溶液
无色气体
红棕色气体
由此推出本次氢气还原氧化铜实验的产物:
A.是CuB.是Cu2O
C.一定有Cu,可能有Cu2OD.一定有Cu2O,可能有Cu
15、海水开发利用的部分过程如图所示。
下列说法错误的是
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
16、在反应aBrF3+bH2O==cHBrO3+dHBr+eHF+fO2(a、b、c、d、e、f是各物质的化学计量数),若0.3molH2O被氧化,则被水还原的BrF3的物质的量是
A.0.15mol B.0.2mol C.0.3mol D.0.4mol
17、以NA表示阿佛加德罗常数,下列说法中正确的是
A78g过氧化钠中含2NA个O2-B0.1molOH-含NA个电子
C1.8g重水(D2O)中含NA个中子D标准状况下11.2L臭氧中含NA个氧原子
18、下列图示与对应的叙述相符的是
A.图I表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8kJ.mol-1
B.图Ⅱ表示某可逆反应正、逆反应速率随温度的变化,则该反应的正反应是放热反应
C.图Ⅲ表示0.1molMgCl2.6H2O在空气中充分加热时固体质量随时间的变化
D.图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
19、下列实验方案能达到实验目的的是
选项
实验方案
实验目的或结论
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
可证明氧化性:
H2O2比Fe3+强
向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀
说明Y中不含醛基
取ag铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为VL(已转化为标准状况下)
测定铝箔中氧化铝的含量
比较不同反应的反应热数据大小
从而判断反应速率的大小
20、己知金刚烷的结构如图所示
,若有一个氮原子和一个溴原子取代它的两个氢原子,所得结构可能为()
A.7种B.8种C.9种D.10种
第І卷(非选择题,共40分
二、填空与简答
21(10分)、现有废液,其中含有CuCl2、FeCl2、HCl。
某课外活动小组计划用它得到纯净的FeCl2晶体。
为此设计如下实验方案:
序号
E
仪器及药品
第一步:
用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。
(制取CO的原理为:
H2C2O4
CO2↑+CO↑+H2O)
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是
→→→→。
(2)正确的操作第一步应是;
最后一步应是熄灭处的酒精灯。
(3)装置B的作用是;
装置E的作用是。
第二步:
将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
(4)必须进行的操作是。
第三步:
得到纯净的FeCl2晶体。
(5)必须进行的操作是。
22(10分)实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。
化工行业的发展必须符合国家节能减排的总体要求。
试运用所学知识,回答下列问题:
(1)已知在一定温度下,
①C(s)+CO2(g)
2CO(g)△H1=akJ/mol平衡常数K1;
②CO(g)+H2O(g)
H2(g)+CO2(g)△H2=bkJ/mol平衡常数K2;
③C(s)+H2O(g)
CO(g)+H2(g)△H3平衡常数K3。
则K1、K2、K3之间的关系是:
,△H3=(用含a、b的代数式表示)。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。
已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:
CO(g)+H2O(g)
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃
400
500
800
平衡常数K
9.94
9
1
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol·
L-1,在该条件下,CO的平衡转化率为:
。
(3)在催化剂存在条件下反应:
H2O(g)+CO(g)
CO2(g)+H2(g),CO转化率随蒸气添加量的压强比及温度变化关系如下左图所示:
对于气相反应,用某组分(B)的平衡分压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=
23(10分)“8·
12”天津港危化仓库爆炸,造成生命、财产的特大损失。
据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。
请回答下列问题:
(1)NaCN属于剧毒物质,有多种无害化处理方法
H2O2处理法:
NaCN+H2O2——N2↑+X+H2O,推测X的化学式为,双氧水的电子式为。
NaClO处理法:
aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O。
方程式中e:
f的值为
(填选项标号)。
A.1B.1/2C.2D.不能确定
③用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,则电解过程中,阳极的电极反应式为。
(2)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。
取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·
L—1)进行实验。
写出CNO-在酸性条件下被NaClO氧化的离子方程式:
______________;
24(10分)丙烯是石油化工的重要原料,一定条件下可发生下列转化:
已知:
;
R—Br+NaOH→R—OH+NaBr
(1)A的结构简式为:
____________;
(2)反应④的类型为:
_________________反应;
(3)D与足量乙醇反应生成E的化学方程式为:
_______________________________。
(4)
与足量NaOH溶液反应的化学方程式为____________________________。
(5)B的同分异构体有多种.写出其中既能发生银镜反应,又能发生酯化反应的2种同分异构体的结构简式:
__________________、___________________。
高三级理科综合(化学)参考答案
1B2D3B4D5A6D7B8C9B10B
11A12D13D14D15C16A17B18B19C20B
21、
(1)A→E→C→D→B
(2)连接好并检查气密性,A
(3)处理未反应完的CO和新生成的CO2除CO2(4)搅拌,过滤
(5)在HCl气体中加热浓缩,冷却结晶。
22、
(1)K3=K1·
K2(2分)(a+b)kJ/mol(2分)
(2)放热(2分)75%(2分)(3)
(2分)
23、
(1)
NaHCO3
B③Cl-+2OH-
—2e-=ClO-+H2O
(2)2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O
24、(10分)
(1)CH3CHBrCH3(1分);
(2)取代反应(1分)
⑶
(3分)
⑷
(5)HOCH2CH2CH2CHO、CH3CH(OH)CH2CHO或CH3CH2CH(OH)CHO
(CH3)2C(OH)CHO、HOCH2CH(CH2)CHO(写其中任意2个)(共2分)