上海二模化学专题资料废液缸题变质题和答案Word文档格式.docx
《上海二模化学专题资料废液缸题变质题和答案Word文档格式.docx》由会员分享,可在线阅读,更多相关《上海二模化学专题资料废液缸题变质题和答案Word文档格式.docx(10页珍藏版)》请在冰豆网上搜索。
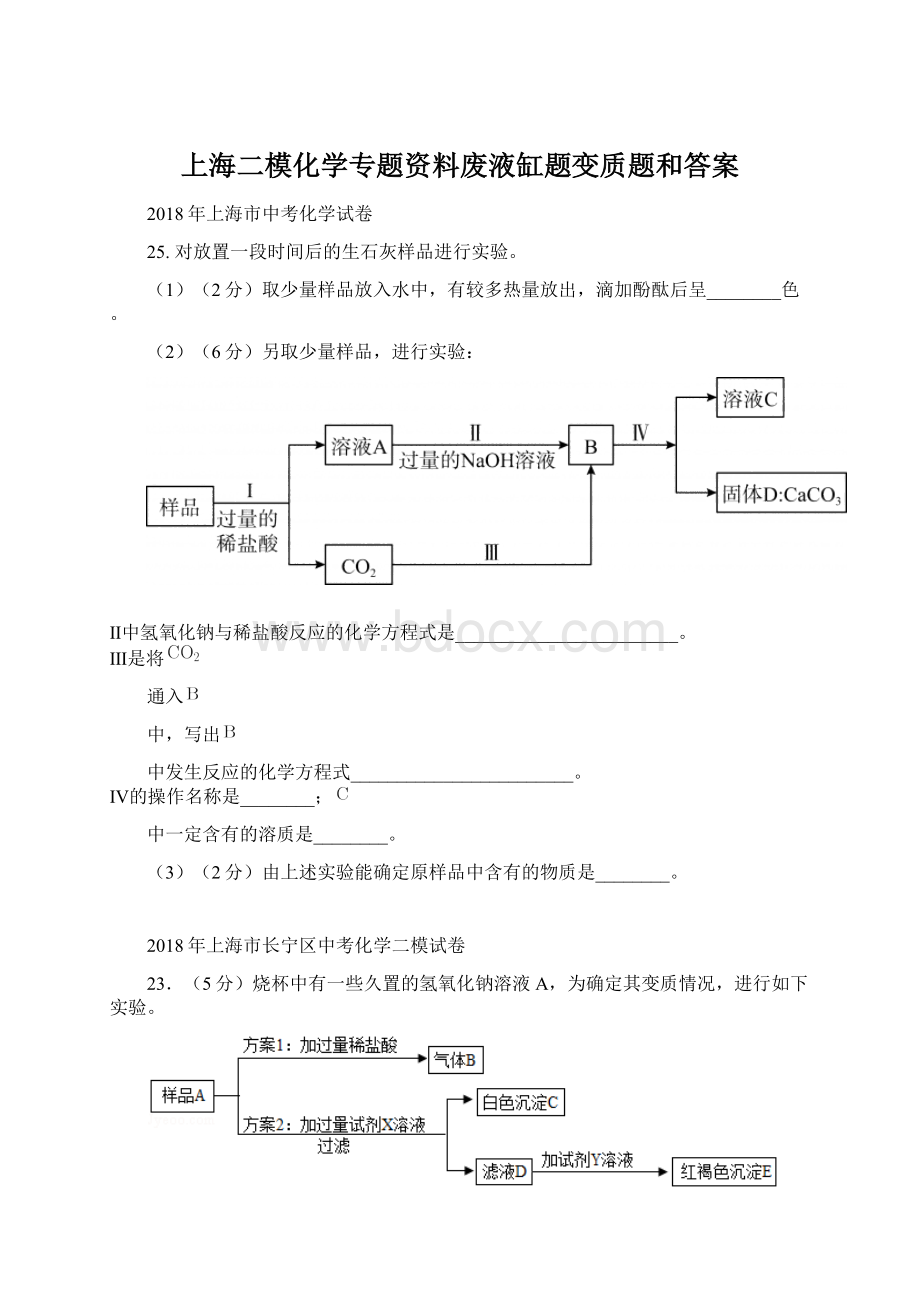
25.③丙同学用三支试管分别取适量的稀盐酸、澄清石灰水、碳酸钠溶液进行实验探究。
(I)步骤1:
向三支试管分别滴加无色酚酞试液后,Na2CO3溶液中显红色,说明Na2CO3溶液显 性。
(II)步骤2:
丙同学把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;
过滤,得到滤液,滤液中一定不含有 (填编号)。
A.稀盐酸B.澄清石灰水C.碳酸钠溶液D.氯化钾
(III)
【实验猜想】步骤2所得滤液中溶质可能为:
猜想一:
NaCl、Na2CO3;
猜想二:
NaCl、CaCl2和NaOH;
猜想三:
NaCl、Na2CO3和NaOH;
猜想…………
【实验设计】
实验操作
实验现象
实验结论
取少量滤液于试管中,加入过量CaCl2溶液
猜想三成立
【实验分析】上述实验操作结束后,试管中溶质的成分为 。
2018年上海市奉贤区中考化学二模试卷
23.(7分)为探究盐酸的化学性质,某同学做了如图实验:
①A中的现象是 ;
B中反应的化学方程式为 ;
C中反应原理的用途 ;
②反应结束后,将D、E中的废液倒入同一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。
过滤,得到白色沉淀和无色滤液。
该同学欲探究无色滤液中的溶质。
【分析】无色滤液中一定不含HCl,理由 (用化学方程式解释)。
【提出问题】无色滤液中的溶质是什么?
【作出猜想】①NaCl;
②NaCl和CaCl2;
③NaCl和Na2CO3;
④NaCl、CaCl2和Na2CO3.你认为猜想 一定不正确?
【进行实验】
实验步骤
取少量滤液于试管中,滴加少量碳酸钠溶液
无明显现象
猜想 成立
取少量滤液于试管中,滴加少量
有气泡产生
2018年上海市金山区中考化学二模试卷
25.(9分)学习盐的化学性质时,进行了如图所示的实验(提示:
氯化钙、氯化钡的溶液都呈中性)
①碳酸钠是一种重要的盐,甲中碳酸钠溶液中加入酚酞,溶液显 色;
乙和丙中都能观察到的实验现象是 ;
乙中发生反应的化学方程式是 ,该反应属于 发应(填基本反应类型);
②实验结束后,将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色;
静置,取上层清液于试管中,加入过量氯化钡溶液,有白色沉淀,溶液呈红色。
则废液缸中的废液一定含有指示剂、水、碳酸钙、 ;
在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑 。
2018年上海市闵行区中考化学二模试卷
25.(5分)为探究Ca(OH)2的化学性质,某小组进行了A、B两个实验。
将两支试管中的上层废液同时倒入一洁净的烧杯中,发现烧杯中有气泡产生。
请分析最终烧杯中成份:
假设1:
NaCl、CaCl2、HCl
假设2:
NaCl、NaOH、Na2CO3;
假设3:
;
【讨论】你认为上述假设中 一定不合理;
理由是 。
【实验】某同学通过以下实验方案及现象证明假设1成立,请补充完成下表实验。
取烧杯中少量液体于试管中,滴入
假设1正确
2018年上海市浦东新区中考化学二模试卷
26.(5分)为鉴别NaCl溶液和Na2CO3溶液,甲、乙、丙三位同学设计方案如下:
甲
乙
丙
分别滴加酚酞试液
分别滴加 溶液
分别滴加BaCl2溶液
现象与结论
呈 色的是Na2CO3溶液,无色的是NaCl溶液
冒气泡的是Na2CO3溶液,无明显现象的是NaCl溶液
有 的是Na2CO3溶液,无明显现象的是NaCl溶液
丙同学实验后将两只试管中的物质倒入洁净烧杯,静置后取上层清液,滴加稀硫酸观察到 ,可知上层清液中含有BaCl2,为避免可溶性钡盐引起水体重金属污染,可向废液中加适量 再排放。
A.碳酸钠溶液B.硫酸钠溶液C.硝酸银溶液D.水
2018年上海市杨浦区中考化学二模试卷
33.(9分)如图所示,在6支试管中分别低价2滴紫色石蕊溶液。
(资料:
KCl溶液、CaCl2溶液均显中性)
(1)作为对照试验的是试管 (选填①~⑥编号)。
(2)试管②、⑤溶液变为红色,其原因是溶液中溶质都含有 元素。
(3)试管⑥中溶液变为蓝色,说明碳酸钾溶液显 (选填“酸性”、“中性”或“碱性”)。
碳酸钾属于 (填物质类别),可做 肥使用,取该溶液灼烧,透过蓝色钴玻璃火焰呈 色。
(4)将试管⑤倒入试管④中,写出该反应的化学方程式 。
充分反应后溶液呈现 。
A.红色B.紫色C.蓝色
(5)实验后将试管①②⑥中的废液倒入大烧杯中,最终得到红色溶液,则大烧杯的废液中除了石蕊外,一定还含有 。
25.
(1)
【答案】红
【解析】解:
氧化钙和水反应生成氢氧化钙,放出热量,碳酸钙和盐酸反应生成二氧化碳,二氧化碳和氢氧化钠反应生成碳酸钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,所以
①取少量样品放入水中,有较多热量放出,反应后生成了氢氧化钙,溶液显碱性,滴加酚酞后呈红色。
25.
(2)
【答案】
、
过滤氯化钙、氯化钠
Ⅱ中氢氧化钠与稀盐酸反应生成氯化钠和水,化学方程式是:
;
中,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和盐酸反应生成碳酸钙沉淀和氯化钠,所以B中发生反应的化学方程式为:
Ⅳ的操作将不溶性固体从溶液中分离出来,所以该名称是过滤;
碳酸钙中的碳来自二氧化碳,二氧化碳中的碳来自碳酸钙,而碳酸钙中的钙只是氧化钙中的一部分,而氯化钙中的钙元素的质量等于氧化钙中钙元素的质量,因此碳酸钠只是和部分氯化钙发生了反应,氯化钙有剩余;
C中一定有的溶质是:
氯化钙、氯化钠。
25.(3)
【答案】氧化钙、碳酸钙
由上述实验能确定原样品中含有的物质是氧化钙、碳酸钙。
23.【解答】解:
(1)久置的氢氧化钠溶液A中可能含有氢氧化钠与二氧化碳反应生成的碳酸钠,碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,故气体B是二氧化碳,故填:
CO2;
(2)要检验变质的情况,就是检验是否含有氢氧化钠,需要先除去碳酸钠,加入的试剂与碳酸钠反应不能生成氢氧化钠,故试剂X是硝酸钡溶液,故填:
硝酸钡。
(3)若所加试剂Y是氯化铁溶液,则氯化铁与氢氧化钠反应生成生成红褐色沉淀和氯化钠,化学方程式为3NaOH+FeCl3═Fe(OH)3↓+3NaCl.故填:
3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
(4)经过实验可以看出,加入的硝酸钡是过量的,加入硝酸钡产生了红褐色的沉淀,故滤液D中溶质的成分有氢氧化钠、硝酸钡,故填:
氢氧化钠、硝酸钡。
由方案2可知,烧杯中氢氧化钠溶液是部分变质,故填:
部分变质。
向三支试管分别滴加无色酚酞试液后,Na2CO3溶液中显红色,说明Na2CO3溶液显碱性。
(II)步骤2:
丙同学把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;
过滤,得到滤液,根据“最终有白色沉淀生成且溶液显红色”和质量守恒定律,滤液中一定不含有稀盐酸、氯化钾,故选AD。
【实验猜想】步骤2所得滤液中溶质可能为:
NaCl、CaCl2和NaOH;
NaCl、Na2CO3和NaOH;
猜想……【实验设计】
取少量滤液于试管中,加入过量CaCl2溶液
有白色沉淀生成且溶液红色不消失
【实验分析】上述实验操作结束后,试管中溶质的成分为NaCl、CaCl2、NaOH。
故答案为:
Mg>Fe>Cu;
Fe、Cu或Fe、Cu、Mg;
CO+CuO
Cu+CO2;
反应后装置A中固体的质量(或测量反应前后装置B增加的质量);
碱;
AD;
有白色沉淀生成且溶液红色不消失;
NaCl、CaCl2、NaOH。
①A中的现象是石蕊试液变红色;
B中铁和稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:
Fe+2HCl═FeCl2+H2↑;
C中氧化铁和稀盐酸反应生成氯化铁和水,可以用稀盐酸除铁锈。
故填:
石蕊试液变红色;
利用稀盐酸除铁锈。
②【分析】
反应结束后,将D、E中的废液倒入同一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成,说明D中碳酸钠过量,E中稀盐酸过量,碳酸钠和稀盐酸反应后碳酸钠过量,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;
无色滤液中一定不含HCl,这是因为如果稀盐酸过量,则碳酸钠和氯化钙反应生成的碳酸钙会和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:
CaCO3+2HCl═CaCl2+H2O+CO2↑。
【作出猜想】
猜想④一定不正确,这是因为氯化钙和碳酸钠不能共存。
④。
取少量滤液于试管中,滴加少量碳酸钠溶液,无明显现象,说明滤液中不含有氯化钙;
取少量滤液于试管中,滴加少量稀盐酸,产生气泡,说明滤液中含有碳酸钠,实验过程如下所示:
猜想③成立
取少量滤液于试管中,滴加少量稀盐酸
25.【解答】解:
①甲中碳酸钠溶液显碱性,加入酚酞时,溶液显红色;
乙和丙中反应都能够生成碳酸钙沉淀,都能观察到的实验现象是产生白色沉淀;
乙中碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,发生反应的化学方程式是:
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,属于复分解反应。
红;
产生白色沉淀;
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
复分解。
②实验结束后,将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色说明溶液显碱性;
静置,取上层清液于试管中,加入过量氯化钡溶液,有白色沉淀,说明溶液中含有碳酸钠,溶液呈红色,说明溶液显碱性,即含有碳酸钠和氢氧化钙反应生成的氢氧化钠;
则废液缸中的废液一定含有指示剂、水、碳酸钙、反应生成的氯化钠氯化钠、过量的碳酸钠、反应生成的氢氧化钠;
在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑反应物是否过量。
氯化钠、碳酸钠、氢氧化钠;
反应物是否过量。
稀盐酸过量时溶质是NaCl、CaCl2、HCl;
溶质是NaCl、NaOH、Na2CO3;
假设3:
碳酸钠和稀盐酸恰好完全反应时溶质是NaCl、CaCl2。
NaCl、CaCl2。
【讨论】
上述假设中,假设2一定不合理,理由是发现烧杯中有气泡产生,说明碳酸钠和氢氧化钙反应生成的氢氧化钠已经和稀盐酸完全反应。
假设2;
有气泡产生,说明氢氧化钠已被消耗完。
【实验】
取烧杯中少量液体于试管中,滴入石蕊试液,溶液变红色,说明溶液中含有盐酸,实验过程如下所示:
取烧杯中少量液体于试管中,滴入石蕊试液
溶液变红色
26.【解答】解:
碳酸钠溶液呈碱性,能使酚酞试液变红,故填:
碳酸钠能与盐酸反应生成二氧化碳气体,有气泡产生,故填:
盐酸;
氯化钡溶液能与碳酸钠溶液反应产生白色沉淀,故填:
氯化钡能与硫酸反应生成硫酸钡沉淀,故填:
要除去钡离子,可以加入硫酸钠溶液,故填:
B。
33.【解答】解:
(1)做对照试验的没有放其他溶质,所以是放入水的③;
(2)酸中都含有氢离子,才具有共性,所以试管②、⑤溶液变为红色,其原因是溶液中溶质都含有氢元素;
(3)碱性溶液能使石蕊试液变为蓝色,所以管⑥中溶液变为蓝色,说明碳酸钾溶液显碱性;
碳酸钾属于盐,含有钾元素,可做钾肥;
取该溶液灼烧,透过蓝色钴玻璃火焰呈紫色;
(4)反应物是硫酸和氢氧化钠,生成物是硫酸钠和水,所以方程式是:
H2SO4+2NaOH=Na2SO4+2H2O;
等质量的硫酸和氢氧化钠反应,碱过量,显碱性溶液变为蓝色;
(5)氢氧化钙与盐酸反应生成了氯化钙和水,碳酸钾和氢氧化钙反应生成碳酸钙和氢氧化钾,碳酸钾与盐酸反应生成氯化钾、水和二氧化碳;
因为溶液显红色,所以酸过量,不可能含有氢氧化钾,所以大烧杯的废液中除了石蕊外,一定还含有CaCl2、KCl、HCl。
(1)③
(2)H(3)碱性;
盐;
钾;
紫
(4)H2SO4+2NaOH=Na2SO4+2H2O;
C
(5)CaCl2、KCl、HCl